吡格列酮对人胰腺癌细胞株PANC-1增殖、凋亡的影响及分子机制研究
李俊玲 张敬毅 阚方功 翟爱娣 郝莹
作者单位:255200 淄博 山东省淄博市第一医院药学部
胰腺癌(pancreatic cancer)是消化道系统恶性程度较高的恶性肿瘤,预后较差[1]。2015年统计数据显示,我国胰腺癌病死率居肿瘤相关死亡的第6位[2]。临床上以吉西他滨(gemcitabine)等化疗药物治疗胰腺癌的效果不理想,患者总体生存期仅为6.8个月[3]。寻找新的有效抗胰腺癌药物,对提高患者生存时间,改善预后具有十分重要的意义。吡格列酮(pioglitazone)是噻唑烷二酮类药物,属于胰岛素增敏剂,临床上常用于治疗2型糖尿病[4]。近年来研究发现,吡格列酮可能通过上调PPARγ表达而抑制胃癌细胞生长,并促进细胞凋亡[5]。然而其在胰腺癌中的作用至今鲜有报道,基于此,本研究通过分析吡格列酮对人胰腺癌细胞株PANC-1增殖、凋亡的影响,旨在探讨吡格列酮对胰腺癌的分子作用机制,以期为临床诊治提供参考依据。
1 材料与方法
1.1 主要试剂
胰腺癌细胞株PANC-1购自北纳创联生物技术有限公司,吡格列酮(纯度98%)购自上海科顺生物科技有限公司,吉西他滨(纯度98%)购自上海恒斐生物科技有限公司,Bcl-2、Bax、caspase-3 抗体与 ERK、p-ERK抗体及β-actin购自赛默飞世尔科技(中国)有限公司,PI/RNase购自厦门研科生物技术有限公司,AnnexinVFITC/PI双染细胞凋亡检测试剂盒购自上海一基实业有限公司,RP-MI1640培养基购自上海研生实业有限公司,DAPI染色试剂盒购自上海贝博生物科技有限公司。
1.2 细胞培养
将胰腺癌细胞株PANC-1常规培养至RP-MI1640培养基(10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素),于37℃、5%CO2饱和湿度的培养箱中培养,待70%~80%细胞贴壁融合时,采用胰蛋白酶消化传代,取对数生长期细胞进行后续实验。
1.3 CCK-8法检测胰腺癌细胞增殖情况
调节细胞浓度,并以每孔1×103个/mL细胞接种于96孔板,随机分为0 μmol/L吡格列酮组、10 μmol/L吡格列酮组、20 μmol/L吡格列酮组、50μmol/L吡格列酮组、50 μmol/L吉西他滨组(以下实验均以此分组)。每组细胞设置6个复孔,并置于37℃、5%CO2饱和湿度的培养箱中培养。待细胞贴壁后,分别加入终浓度为0 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L 的吡格列酮及 50 μmol/L 的吉西他滨,分别于培养 0 h、12 h、24 h、48h、72h时,各孔细胞加入0.01mL的CCK-8,培养结束后,在全自动酶标仪上测定各孔吸光度值(OD490),计算细胞存活率(%)=OD490实验组/OD490空白对照组×100%(0 μmol/L 吡格列酮组为空白对照组,10 μmol/L吡格列酮组、20 μmol/L 吡格列酮组、50 μmol/L 吡格列酮组、50 μmol/L吉西他滨组为实验组),并筛选合适的药物作用时间。
1.4 流式细胞术检测胰腺癌细胞周期
将对数生长期细胞浓度调至1×105个/mL,并接种于6孔板中,按照1.3的方法分组,于常规37℃培养箱中培养,待细胞生长至90%融合时,分别加入终浓度为 0 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L 的吡格列酮及50 μmol/L的吉西他滨,继续培养48 h,然后收集各组细胞,PBS洗涤2次,弃上清液,70%酒精固定,4℃过夜,PBS洗涤后将细胞重悬于PI/RNase染色缓冲液中,37℃避光孵育30 min后,采用流式细胞仪检测,计算G0/G1期、S期、G2/M期细胞比例。每组实验均重复3次。
1.5 流式细胞仪检测胰腺癌细胞凋亡情况
将对数生长期细胞浓度调至1×105个/mL,接种于6孔板中,按照1.3的方法分组,以50 μmol/L吉西他滨及 0 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L 吡格列酮作用后,继续培养48 h。收集各组细胞,胰蛋白酶消化,1 000 r/min离心5 min,PBS洗涤2次,弃上清液,用500 μL结合缓冲液重悬细胞,加入5 μL AnnexinV/PITC 混匀,再加入 5 μL PI,混匀,避光、室温培养15 min后上流式细胞仪检测,检测细胞数约为1×104个/组。每组实验重复3次。
1.6 4,6-联脒-2-苯基吲哚染色法检测胰腺癌细胞凋亡形态学变化
将对数生长期细胞浓度调至1×105个/mL,接种在6孔培养板中,按照1.3中的方法分组,以50μmol/L吉西他滨及 0 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L 吡格列酮作用后,继续培养48 h。收集各组细胞,采用4,6-联脒-2-苯基吲哚(DAPI)染色试剂盒检测细胞凋亡形态学的变化,按试剂盒说明书检测。DAPI染色结果判定:正常细胞DAPI染色呈蓝白色荧光,早期凋亡细胞出现核浓缩,染色加深,晚期凋亡细胞表现为核碎裂呈大小不等的圆形小体,并被细胞膜包绕。
1.7 Western blot检测凋亡相关蛋白及MAPK/ERK信号通路相关蛋白的表达
将对数生长期细胞浓度调至1×105个/mL,接种在6孔培养板中,按照1.3中的方法分组,以50μmol/L吉西他滨及 0 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L 的吡格列酮处理后,继续培养48 h。收集各组细胞,PBS洗涤2次后,加裂解液,冰上裂解30 min,离心取上清液,以Lowry法进行蛋白定量。取50 μg蛋白样品进行SDS-PAGE电泳,然后取出凝胶,切胶,并将凝胶上的蛋白转移到硝酸纤维素膜上,在95 mA电流下转移3 h,5%脱脂牛奶封闭3 h,室温封闭1 h,加入一抗,4 ℃孵育过夜。TBST(0.1%Tween20)洗膜3次,加入相应二抗及TBST缓冲液,室温孵育2 h,TBST洗膜,ECL化学发光法显色,Quantity One凝胶成像分析软件拍照并分析各蛋白相对表达量,以β-actin作为内参照。每组实验重复3次。
1.8 统计学方法
采用SPSS 20.0处理数据。计量资料采用均数±标准差(x±s)表示,组间比较采用单因素方差分析,若组间差异有统计学意义,进一步的多重比较采用Bonferroni检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 吡格列酮对人胰腺癌PANC-1细胞增殖的影响
与 0 μmol/L 吡格列酮组相比,50 μmol/L 吉西他滨组及 10 μmol/L、20 μmol/L、50 μmol/L 吡格列酮组PANC-1细胞作用24 h、48 h、72 h的OD值均显著降低(P<0.05),且吡格列酮浓度越高,PANC-1细胞 OD值越低。与50 μmol/L吉西他滨组相比,10 μmol/L吡格列酮组PANC-1细胞作用24 h、48 h、72 h的OD值均升高(P<0.05),而 50 μmol/L 吡格列酮组 PANC-1细胞OD值均降低(P<0.05)。见表1。各组细胞作用48 h与72 h的OD值相差不大,表明细胞作用48 h后,增殖速度趋于平稳,因此本实验选择药物作用时间为48 h进行后续研究。
2.2 吡格列酮对人胰腺癌PANC-1细胞周期的影响
与 0 μmol/L 吡格列酮相比,50 μmol/L 吉西他滨及 10 μmol/L、20 μmol/L、50 μmol/L 吡格列酮作用于胰腺癌细胞后,G0/G1期细胞比例均显著升高(P<0.05),S期细胞比例显著降低(P<0.05),且吡格列酮浓度越高,G0/G1期细胞比例越高,S期细胞比例越低,各组G2/M期细胞比例差异无统计学意义(P>0.05)。与50 μmol/L 吉西他滨组相比,10 μmol/L 吡格列酮组G0/G1期细胞比例降低(P<0.05),S期细胞比例升高(P<0.05),而 20 μmol/L 吡格列酮组 G0/G1期、S期细胞比例差异无统计学意义(P>0.05),50 μmol/L 吡格列酮组G0/G1期细胞比例升高(P<0.05),S期细胞比例降低(P<0.05)。见图 1、表 2。

表1 吡格列酮对胰腺癌PANC-1细胞增殖的影响(x±s)Tab.1 Effects of pioglitazone on proliferation of human pancreatic cancer PANC-1 cells(x±s)

图1 吡格列酮对胰腺癌PANC-1细胞周期的影响Fig.1 Effect of pioglitazone on cell cycle of pancreatic cancer PANC-1
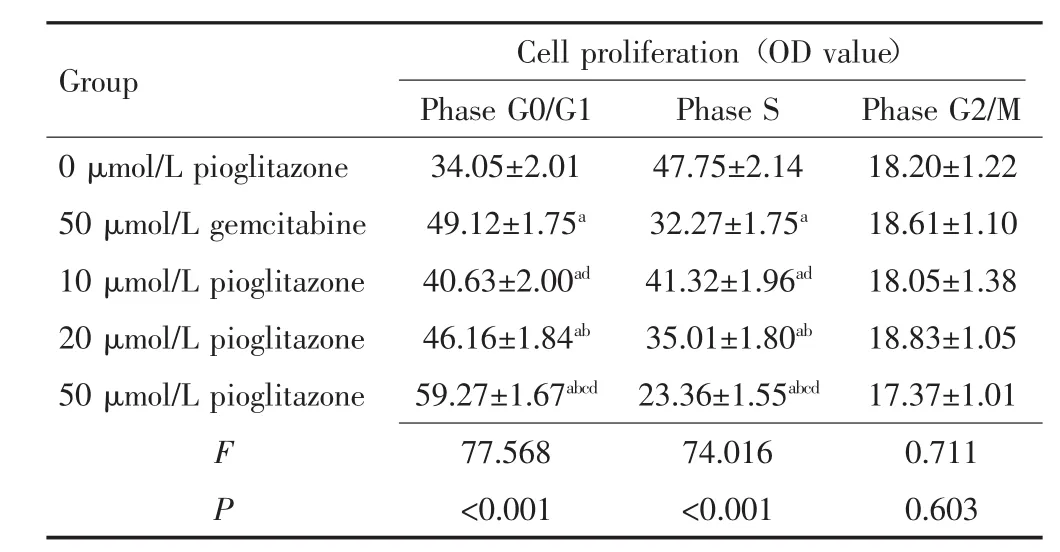
表2 吡格列酮对胰腺癌PANC-1细胞周期的影响(x±s)Tab.2 Effect of pioglitazone on cell cycle of pancreatic cancer PANC-1(x±s)
2.3 吡格列酮对胰腺癌PANC-1细胞凋亡的影响
与 0 μmol/L 吡格列酮组相比,50 μmol/L 吉西他滨及 10μmol/L、20μmol/L、50μmol/L吡格列酮作用胰腺癌细胞后,细胞凋亡率均升高(P<0.05),且吡格列酮浓度越高,细胞凋亡率越高。与50 μmol/L吉西他滨组相比,10 μmol/L、20 μmol/L 吡格列酮组细胞凋亡率均降低(P<0.05),而50 μmol/L 吡格列酮组细胞凋亡率升高(P<0.05)。见图 2、表 3。

表3 吡格列酮对胰腺癌PANC-1细胞凋亡的影响(x±s)Tab.3 Effect of pioglitazone on apoptosis of pancreatic cancer PANC-1 cells(x±s)

图2 吡格列酮对胰腺癌PANC-1细胞凋亡的影响Fig.2 Effects of pioglitazone on apoptosis of pancreatic cancer PANC-1 cells
2.4 吡格列酮对胰腺癌PANC-1细胞凋亡形态学的影响
在倒置荧光显微镜下用DAPI染色剂检查细胞凋亡的形态学特征,结果显示,与0 μmol/L吡格列酮相比,50 μmol/L 吉西他滨及 10 μmol/L、20 μmol/L、50 μmol/L吡格列酮作用胰腺癌细胞后,细胞收缩程度逐渐加重,蓝白色荧光逐渐加深,细胞核逐渐碎裂为大小不一的圆形小体,见图3。
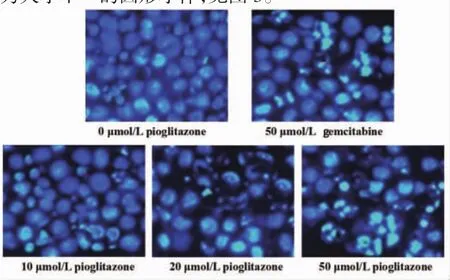
图3 吡格列酮对胰腺癌PANC-1细胞凋亡形态学的影响(×400)Fig.3 Effects of pioglitazone on apoptotic morphological of pancreatic cancer PANC-1 cells(×400)
2.5 吡格列酮对胰腺癌PANC-1细胞凋亡相关蛋白表达的影响
与 0 μmol/L吡格列酮相比,50 μmol/L吉西他滨及 10 μmol/L、20 μmol/L、50 μmol/L 吡格列酮作用胰腺癌细胞后,Bcl-2 蛋白表达降低(P<0.05),而 Bax、caspase-3蛋白表达增强(P<0.05),且吡格列酮浓度越高,细胞Bcl-2蛋白表达水平越低,Bax、caspase-3蛋白表达水平越高。与50 μmol/L吉西他滨组相比,10 μmol/L吡格列酮组细胞Bcl-2蛋白表达水平升高(P<0.05),而 Bax、caspase-3 蛋白表达水平均降低(P<0.05);50 μmol/L 吡格列酮组细胞 Bcl-2 蛋白表达水平降低(P<0.05),Bax、caspase-3蛋白表达水平均升高(P<0.05)。见图 4、表 4。

图4 吡格列酮对胰腺癌PANC-1细胞凋亡相关蛋白表达的影响Fig.4 Effects of pioglitazone on apoptosis-related protein expression in PANC-1 cells

表4 吡格列酮对胰腺癌PANC-1细胞中凋亡相关蛋白表达的影响(x±s)Tab.4 Effect of pioglitazone on apoptosis-related protein expression in PANC-1 cells(x±s)
2.6 吡格列酮对胰腺癌PANC-1细胞MAPK/ERK信号通路相关蛋白表达的影响
与 0 μmol/L吡格列酮相比,50 μmol/L吉西他滨及 10 μmol/L、20 μmol/L、50 μmol/L 吡格列酮作用胰腺癌细胞后,p-ERK蛋白表达水平升高(P<0.05),且吡格列酮浓度越高,p-ERK蛋白表达水平越高,各组ERK蛋白表达水平,差异无统计学意义(P>0.05)。与50 μmol/L吉西他滨组相比,10 μmol/L吡格列酮组细胞p-ERK 蛋白水平降低(P<0.05),20 μmol/L 吡格列酮组细胞p-ERK蛋白水平差异无统计学意义(P>0.05),而50 μmol/L吡格列酮组细胞p-ERK蛋白水平升高(P<0.05)。见图 5、表 5。

图5 吡格列酮对胰腺癌PANC-1细胞中MAPK/ERK信号通路相关蛋白表达的影响Fig.5 Effects of pioglitazone on the expression of MAPK/ERK signaling pathway-related proteins in PANC-1 cells
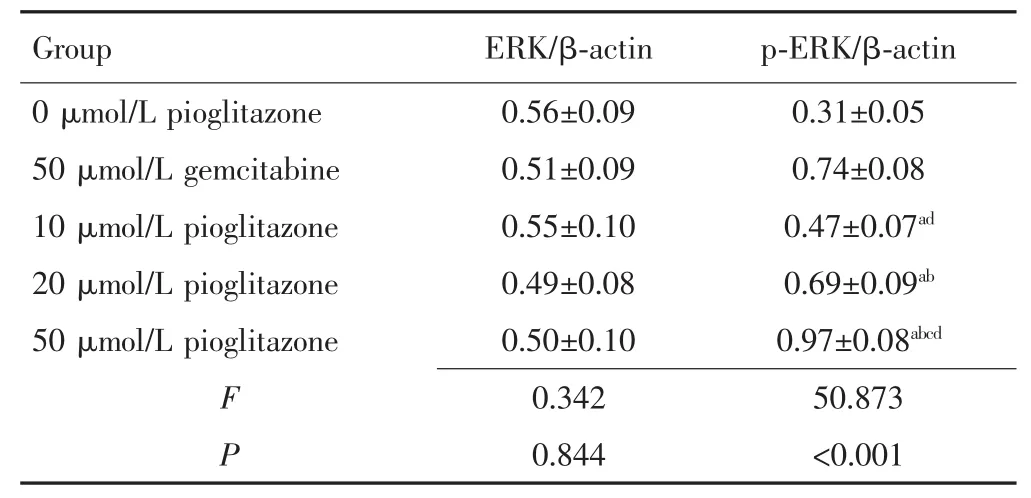
表5 吡格列酮对胰腺癌PANC-1细胞中MAPK/ERK信号通路相关蛋白表达的影响(x±s)Tab.5 Effects of pioglitazone on the expression of MAPK/ERK signaling pathway-related proteins in PANC-1 cells(x±s)
3 讨论
胰腺癌起病隐匿、侵袭性强、进展迅速、早期诊断困难、手术切除率低,且对放疗、化疗敏感性差[6]。5年生存率约为5%,手术切除后中位生存期仍不足2年,大多数患者因肿瘤复发或转移死亡[7]。目前临床上尚缺乏有效的治疗方案。吡格列酮为噻唑烷二酮类药物,具有抗氧化、抗炎及改善胰岛素抵抗和高血糖等功效[8],亦有研究表明吡格列酮可抑制成骨细胞增殖,并促进细胞凋亡[9]。只璟泰等[10]研究报道吡格列酮治疗甲状腺癌PAX8-PPARγ融合基因阳性患者可取得一定效果。李莉等[11]研究亦发现吡格列酮能够明显促进大鼠胰岛素瘤细胞凋亡并抑制其增殖。本研究结果显示,与0 μmol/L吡格列酮作用相比,50 μmol/L吉西他滨及 10 μmol/L、20 μmol/L、50 μmol/L 吡格列酮作用PANC-1细胞24 h、48 h、72 h后OD值均明显降低,且吡格列酮浓度越高,PANC-1细胞的OD值越低,与李莉等[11]研究结果相似。提示吡格列酮能够抑制胰腺癌细胞增殖,且吡格列酮浓度越高,其对胰腺癌细胞增殖抑制越明显,可能具有抗肿瘤作用。进一步采用流式细胞术检测胰腺癌细胞周期,发现与0 μmol/L吡格列酮作用相比,50 μmol/L吉西他滨、10μmol/L、20μmol/L、50μmol/L吡格列酮作用后G0/G1期细胞比例均升高,而S期细胞比例降低,说明吡格列酮作用胰腺癌细胞后,大部分细胞被阻滞在G0期、G1期,从而抑制细胞增殖。
正常条件下,细胞的凋亡与增殖维持着动态平衡。但在肿瘤组织中,这种平衡被打破,因此在肿瘤治疗中,诱导癌细胞凋亡是关键[12]。研究表明吡格列酮可能通过改变细胞膜电位,促进急性胰腺炎细胞凋亡[13]。本研究结果显示,与0 μmol/L吡格列酮相比,50 μmol/L 吉西他滨及 10 μmol/L、20 μmol/L、50 μmol/L吡格列酮作用后胰腺癌细胞凋亡率升高,且吡格列酮浓度越高,胰腺癌细胞凋亡率越高,提示吡格列酮可能促进胰腺癌细胞凋亡。王云等[14]研究亦表明吡格列酮能明显抑制肺癌细胞增殖,促进细胞凋亡。DAPI作为一种荧光染料,可以穿透细胞膜与细胞核中的双链DNA结合,进而发挥标记作用,在显微镜下可看到显蓝白色荧光的细胞,根据荧光的强度及细胞质、细胞核的形态可检测出细胞凋亡情况。因此,本研究采用DAPI细胞核染色观察细胞凋亡的形态学特征,发现与0 μmol/L吡格列酮作用相比,50 μmol/L吉西他滨及10 μmol/L、20 μmol/L、50 μmol/L 吡格列酮作用胰腺癌细胞后,细胞收缩程度逐渐加重,蓝白色荧光亦逐渐加深,细胞核逐渐碎裂为大小不一的圆形小体。说明胰腺癌DANC-1细胞在不同浓度吡格列酮作用下,细胞凋亡程度逐渐加重。
为进一步探索胰腺癌细胞凋亡的分子机制,本研究检测凋亡相关基因Bcl-2、Bax、caspase-3等的表达情况。其中Bcl-2是常见促凋亡基因;Bax基因具有抗Bcl-2蛋白、诱导细胞凋亡的作用[15-16];caspase-3是细胞凋亡过程中最重要的剪切酶,在细胞凋亡中具有重要的作用[17]。本研究Western blot实验结果显示,与0μmol/L吡格列酮相比,50μmol/L吉西他滨及10μmol/L、20 μmol/L、50 μmol/L 吡格列酮作用 PANC-1 细胞后Bcl-2蛋白表达水平均降低,而Bax、caspase-3表达均增强,且吡格列酮作用浓度越高Bcl-2蛋白表达水平越低,Bax、caspase-3表达水平越高,提示吡格列酮作用后可能通过抑制抗凋亡蛋白表达,增强促凋亡蛋白表达,从而促进肿瘤细胞凋亡。MAPK/ERK是细胞外调节蛋白激酶信号,亦是调节细胞凋亡的重要通路[18]。其中p-ERK蛋白水平是反映MAPK/ERK信号通路激活情况的重要指标[19]。YI等[20]研究表明吡格列酮能够剂量依赖性地抑制人子宫平滑肌肉瘤SK-UT-1细胞p-ERK蛋白的表达。本研究结果显示,与0μmol/L吡格列酮相比,50 μmol/L 吉西他滨及 10 μmol/L、20 μmol/L、50 μmol/L吡格列酮作用后 PANC-1细胞 p-ERK蛋白表达水平降低,且吡格列酮浓度越高,p-ERK蛋白表达水平越低,提示MAPK/ERK信号通路活化可能参与胰腺癌PANC-1细胞凋亡过程。
综上所述,吡格列酮能抑制胰腺癌细胞PANC-1增殖,并诱导其凋亡,吡格列酮可能通过调控凋亡相关蛋白及MAPK/ERK通路而诱导胰腺癌细胞PANC-1凋亡,吡格列酮调控胰腺癌细胞增殖与凋亡的机制十分复杂,具体调控机制仍需进一步探索。

