五种国产甘胆酸均相酶免疫法检测试剂的分析性能验证*
张曙晴,张骆军
(南通市第二人民医院检验科,江苏南通 226002)
甘胆酸(CG)是胆酸与甘氨酸结合而成的结合型胆酸,也是胆汁酸的主要成分,肝脏是其代谢的重要器官。当肝细胞受损时,肝细胞摄取CG的能力下降,致使血中CG含量升高[1],故临床常将CG作为肝细胞损害的指标,同时CG也可作为肝病严重程度以及肝损伤疾病鉴别诊断的指标[2]。目前CG检测的常规方法主要有放射免疫法、胶乳增强免疫比浊法和均相酶免疫法,放射免疫法试剂稳定性差、检测用时长、环境要求高,临床广泛应用受限,胶乳增强免疫比浊法试剂性能劣于均相酶免疫法[3-4],故均相酶免疫法更能满足临床检测CG的需求。本研究按照美国临床实验室标准化委员会(NCCLS)的相关文件要求,以我室当前使用的苏州博源公司CG试剂为参考试剂,将其与其它四个厂家的试剂进行性能验证、分析比对,为临床实验室选择适合自己实验室的CG试剂提供参考。
1材料与方法
1.1 研究对象
1.1.1 所有标本均为清晨空腹8 h后采集静脉血,并立即离心分离血清,避免使用溶血、脂血、黄疸标本,血清分装后于-20℃冻存。
1.1.2 精密度验证标本:选取3份高、中、低浓度的CG血清,分别为0.9 mg/L,2.8 mg/L和45.0 mg/L。
1.1.3 线性范围评价标本:选取接近试剂盒标注线性范围的高、低值血清标本各1份,低值为1号,高值为6号,二者再分别以4∶1,3∶2,2∶3,1∶4比例混匀,形成6个浓度梯度的混合血清。
1.1.4 比对标本:随机选取2018年6月我院住院患者新鲜血清40份,其中异常标本20份。
1.2 试剂与仪器 5种CG试剂均为均相酶免疫法,分别为A:苏州博源,B:安徽,C:浙江,D:重庆,E:贵州。各试剂均使用各自配套的校准品及质控品,按照厂家推荐的参数进行校准,检测各自配套的质控品且均在控。仪器为日立 HITACHI7600全自动生化分析仪。
1.3 方法
1.3.1 精密度评价:依据CLSI EP15-A文件所提供方案[5],用5种试剂分别测定高、中、低值3个水平的CG血清,连续测定5天,每天测4次,计算各试剂各水平的批内CV及总CV(CV%within,CV%total),并判断精密度是否符合厂家标注。
1.3.2 线性范围评价:依据CLSI EP6-A文件所提供方案[6],用5种试剂分别检测6个浓度梯度的混合血清,各浓度测定3次并计算平均值,检查离群值及重复性,将预期值与实测值进行曲线拟合,多元回归分析,以r2>0.95,斜率b在0.95~1.05范围内判断该试剂验证浓度范围内线性良好。
1.3.3 比对试验:依据CLSI EP9-A2文件所提供方案[7],用5种试剂分别检测40份比对血清,以A试剂测定结果为X,分别以B,C,D,E试剂结果为Y,绘制散点图,显示回归方程,计算平均绝对偏倚,以超过10%为标准判断两者是否等效。
1.3.4 一致率比较:将40份标本的比对结果分别按照各试剂提供的参考范围上限为标准,高于标准为阳性,低于标准为阴性,比较判定CG异常的一致率,并进行Kappa一致性检验,以Kappa值≥0.75表示两者一致性为优。
1.4 统计学分析 应用Microsoft EXCEL 2003及SPSS16.0软件进行统计学分析。采用K-S正态分布检验检查数据正态性,以P>0.05表示数据呈正态分布。相关性分析采用Pearson相关分析,以P<0.05表示差异具有统计学意义。线性回归采用简单线性回归分析,以P<0.05表示差异具有统计学意义。采用Kappa一致性检验比较各试剂与参考试剂判定异常时的一致性。
2结果
2.1 精密度评价 见表1。
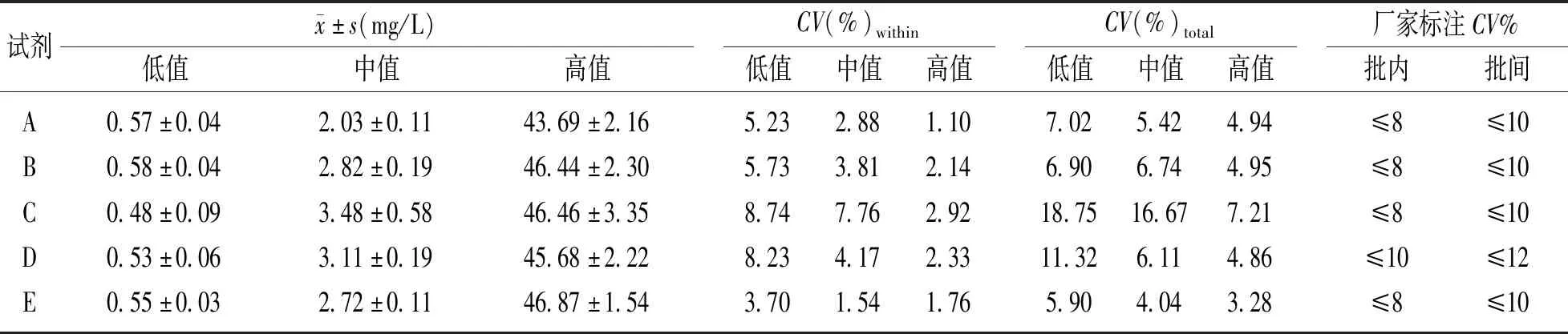
表1 五种试剂的精密度
A,B,D,E试剂实测精密度均小于试剂盒标注的精密度,其中E试剂CV%within及CV%total最小。C试剂低值CV%within和低、中值CV%total均高于厂家标注,精密度验证未通过。D试剂低值水平CV%total大于本实验室CG检测的最大允许误差(CV%total<10%)。
2.2 线性范围评价 A~E试剂线性范围分别为0.89~43.58 mg/L,0.90~44.72 mg/L,0.96~41.31 mg/L,0.82~42.29 mg/L和0.78~46.24 mg/L。CG实测值无明显离群值,最佳拟合方程为一次多项式,预期值与实测值拟合方程斜率b分别为1.038,0.964,0.908,0.984和1.040,r2为0.993~0.998,平均绝对偏差分别为4.16%,5.17%,8.85%,4.92%和4.38%。C试剂线性范围验证未通过。
2.3 比对试验 见图1。B,C,D,E试剂与A试剂比对结果。
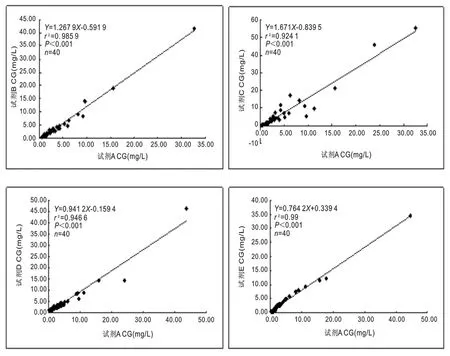
图1 B,C,D,E试剂与A试剂比对结果
B~E试剂与A试剂比对均呈良好的线性关系,r2为0.924~0.990,平均绝对偏倚分别为6.67%,36.3%,9.80%和16.45%,C,E试剂与A试剂结果不等效。
2.4 一致率比较 B~E试剂与A试剂一致率分别为90%,82.5%,82.5%和90%,经Kappa检验,Kappa值分别为0.80(P=0.000),0.65(P=0.000),0.65(P=0.000)和0.75(P=0.000),B,E试剂与A试剂一致性优。
3讨论机体内CG是由肝脏合成、分泌、摄取,胆管胆囊参与排泄,临床多种常见的肝胆疾病(如急慢性肝炎、肝硬化、胆石症等)血液中CG均显著升高,且具有出现早、消退晚、敏感度高的优点[8]。妊娠中晚期,产科常用CG来反映妊娠期肝内胆汁淤积症的严重程度以及预测是否发生胎儿窘迫[9-10]。同时CG也作为判断肠道恶性肿瘤发生、诊疗效果及预后的指标[11]。因此实验室开展CG检测,对多种疾病的诊断、治疗、预后判断均具有指导意义。
临床检测CG广泛使用均相酶免疫法,它采用酶标记半抗原和标本中未标记半抗原与定量抗体竞争性结合,推算标本中半抗原的含量。该方法敏感度高、稳定、方便。本室参考CLSI文件,对国内常见的5种CG试剂精密度、线性范围进行验证,并对结果进行比对。研究表明除C试剂外,其它试剂精密度验证均通过,但D试剂在低值水平处CV%值大于本室CG的最大允许误差。故在本实验室现有的日常常规检测条件下,A,B,E试剂均可满足临床需要,尤以E试剂最佳。C试剂精密度验证未通过,观察数据我们发现,C试剂从检测第4天起,低、中值水平检测结果轻微下降,而第5天各批次血清下降更为明显,最终导致总变异上升超标。考虑一方面各厂家试剂存在差异,开瓶后稳定期不同,另一方面我室试剂开瓶上机后,试剂存储的环境波动以及反复接触检测的过程中,可能存在累积污染,C试剂更易引起变质。具体原因还有待进一步研究考证。
A,B,D,E试剂线性范围良好,验证通过,但C试剂在低值处多点偏差大于可接受范围,验证未能通过。所以我们应当注意厂家提供的线性范围是在特定仪器及环境中制定的,同一试剂在不同实验室、不同仪器上检测时,线性范围存在一定差异,故各实验室初次使用某厂家试剂时,不能盲目采用说明书上标注的,应进行线性范围验证。
比对试验中,B~E试剂与A试剂均线性关系良好,但C,E试剂平均绝对偏倚都超过10%,所以C,E试剂与A试剂结果不等效,故我们在临床应用时应注意结果不可比。异常一致性比较中,C,D试剂与A试剂一致性中等,故实验室应用C,D试剂时应建立自己的参考范围,并验证临床适用性。
通过此次验证实验,我们发现不同厂家的CG试剂各项性能略有不同,建议临床检测CG时,各实验室对试剂和仪器组成的检测系统应进行综合性能验证,选用适合自己实验室的试剂,提高检测的准确性,为临床提供更优质的服务。

