米槁幼苗光合色素与光合特征对干旱胁迫的响应
刘济明 李佳 文爱华 邓明明
摘要:以一年生米槁幼苗为研究对象,研究盆栽下3种不同土壤相对含水量对米槁幼苗叶片相对含水量、叶绿素含量、光合生理指标变化趋势以及光响应特征的影响。结果表明,(1)米槁幼苗叶片相对含水量随土壤干旱胁迫加剧而明显降低,但下降幅度小于土壤相对含水量的下降幅度,表明米槁幼苗遭受干旱胁迫时叶片具有一定的保水能力。(2)米槁幼苗葉片相对含水量与净光合速率极显著正相关,是影响叶片净光合速率的重要因子。(3)随着干旱胁迫的加剧,叶绿素(Chl)、叶绿素a(Chla)、类胡萝卜素(Car)、叶片水分利用率(WUE)、胞间CO2浓度(Ci)逐渐升高,叶绿素Chla/b先减少后升高,净光合速率(Pn)随干旱胁迫加重而逐渐降低,气孔导度(Gs)和蒸腾速率(Tr)先降低后升高。可见土壤含水量直接影响植物各项光合生理指标,从而影响植物的光合作用。
关键词:米槁;含水量;生理指标;光合作用;干旱胁迫
中图分类号: S567.1+90.1文献标志码: A
文章编号:1002-1302(2019)09-0171-04
水分是植物生长发育过程中必不可少的因素,它参与细胞内的多种代谢活动,水分胁迫造成植物生长与生理生态发生显著变化[1-3]。全球气温升高,土壤干旱化越发严重[4],研究植物耐旱能力是植物生理生态学的重点问题[5]。植物的光合能力是植物能够生长发育的关键因素,也是植物在生长环境下生理状况的综合体现,可以衡量不同植物间的差异以及受环境胁迫的程度[6]。植物遭受长期水分胁迫时,常造成光合速率的下降[7]。植物的光合作用是一个复杂的生理过程,极易受到生态因子的影响。生态因子不仅直接影响光合作用的强弱,还间接改变植物体内的生理因子进而对光合作用产生影响[8]。
米槁(Cinnamomum migao H.W.Li)是一种常绿乔木,隶属于樟科樟属,别称麻告、大果樟,是贵州省苗族特色中药。米槁有驱寒、止痛、健脾等功效,苗族民间用米槁治疗胸痛、胸闷及哮喘,特别是对于确诊为冠心病、心绞痛的患者有明显的缓解作用[9-11]。米槁光合及水分生理特性的研究至今甚少有报道,而国内外对樟科植物的研究主要集中于药用价值的开发。本试验以一年生的米槁幼苗为材料,进行盆栽控水干旱处理,探究干旱胁迫与米槁光合作用的相关性。
1 材料与方法
1.1 材料
试验于2015年6—10月在贵州大学进行。材料为长势良好且较为一致的一年生米槁幼苗,取自贵州省罗甸县的米槁基地,种植于底部内径为24 cm、盆口内径为29 cm、高为 27 cm 的花盆。
1.2 试验设计
设置3个土壤水分梯度处理,对照(W1)土壤相对含水量为(80±5)%;中度胁迫(W2)相对含水量为(60±5)%;重度胁迫(W3)相对含水量为(35±5)%,每个处理20盆。采用盆栽称质量控水法[12]确定盆栽总质量,各处理组质量分别控制为11.025、10.524、9.860 kg。每20 d对光合和水分生理生化指标进行测定。每2次试验数据作为试验处理的1个时期,分前、中、后3个试验阶段。
1.3 测定指标和测定方法
1.3.1 叶片相对含水量
参照邹琦的方法[13]测定叶片相对含水量(relative water content,RWC)。
RWC=(叶片鲜质量-叶片干质量)/(叶片饱和鲜质量-叶片干质量)×100%。
1.3.2 光合色素含量
利用可见分光光度计测定并记录数据。最后根据计算公式测定各处理组下叶片叶绿素a(Chla)含量、叶绿素b(Chlb)含量、叶绿素(Chl)总含量以及类胡萝卜素(Car)含量。
Chla含量(mg/L)=13.95D665 nm-6.88D649 nm;
Chlb含量(mg/L)=24.96D649 nm-7.32D665nm;
Car含量(mg/L)=(1 000D470 nm-2.05Chla-114Chlb)/245;
Chl含量(mg/g)=Chla含量+Chlb含量;
光合色素含量(mg/g)=(色素浓度C×提取液体积V)/样品鲜质量。
其中提取液体积单位为mL,样品鲜质量单位为g。
1.3.3 光合作用光响应测定:采用美国LI-COR公司生产的Li-6400光合作用测定系统进行测定。选择在连续晴朗无风(微风)的天气内,于09:00—11:30之间进行光响应测定。选取受光方向一致的上部叶片,每个处理设置3盆,每盆3张长势相同的叶片,共9张。测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)等光合指标,气体流速设置为500 μmol/s,叶室中CO2浓度控制在(380±2) μmol/mol,空气相对湿度处于(65±5)%,叶片温度控制为(20±0.5) ℃,在该条件下采用1 500 μmol/(m2·s)光照度活化10 min。在上述设置的条件控制下,对光合测定系统的02B-LED红蓝光源进行设定,米槁属阳性植物,其叶片光饱和点较高,2 000 μmol/(m2·s)以内都为其可以接受的光合有效辐射(PAR)范围[14]。用光合测定仪自动记录净光合速率、气孔导度、胞间CO2浓度、蒸腾速率等光合参数,最终选取平均值进行分析。根据测得数据计算叶片水分利用率(WUE):WUE=Pn/Tr[15]。
1.4 数据处理与分析
使用Excel整理数据,用SPSS 19.0软件进行数据分析。
2 结果与分析
2.1 干旱处理对叶片相对含水量的影响
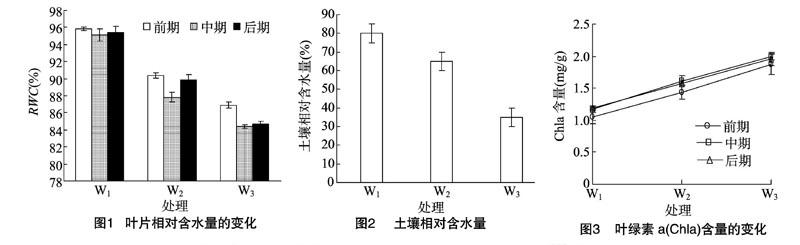
细胞水分含量常表示为相对含水量,植物细胞遭受环境胁迫时,RWC变化范围可从100%到50%或更低[16]。由图1可以看出,RWC随土壤含水量的降低呈明显的下降趋势,但是下降幅度较土壤含水量下降幅度要小。与W1相比,W2和W3处理下叶片相对含水量下降了4~10百分点,但是土壤相对含水量相差15百分点和40百分点(图2),说明米槁幼苗具有一定的保水性。
2.2 干旱处理对米槁幼苗光合色素的影响
2.2.1 不同处理对光合色素的影响 光合色素是植物将无机物转变成有机物的关键介质,是反映植物光合作用能力及营养作用的重要指标之一,包括叶绿素和类胡萝卜素,它们的含量以及各组分的比例对植物光合作用有很大影响,在一定程度上影响植株的正常生长和抗逆性[17]。图3可见,在不同处理下,随着处理时间的延长,Chla含量呈线性上升趋势。在重度干旱胁迫下Chla的含量达到最大,试验中期和后期含量较前期大,可能是植株为抵御干旱造成的损伤,通过增加叶绿素a吸收更多的光量子。由此可以看出,米槁叶片Chla的含量对干旱胁迫处理并不敏感。比较图3、图4和图5,各胁迫处理下,Chla含量均占叶绿素含量的64%以上。Chl含量的变化趋势与Chla的相一致。
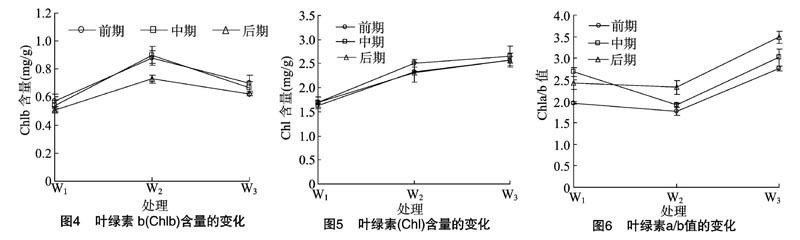
Chlb含量随土壤水分的减少先明显升高,随胁迫时间的延长而大致表现为下降趋势逐渐下降(图4)。中度胁迫(W2)下Chlb含量变化趋势最明显,在后期明显下降 0.17 mg/g。W1和W3处理下的Chlb含量变化无差异,Chlb含量对中度干旱胁迫较为敏感。
Chla/b值不仅可以反映Chla和Chlb的变化程度,还可以表示叶片的衰老程度[18],也表示叶绿素类囊体的叠加程度,Chla/b值越小,表明叠加程度越小,光抑制现象越严重[19]。因此,Chla/b值的改变在一定程度上体现了光合速率的强弱[20]。在图6中Chla/b随土壤水分的减少先减少后增加,中度干旱胁迫下植物出现光抑制的现象,但是在重度干旱胁迫下又上升,可能是米槁通过增加Chla的含量适应胁迫环境。
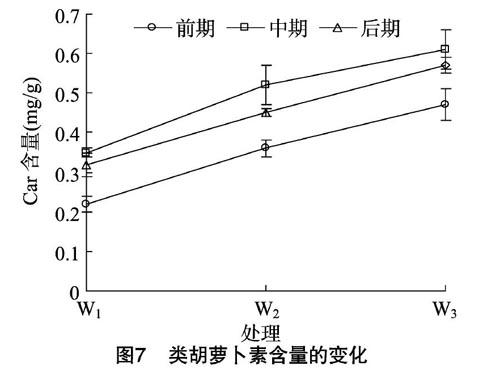
2.2.2 不同处理对类胡萝卜素的影响 类胡萝卜素的主要功能是清除体内活性氧,保护光合膜系统,在水分缺失时含量也会相应降低[21]。Car含量随着干旱程度的加剧都呈缓慢升高的趋势(图7),随胁迫时间的延长其增加幅度略有减小。Car会清除细胞内的活性氧,保护叶绿体光合膜系统,在遭受逆境胁迫时,米槁幼苗植株通过类胡萝卜素的积累来保護叶绿体,保证光合作用的发生,促进植物生长发育。
2.3 不同干旱胁迫处理对米槁幼苗光合生理指标的影响
由表1可见,米槁的净光合速率随着土壤水分减少而逐渐降低,并且处理间有显著差异。基于Pn和Tr计算的单位水平瞬时水分利用效率随水分的减少而逐渐上升。这与Pn的变化趋势相反。气孔是水分和空气中CO2气体密切联系的通道。植物的光合作用是通过气孔的传递进行的。随着水分的减少,气孔导度和蒸腾速率的变化一致,先减少后增加。在W1处理下蒸腾速率最大,说明适度的干旱胁迫有利于改善米槁叶片的蒸腾速率。重度干旱胁迫下叶片的蒸腾速率降低主要是由气孔导度的降低引起的。Tr的减少也是植物适应干旱胁迫的一种方式。胞间CO2的浓度随着干旱程度的增加而逐渐升高。
2.4 光合参数与光合色素相关性分析
从表2可以看出,Car与Chla和Chl之间具有极显著正相关(r≥0.899),与Pn、Gs、Ci、Tr、RWC呈负相关,与WUE呈正相关。Pn与RWC具有极显著的正相关,说明叶片相对含水量对米槁光合速率的影响较大。
3 讨论
叶片相对含水量作为水分生理指标,能够间接反映干旱胁迫下叶片水势的高低,以及随干旱胁迫的加深对叶片水分含量的影响。因此,干旱胁迫下植物叶片的相对含水量能反映植物的抗旱能力[22]。本研究中,RWC随土壤含水量的降低呈明显的下降趋势,但是下降幅度较土壤含水量的下降幅度要小。这与前人对油橄榄、高丛蓝莓等植物的研究结果[22-23]相一致,说明米槁具有一定的保水能力。并且米槁RWC与净光合速率具有极显著的正相关关系,是影响叶片净光合速率的重要因子。
光合色素是植物叶片进行光合作用的物质基础,光合色素的含量高低直接反映植株光合作用的强弱。其中叶绿素和类胡萝卜素与光合作用密切相关,叶绿素和类胡萝卜素的含量以及各组分的比例对植物光合作用水平有很大影响,在一定程度上可以直接影响植株的正常生长和抗逆性[17]。Rosevear等研究发现,影响色素构成的主要原因不是物种的生态来源,而是其生长的条件[24]。干旱胁迫已经成为制约光合作用的一个重要因素,干旱胁迫会导致叶绿素含量降低,严重缺水时不仅影响叶绿素的合成,还会加快降解已经合成的叶绿素[25-26],造成叶片发黄,而类胡萝卜素的主要功能是清除体内活性氧,保护光合膜系统,在水分缺失时含量也相应降低[21,27]。本试验中随着干旱胁迫的加剧,Chla、Chl、Car含量逐渐升高,随着胁迫时间的延长而逐渐上升。这与他人的研究不同,可能是因为米槁通过增加光合色素的含量来缓解干旱胁迫。Chlb含量则先升高再下降,张明生等研究发现,Chla/b相较于CK下降幅度越大,物种抗旱性越强[28]。本研究中叶绿素Chla/b则随着干旱处理先降低后升高,在W3水分处理下比值最高。说明米槁具有一定的抗旱性。各指标表明米槁为抵抗干旱胁迫而使体内的光合生理机制发生了相应的变化。米槁幼苗通过增加Chla、Car的含量来保证植物光合作用的正常进行。
Pn随着水分减少而逐渐降低,Gs和Tr具有相同的变化趋势,都随着水分的减少而先降低后升高,Ci则先升高后降低,WUE与Pn正好相反,呈逐渐增加的趋势。干旱胁迫下,光合速率的下降是由气孔限制或非气孔限制造成的[29]。研究发现,在轻度的干旱胁迫下气孔限制是光合速率下降的原因[30-32],而严重的干旱胁迫其主要原因是非气孔限制。Farquhar等认为,可分析Gs和Ci的变化趋势是否一致,Gs降低而Ci升高或不变为非气孔限制,Gs降低伴随着Ci降低为气孔限制[33]。但是当气孔限制和非气孔限制这2种因素同时存在时,胞间CO2浓度变化的方向取决于占优势的因素[34]。本研究中,Gs与Ci的变化趋势完全相反,则米槁在干旱胁迫的环境下光合速率下降是因为非气孔限制因素占优势,可能是由叶肉细胞光合活性的下降引起的。米槁在重度干旱胁迫下WUE上升,是气孔关闭造成,这也造成植物光合速率的降低。
4 结论
米槁幼苗叶片相对含水量随土壤干旱胁迫加剧而明显降低,但下降幅度小于土壤含水量的下降幅度,表明米槁幼苗遭受干旱胁迫时叶片具有一定的保水能力。米槁幼苗叶片相对含水量与净光合速率具有极显著的正相关关系,是影响叶片净光合速率的重要因子。
参考文献:
[1]利容千,王建波. 植物逆境细胞及生理学[M]. 武汉:武汉大学出版社,2002:55-56.
[2]张志良,瞿伟菁. 植物生理学实验指导[M]. 3版.台北:艺轩图书出版社,2009:75-125.
[3]惠竹梅,房玉林,郭玉枝,等. 水分胁迫对葡萄幼苗4种主要生理指标的影响[J]. 干旱地区农业研究,2007,25(3):146-149.
[4]Bohnert H R. Stratigies for engineering water-stress tolerance in plants[J]. Trend in Biotechnology,1996,14:89-97.
[5]張正斌. 作物抗旱节水的生理遗传育种基础[M]. 北京:科学出版社,2003:34-35.
[6]赵 琳,郎南军,温绍龙,等. 云南干热河谷4种植物抗旱机理的研究[J]. 西部林业科学,2006,35(2):9-16.
[7]Guo W H,Li B,Huang Y M,et al. Effects of different water stress on eco-physiological characteristics of Hippophae rhamnoides seedings[J]. Acta Botanic Sinica,2003,45:1238-1244.
[8]刘应迪,陈 军,张丽娟,等. 两种匍灯藓属植物夏季和冬季光合特性的比较研究[J]. 应用生态学报,2001,12(1):39-42.
[9]冉先德. 中华药海[M]. 上海:东方出版社,2010:45-49.
[10]赵 山,李鸿玉,刘 宁,等. 大果木姜子原植物、同功品种及易混品种的研究[J]. 贵阳中医学院学报,1990,4(2):60-64.
[11]郑亚玉,邱德文,粱光义,等. 贵州苗药大果木姜子的研究及产业化[J]. 世界科学技术-中医药现代化,2005,7(2):112-114.
[12]国 琳,张劲松,孟 平,等. 山茱萸光合及水分利用特征对土壤水分胁迫的响应[J]. 河北农业大学学报,2010,33(1):21-26.
[13]邹 琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2000:11-12.
[14]Demmi A B,Adams W. Photo protection and other responses of plant in light stress[J]. Ann Rev Plant Physical Plant Mol Biol,1992,43:599-626.
[15]何春霞,李吉跃,郭 明,等. 4种乔木叶片光合特性和水分利用效率随树高的变化[J]. 生态学报,2008,28(7):3008-3016.
[16]Lawlor D W,Cornic G. Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants[J]. Plant Cell and Environment,2002,25:275-294.
[17]孙小玲,许岳飞,马鲁沂,等. 植株叶片的光合色素构成对遮阴的响应[J]. 植物生态学报,2010,34(8):989-999.
[18]Woolhouse H W. Longevity and senescence in plants[J]. Science Progress,1974,61:123-147.
[19]郭书奎,赵可夫. NaCl胁迫抑制玉米幼苗光合作用的可能机理[J]. 植物生理学报,2001,27(6):461-466.
[20]杨逢建,庞海河,张学科,等. 光胁迫对南方红豆杉叶片中叶绿体色素和紫杉醇含量的影响[J]. 植物研究,2007,27(5):556-558.
[21]王竹承,梁宗锁,丁永华. 水分胁迫对菘蓝幼苗生长和生理特性的影响[J]. 西北农业学报,2010,19(12):98-103.
[22]兰 艳,徐应杰,谭 枫,等. 干旱胁迫下油橄榄品种光合特性研究[J]. 西北植物学报,2016,36(11):2247-2255.
[23]陈文荣,曾玮玮,李云霞,等. 高丛蓝莓对干旱胁迫的生理响应及其抗旱性综合评价[J]. 园艺学报,2012,39(4):637-646.
[24]Rosevear M J,Young A J,Johnson G N. Growth conditions are more important than species origin in determining leaf pigment content of British plant species[J]. Functional Ecology,2001,15:474-480.
[25]Gratani L,Varone L. Leaf key traits of Erica arborea L.,Erica multiflora L. and Rosmarinus officinalis L. co-occurring in the Mediterranean maquis[J]. Flora-Morphology,Distribution,Functional Ecology of Plants,2004,199(1):58-69.
[26]Jeon M W,Ali M B,Hahn E J,et al. Photosynthetic pigments,morphology and leaf gas exchange during ex vitro acclimatization of micropropagated CAM Doritaenopsis plantlets under relative humidity and air temperature[J]. Environmental and Experimental Botany,2006,55(1/2):183-194.
[27]赵黎芳,张金政,张启翔,等. 水分胁迫下扶芳藤幼苗保护酶活性和渗透调节物质的变化[J]. 植物研究,2003,23(4):437-442.
[28]張明生,谈 锋. 水分胁迫下甘薯叶绿素a/b比值的变化及其与抗旱性的关系[J]. 种子,2001,20(4):23-25.
[29]Huber S C,Moreland D. Co-transport of potassium and sugars across the plasmelemma of mesophyll protoplasts[J]. Plant Physiology,1981,67(1):163-169.
[30]Ni B R,Pallardy S G. Stomatal and nonstomatal limitations to net photosynthesis in seeding of woody angiosperms[J]. Plant Physiology,1992,99:1502-1508.
[31]陈剑成,罗 睿,瞿印权,等. 干旱胁迫对凹叶厚朴光合生理特性的影响[J]. 江苏农业科学,2017,45(13):114-119.
[32]杨 菲,李蓓蓓,何辰宇. 高温干旱对茶树生长和品质影响机理的研究进展[J]. 江苏农业科学,2017,45(3):10-13,40.
[33]Farquhar G D. Carbon isotope discrimination and photosynthesis[J]. Annu Rev Plant Physiology,1989,40:503-537.
[34]柯世省. 干旱胁迫对夏蜡梅光合特性的影响[J]. 西北植物学报,2007,27(6):1209-1215.

