复发转移性头颈部鳞癌的免疫治疗进展
郭晔,白春梅,李志铭 综述,郭晔 审校
200120 上海,同济大学附属东方医院·上海市东方医院 肿瘤科(郭晔);100032 北京,北京协和医院 肿瘤内科(白春梅);510060 广州,中山大学肿瘤防治中心 肿瘤内科(李志铭)
头颈部鳞癌(squamous cell carcinoma of head and neck,SCCHN)是常见恶性肿瘤之一。据估算,2016年全球约有65万新发唇、口腔和咽喉癌患者,约有36万患者因这些部位的癌症死亡[1]。其中90%以上的病理类型为鳞癌[2]。2015年,中国约有新发唇、口腔、咽喉癌症(除外鼻咽癌)患者74 500例,死亡患者36 600例[3]。近年来,欧美国家人乳头瘤状病毒(human papillomavirus,HPV)相关口咽癌发病率明显上升[4]。中国2003~2007年期间口咽癌发病率略有升高[5]。近期发表的荟萃分析显示,在28项临床研究中纳入的2 896例SCCHN中国患者中,HPV 16感染阳性率为24.7%[6]。
超过60%的SCCHN患者在确诊时为局部晚期或转移性疾病(UICC/AJCC TNM III期和IV期)[7-8]。传统手术、放化疗等治疗手段用于晚期患者的效果仍有待提高,5年总生存(overall survival, OS)率< 50%[9]。局部晚期SCCHN患者接受标准治疗后局部/区域性肿瘤复发率约为50%~60%[10],远处转移复发率约为4%~26%[11]。复发和转移性SCCHN患者可选的治疗方式和治疗效果非常有限,存在较大的未满足治疗需求,而免疫治疗为这些患者提供了新的治疗选择和改善预后的希望。本文将首先概述复发/转移性SCCHN的治疗演变和全身治疗现状,然后对这一人群的免疫治疗现状作一介绍。
1 复发/转移性SCCHN治疗的演变和现状
表1展示了在美国和欧洲获批的SCCHN全身治疗药物概况。从最初的抗肿瘤代谢药,到基于铂类的联合化疗,再到肿瘤靶向治疗药物,直至近年来获批的免疫检查点抑制剂,SCCHN的全身治疗已经历了多个阶段的演变[12]。
表1 晚期SCCHN的全身治疗药物

药物适应证FDA获批时间EMA获批时间甲氨蝶呤晚期SCCHN1959年不详羟基脲联合同步放化疗用于局部晚期SCCHN1967年不详博来霉素晚期SCCHN1973年不详顺铂+多西他赛+5-氟尿嘧啶不可切除的局部晚期SCCHN的诱导化疗2006年2007年西妥昔单抗联合同步放化疗用于局部晚期SCCHN联合化疗用于复发/转移性SCCHN2006年2006年2006年2008年纳武利尤单抗含铂化疗期间或其后发生疾病进展的复发/转移性SCCHN2016年2017年帕博利珠单抗含铂化疗期间或其后发生疾病进展的复发/转移性SCCHN2016年2018年
EMA:欧洲药品管理局;FDA:美国食品和药品监督管理局;SCCHN:头颈部鳞癌。
尽管如此,复发/转移性SCCHN患者的治疗仍存在较大挑战。仅少数复发SCCHN患者有条件再次接受根治性手术或放疗,大多数复发和所有转移性SCCHN患者需要接受全身治疗或最佳支持治疗[13]。
化疗方案通常需要根据患者的具体瘤种、体能状态和治疗目标个体化制定。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[2]推荐的一线联合治疗方案包括顺铂/卡铂联合5-氟尿嘧啶(fluorouracil,5-FU)和西妥昔单抗、顺铂/卡铂联合多西他赛/紫杉醇、顺铂/卡铂联合西妥昔单抗、顺铂联合5-FU、顺铂/卡铂联合多西他赛/紫杉醇和西妥昔单抗、顺铂联合吉西他滨以及卡铂联合西妥昔单抗。对联合治疗耐受不佳的患者可选择顺铂、卡铂、紫杉醇、多西他赛、5-FU、甲氨蝶呤、西妥昔单抗、吉西他滨或卡培他滨作为一线单药治疗[2]。但一线全身治疗的应答维持时间有限,在III期临床试验中,接受铂类联合5-FU和西妥昔单抗一线治疗患者的中位OS为10.1个月,中位无进展生存时间(progression-free survival,PFS)为5.6月[14]。
对于一线铂类药物治疗失败的复发/转移性SCCHN,目前国内缺乏标准的治疗方案[13]。NCCN指南[2]建议,非鼻咽癌SCCHN患者铂类药物治疗失败后可优选纳武利尤单抗(1类推荐)、帕博利珠单抗(2A类推荐),也可在上述联合或单药方案中选择既往未使用过的药物或阿法替尼。
2 复发/转移性SCCHN免疫治疗现状
近年来免疫治疗发展迅速,已有多种药物获批用于不同的实体和血液肿瘤。以纳武利尤单抗和帕博利珠单抗为代表的免疫检查点程序性细胞死亡受体-1(programmed cell death-1,PD-1)抑制剂可有效改善铂类治疗失败的复发/转移性SCCHN患者的生存预后,同时具有较好的安全性,突破了自西妥昔单抗以来近10年无新药获批的瓶颈。
2.1 铂类治疗失败的挽救治疗
2.1.1 纳武利尤单抗 在前瞻性III期随机对照临床试验CheckMate-141研究[15]中,含铂化疗后6个月内出现疾病进展的复发/转移性SCCHN患者(n=361)接受纳武利尤单抗治疗后,生存结局优于研究者选择的标准单药化疗对照组,中位OS分别为7.5月和5.1月,差异有统计学意义(P=0.01),1年OS率分别为36.0%和16.6%。两组患者6个月PFS率分别为19.7%和9.9%,客观缓解率(objective response rate,ORR)分别为13.3%和5.8%。基于在中期分析时提前达到预设的临床终点(OS),纳武利尤单抗提前获得美国食品和药品监督管理局(Food and Drug Administration,FDA)审批。亚洲患者亚组(n=34)中接受纳武利尤单抗治疗和对照组患者的中位OS分别为9.5月和6.2月(HR=0.50,95%CI:0.17~1.48),ORR分别为26.1%和0%[16]。CheckMate-141研究的2年随访[17]结果显示,接受纳武利尤单抗治疗的患者OS与对照组相比持续改善,中位OS分别为7.7月和5.1月(HR=0.68,95%CI:0.54~0.86),估算2年OS率分别为16.9%和6.0%,中位缓解持续时间(duration of response,DOR)分别为9.7月和4.0月。该长期随访研究还评估了PD-1配体PD-L1的表达比例和HPV对疗效的影响。结果显示,无论PD-L1表达≥1%还是<1%纳武利尤单抗治疗均有生存获益——在PD-L1≥1%患者中,纳武利尤单抗治疗组和对照组的中位OS分别为8.2月和4.7月(HR=0.55,95%CI:0.39~0.78);在PD-L1<1%患者中,两组的中位OS分别为6.5月和5.5月(HR=0.73,95%CI:0.49~1.09),HPV阴性和阳性患者也表现出相似的获益[17]。
在安全性方面,纳武利尤单抗治疗组患者3~4级治疗相关不良事件发生率低于对照组(总人群:13.1%vs35.1%;亚洲患者:8.7%vs27.3%),常见不良事件包括疲劳、恶心、皮疹、食欲减退和瘙痒[15-16]。纳武利尤单抗组和单药化疗组不良反应特征有明显不同。单药化疗组3~4级不良反应主要为中性粒细胞减少(7.2%)和贫血(4.5%),纳武利尤单抗组主要为疲劳(2.1%)和脂肪酶升高(1.7%)。与纳武利尤单抗组相比,单药化疗组有更多患者因治疗相关不良事件停药(4.2%vs9.0%)[17]。
此外,在纳武利尤单抗治疗期间,患者的健康相关生活质量(health-related quality of life,HRQoL)相对稳定,而单药化疗组患者HRQoL明显下降。与单药化疗对照组相比,纳武利尤单抗治疗可延长SCCHN患者的HRQoL衰退时间[18]。
2.1.2 帕博利珠单抗 在前瞻性III期随机对照临床试验KEYNOTE-040研究[19]中,含铂化疗期间或化疗后出现疾病进展的复发/转移性SCCHN患者(n=247)接受帕博利珠单抗治疗,OS较对照组(接受研究者选择的标准单药化疗)延长。在既定的最终分析时,两组患者的中位OS分别为8.4月和7.1月,HR为0.82,未达到研究方案既定的主要有效性终点(HR0.80)。在确认了12例最终分析时状态不明患者的生存信息后,两组患者的中位OS分别调整为8.4月和6.9月(HR=0.80,P=0.016),1年OS率分别为37.0%和26.5%。两组患者的缓解率分别为14.6%和10.1%(P=0.061),中位DOR分别为18.4月和5.0月[19]。
SCCHN患者的PD-L1状态对帕博利珠单抗的治疗效果有一定影响。在PD-L1阳性联合评分(combined positive score,CPS;定义为所有PD-L1阳性细胞除以肿瘤细胞总数乘以100)≥1分的患者中,帕博利珠单抗与对照组相比可改善生存结局(中位OS:8.7月vs7.1月,名义P=0.005);而在PD-L1 CPS<1分的患者中,两组OS无明显差异(中位OS:6.3月vs7.0月,P=0.848)[19]。在PD-L1肿瘤比例评分(tumour proportion score,TPS;定义为膜染色PD-L1阳性的肿瘤细胞占所有肿瘤细胞的比例)≥50%的患者中,帕博利珠单抗与对照组相比可改善OS(HR=0.53,95%CI0.35~0.81,名义P=0.001);而在PD-L1 TPS<50%的患者中,两组OS无明显差异(HR=0.93,95%CI0.73~1.17,名义P=0.268)。在帕博利珠单抗组中,肿瘤PD-L1表达阳性患者的缓解率高于阴性患者,而对照组的缓解率不受PD-L1状态影响。帕博利珠单抗治疗的DOR似乎不受PD-L1状态影响,但相关分析中纳入的患者数较少[19]。
在安全性方面,帕博利珠单抗组中≥3级治疗相关不良事件发生率低于对照组(13%vs36%),常见治疗相关不良事件包括甲状腺功能减退、疲劳、腹泻和皮疹。帕博利珠单抗组中1例患者发生致死性Stevens-Johnson综合征[19]。
2.1.3 Durvalumab和Tremelimumab 多项II期临床试验显示,PD-L1抑制剂Durvalumab单药或与细胞毒性T细胞相关抗原- 4(cytotoxic T-lymphocyte-associated antigen- 4,CTLA- 4)抑制剂Tremelimumab联合方案用于复发/转移性SCCHN患者的二线治疗具有一定前景[20-22]。例如1 108研究[22]显示,既往含铂化疗失败的复发/转移性SCCHN患者接受PD-L1抑制剂Durvalumab治疗后,中位OS为8.4月,ORR 6.5%,DOR 12.4月。在另一项HAWK研究[23]中,PD-L1比例≥25%且含铂化疗失败的复发/转移性SCCHN患者接受Durvalumab治疗后,中位OS为7.1月,ORR为16.2%,DOR为10.3月。还有一项CONDOR研究[24]显示,PD-L1比例<25%且含铂化疗失败的复发/转移性SCCHN患者接受Durvalumab单药、Tremelimumab单药和两药联合治疗后,中位OS分别为6.0月、5.5月和7.6月,三组之间无明显差异。在上述研究中,Durvalumab单药治疗组≥3级治疗不良事件发生率为8.0%~12.3%,联合治疗组为15.8%[20-22]。
但在III期临床试验EAGLE研究(NCT02369874)中,铂类化疗失败的复发/转移性SCCHN患者接受Durvalumab单药、Durvalumab联合Tremelimumab,或单药标准治疗,结果显示与标准治疗相比,免疫治疗单药或联合治疗组未达到OS获益的主要终点[23]。
2.1.4 Atezolizumab 另一种PD-L1抑制剂Atezolizumab在I期临床试验[24]中验证了其用于局部晚期或转移性不可切除SCCHN患者(n=32;绝大多数为经治患者)的安全性和有效性。入组患者的中位OS为6.0月,ORR为22%,DOR为7.4月[24]。患者的PD-L1表达水平或HPV状态对治疗应答无明显影响。共有3例患者发生3级治疗相关不良事件,1例发生4级治疗相关不良事件[24]。
2.1.5 Avelumab PD-L1抑制剂Avelumab在I期临床中[25-26]验证了其用于SCCHN患者的安全性,但目前尚未报告有效性数据。在纳入超过1 300例不同晚期实体瘤(包括铂类化疗失败后的复发/转移性SCCHN)的I期临床试验JAVELIN实体瘤研究中,Avelumab的最大耐受剂量未达到,9.5%的患者发生≥3级治疗相关不良事件。常见治疗相关不良事件包括疲劳、输注相关反应、恶心、寒战、腹泻和发热等[25-26]。
2.2 一线治疗
目前免疫检查点抑制剂用于复发/转移性SCCHN患者一线治疗的临床数据有限,大多数研究仍在进行中。
帕博利珠单抗单药或联合化疗用于复发/转移性SCCHN患者一线治疗(与铂类联合5-FU和西妥昔单抗方案对比)的III期KEYNOTE-048研究的中期分析结果[27]显示,在PD-L1 CPS≥1分和≥20分的患者中,帕博利珠单抗单药组的OS优于对照组,在总人群中,帕博利珠单抗单药组的OS不劣于对照组,帕博利珠单抗联合化疗组的OS优于对照组。但结论有待观察最终OS分析结果后确定。
纳武利尤单抗单药或联合ipilimumab用于复发/转移性SCCHN一线治疗的II期CheckMate 714研究正在进行中。该研究预计纳入315例患者,根据PD-L1、HPV状态和铂类难治(既往辅助治疗或局部晚期疾病的多模式治疗中含铂方案治疗后6个月内疾病进展)情况分层,按照2∶1的比例分别接受联合或单药治疗。研究主要终点为铂类难治患者的ORR,次要终点包括适用铂类治疗患者的ORR,以及不同PD-L1、HPV和铂类治疗情况患者的PFS和OS,探索性终点为安全性和患者报告结局[28]。纳武利尤单抗联合ipilimumab用于复发/转移性SCCHN的一线治疗(与铂类联合5-FU和西妥昔单抗方案对比)的III期临床试验CheckMate 651研究[29-30]也正在进行中。该研究纳入组织学确诊为难治性复发/转移性SCCHN、既往未因该疾病接受过全身治疗(接受过多模式治疗方案中的化疗且在入组前≥6个月治疗完成者除外)的成人患者。主要研究终点为OS、PFS;次要终点为ORR、至症状恶化(通过10项肿瘤治疗功能评分-头颈部症状量表评估)的时间,以及PD-L1表达状态对疗效的预测意义。该研究预计在2020年8月完成主要评估。
其他正在进行中的一线治疗III期临床试验还包括帕博利珠单抗单药或联合IDO1抑制剂Epacadostat用于复发/转移性SCCHN患者一线治疗(与铂类联合5-FU和西妥昔单抗方案对比)的KEYNOTE-669研究[31]、评估Durvalumab和Tremelimumab单药或两药联合用于复发/转移性SCCHN一线治疗(与铂类联合5-FU和西妥昔单抗方案对比)的KESTREL研究[32]等。
3 免疫相关不良事件及管理
免疫相关不良事件(immune-related adverse event,irAE)是免疫治疗期间需要关注的特殊问题,其发生机制与免疫治疗产生疗效的机制相关,一旦发生,需要根据发生irAE的系统和严重程度,参考相关指南和药物说明书进行相应处理。
既往临床研究显示,不同瘤种的患者发生irAE的特征可能有所不同[33]。CheckMate-141研究将可能由免疫原因导致的不良事件定义为经选择的不良事件。在该研究中,接受纳武利尤单抗治疗的SCCHN患者发生的绝大多数经选择的不良事件为轻中度,3~4级经选择的胃肠、肝脏、肺部、肾脏、皮肤、过敏/输注反应和内分泌不良事件发生率均<1%[15]。值得注意的是,一项对114例接受PD-1抑制剂治疗SCCHN患者的汇总分析[34]显示,治疗期间发生irAE的患者ORR和OS结果均优于未发生irAE的患者,多变量分析也显示发生irAE与ORR、PFS和OS改善独立相关。但irAE能否成为免疫治疗的疗效预测标志物还有待未来进一步研究明确。
irAE的管理主要包括毒性反应的识别和分级、免疫抑制治疗和根据患者个体情况调整免疫检查点抑制剂的给药等几个方面。其关键目标是早期识别症状和及时干预。不同临床指南推荐的irAE处理原则总体一致,通常轻度(1级)irAE需要加强监测,无需暂停免疫治疗,中度以上(≥2级)的irAE则需要暂停免疫治疗并使用以皮质类固醇为主的免疫调节剂,部分重度irAE需要永久停用免疫治疗[35]。但如前所述,SCCHN患者发生严重irAE的风险较低,安全性可控。最近一项西班牙多中心真实世界研究显示,在50例接受纳武利尤单抗治疗的SCCHN患者中,无一例患者发生需要停药或使用全身激素治疗的irAE[36]。
4 SCCHN免疫治疗的前沿进展
除复发/转移性SCCHN以外,目前还有一些III期临床试验正在评估免疫检查点抑制剂联合根治性放化疗用于局部晚期SCCHN患者的可行性(表2)。包括纳武利尤单抗联合放化疗用于局部晚期SCCHN患者的CA209-9TM研究[37]、帕博利珠单抗联合放化疗用于局部晚期SCCHN患者的KEYNOTE-412研究[38]、帕博利珠单抗用于局部晚期SCCHN患者围手术期治疗的MK-3475-689研究[39]、Atezolizumab用于复发高危HNSCC患者局部治疗后辅助治疗的IMvoke010研究[40]、Avelumab联合放化疗用于局部晚期SCCHN患者的JAVELIN HEAD AND NECK 100研究[41]和Avelumab联合西妥昔单抗和放疗用于局部晚期SCCHN患者的REACH研究[42]。这些研究结果将为免疫治疗这一新型疗法能否改善相对早期SCCHN患者的预后提供依据。
其他处于早期临床试验阶段的药物还包括其他在研PD-1通路抑制剂(JS001、Cemiplimab、AB122、ABBV-181、BI 754091、CBT-501)、TIGIT抑制剂(AB154)、LAG-3抑制剂(BI 754111、INCAGN02385、Relatlimab)、TIM-3拮抗剂(INCAGN02390)、IDO1抑制剂(epacadostat、LY3381916)、腺苷受体拮抗剂(AB928、CPI- 444)、CD40激动剂(ABBV-927、SEA-CD40)、ILDR2抑制剂(BAY1905254)、CCR4拮抗剂(FLX475)、CD137激动剂(Urelumab)、肿瘤疫苗(AlloVax、CIMAvax、DSP-7888、MEDI0457)等。这些药物用于SCCHN患者的有效性和安全性还有待进一步明确。
表2 免疫治疗用于SCCHN患者的III期临床试验

研究名(临床试验注册号)研究人群治疗方案预计/实际主要完成时间主要研究结果CheckMate 141(NCT02105636)含铂化疗失败的复发/转移性SCCHN纳武利尤单抗vs研究者选择的药物(西妥昔单抗、甲氨蝶呤或多西他赛)2015年11月纳武利尤单抗vs对照组:中位OS:7.5月和5.1月(P=0.010)ORR:13.3%和5.8%≥3级治疗相关不良事件:13.1% vs35.1%CheckMate 651(NCT02741570)既往未接受过全身治疗的复发/转移性SCCHN纳武利尤单抗+ipilimumab vs 西妥昔单抗+顺铂/卡铂+5-FU2020年8月-CA209-9TM(NCT03349710)局部晚期SCCHN纳武利尤单抗+西妥昔单抗+顺铂+放疗2019年10月-
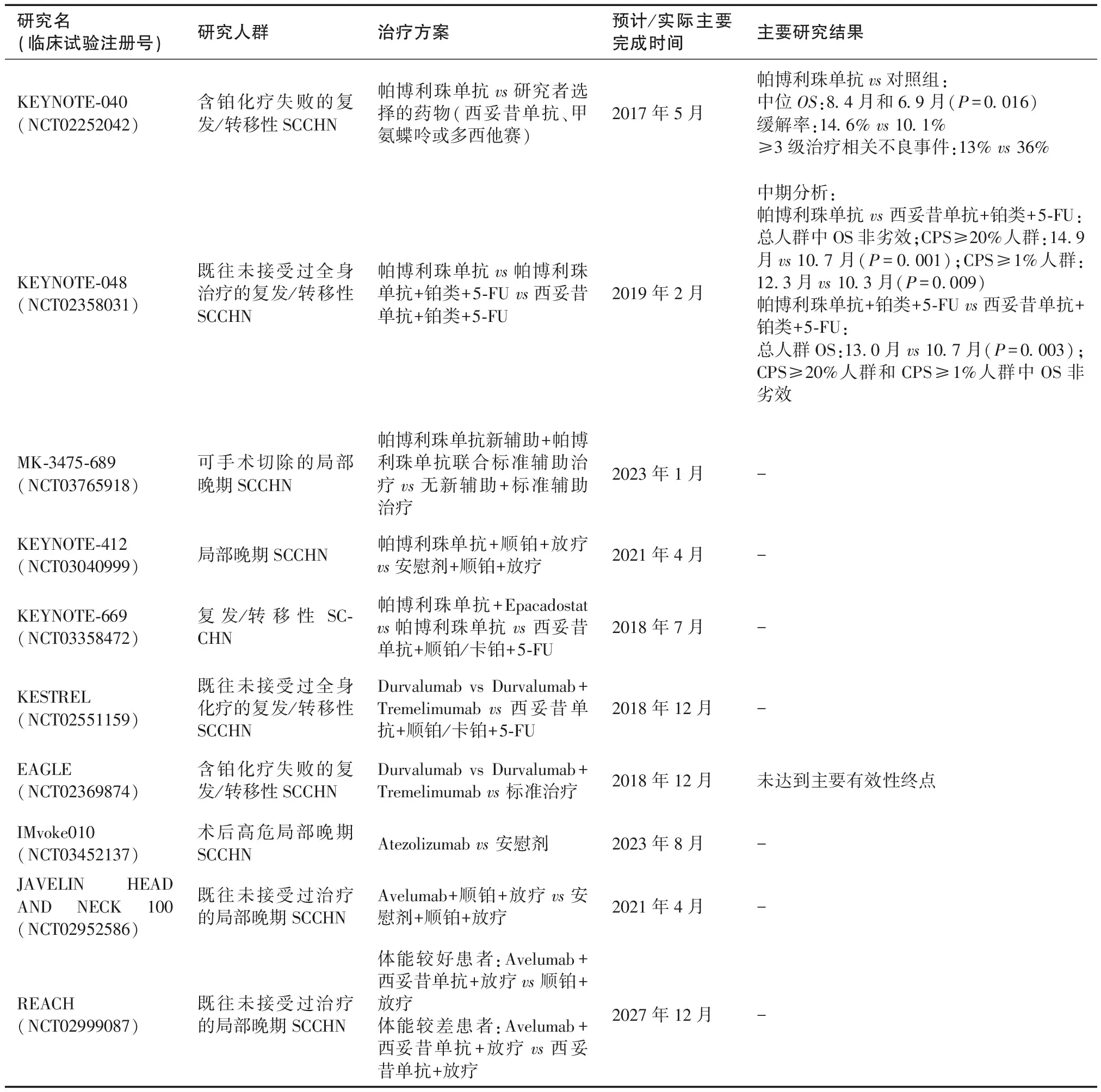
研究名(临床试验注册号)研究人群治疗方案预计/实际主要完成时间主要研究结果KEYNOTE-040(NCT02252042)含铂化疗失败的复发/转移性SCCHN帕博利珠单抗vs研究者选择的药物(西妥昔单抗、甲氨蝶呤或多西他赛)2017年5月帕博利珠单抗vs对照组:中位OS:8.4月和6.9月(P=0.016)缓解率:14.6% vs 10.1%≥3级治疗相关不良事件:13% vs 36%KEYNOTE-048(NCT02358031)既往未接受过全身治疗的复发/转移性SCCHN帕博利珠单抗vs帕博利珠单抗+铂类+5-FU vs西妥昔单抗+铂类+5-FU2019年2月中期分析:帕博利珠单抗 vs 西妥昔单抗+铂类+5-FU:总人群中OS非劣效;CPS≥20%人群:14.9月vs 10.7月(P=0.001);CPS≥1%人群:12.3月vs 10.3月(P=0.009)帕博利珠单抗+铂类+5-FU vs西妥昔单抗+铂类+5-FU:总人群OS:13.0月vs 10.7月(P=0.003);CPS≥20%人群和CPS≥1%人群中OS非劣效MK-3475-689(NCT03765918)可手术切除的局部晚期SCCHN帕博利珠单抗新辅助+帕博利珠单抗联合标准辅助治疗 vs 无新辅助+标准辅助治疗2023年1月-KEYNOTE-412(NCT03040999)局部晚期SCCHN帕博利珠单抗+顺铂+放疗vs安慰剂+顺铂+放疗2021年4月-KEYNOTE-669(NCT03358472)复发/转移性SC-CHN帕博利珠单抗+Epacadostat vs帕博利珠单抗 vs 西妥昔单抗+顺铂/卡铂+5-FU2018年7月-KESTREL(NCT02551159)既往未接受过全身化疗的复发/转移性SCCHNDurvalumab vs Durvalumab+Tremelimumab vs 西妥昔单抗+顺铂/卡铂+5-FU2018年12月-EAGLE(NCT02369874)含铂化疗失败的复发/转移性SCCHNDurvalumab vs Durvalumab+Tremelimumab vs 标准治疗2018年12月未达到主要有效性终点IMvoke010(NCT03452137)术后高危局部晚期SCCHNAtezolizumab vs 安慰剂2023年8月-JAVELIN HEAD AND NECK 100(NCT02952586)既往未接受过治疗的局部晚期SCCHNAvelumab+顺铂+放疗vs安慰剂+顺铂+放疗2021年4月-REACH(NCT02999087)既往未接受过治疗的局部晚期SCCHN体能较好患者:Avelumab+西妥昔单抗+放疗vs顺铂+放疗体能较差患者:Avelumab+西妥昔单抗+放疗vs西妥昔单抗+放疗2027年12月-
5 总结和展望
目前已有两种PD-1抑制剂获批用于复发/转移性SCCHN患者的二线治疗,为这些难治患者带来了新的希望。获批药物的III期临床试验显示,这类药物有助于改善生存预后,带来持久应答,同时具有较好的安全性特征,正逐渐成为铂类治疗失败患者治疗的金标准。
在SCCHN免疫治疗领域,目前尚未明确但值得进一步探索的问题包括是否存在可预测患者应用免疫治疗有效性的可靠生物标志物?免疫治疗与传统放化疗之间的组合、不同机制免疫治疗之间的组合用于不同分期SCCHN患者的有效性和安全性如何?未来随着更多大规模临床研究的进行和临床经验的积累,这些临床医生关注的问题将有望得到一一解答。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突。
——中国居民收入分配中的逆向调节机制

