重组人血管内皮抑制素注射液联合化疗治疗EGFR、ALK阴性肺腺癌并脑转移的疗效
江冠铭, 谭钦全, 曾溢蕻, 袁海姬, 林顺欢
东莞市人民医院肿瘤内科(广东东莞 523059)
肺腺癌是非小细胞肺癌(non-small cell lung cancer, NSCLC)的一种主要病理类型,多起源于支气管黏膜上皮。由于多数患者确诊时已达晚期而丧失手术时机[1]。对于表皮生长因子受体(epidermal growth factor receptor, EGFR)基因阴性及间变性淋巴瘤激酶重排(anaplasticlymphoma kinase,ALK)阴性的患者,化疗是最常用的治疗方法。脑部是Ⅳ期NSCLC患者的常见转移部位之一,临床首诊肺癌患者中约10%已发生脑转移,在肺癌治疗进程中高达40%的患者继发脑转移[2],患者预后较差。EGFR突变阳性和ALK阳性的肺癌脑转移患者使用酪氨酸激酶抑制剂靶向治疗效果好,明显延长生存时间[3-4]。对于EGFR突变、ALK融合均为阴性的肺癌脑转移患者治疗难度大,疗效差。在临床实践中,本科室采用重组人血管内皮抑制素(rh-endostatin/Endostar, 重组人血管内皮抑制素注射液)联合化疗治疗Ⅳ期EGFR突变、ALK融合均为阴性的肺腺癌并脑转移患者,取得了较为满意的治疗效果,现报告如下。
1 资料与方法
1.1 一般资料 2016年9月至2017年7月在本院肿瘤科选取符合条件的受试者112例。纳入标准:(1)原发肺部病灶经病理组织学及Scorpion ARMS法/FISH或NGS基因检测确诊的EGFR突变ALK融合均为阴性的Ⅳ期肺腺癌并脑转移患者;(2)具有可测量的原发肺部病灶(肿瘤病灶CT扫描长径≥10 mm,淋巴结病灶CT扫描短径≥15 mm,扫描层厚不大于5 mm),颅内转移病灶经CT、MRI或PET-CT证实;(3)初治患者,既往未接受抗肿瘤治疗;(4)年龄18~75岁,Karnofsky评分(KPS)80分,无抗血管生成药物与化疗禁忌证;(5)预计生存期≥3个月;(6)依从性好,配合随访。排除标准:(1)既往或同时患有其他恶性肿瘤;(2)颅外其他部位转移;(3)心、肝、肾等重要脏器功能不全,或其他严重的内外科疾病;(4)中央型、空腔的肺鳞癌,或伴有咯血(>50 mL/d)的非小细胞肺癌患者,肿瘤已侵犯重要血管或经研究者判断在后续研究期间有可能发生大出血的患者;(5)妊娠或哺乳期妇女;(6)过敏体质;(7)近3个月参加过其他临床试验;(8)研究者判断其他可能影响临床研究进行及结果判定的情况。剔除/中止/脱落标准:(1)退出研究或失访;(2)未遵既定方案诊疗;(3)资料不全影响观察指标评价。采用随机数字表法,将受试者分为观察组和对照组,每组各56例。观察组中,男35例、女21例;年龄39~75岁,平均(65.3±5.7)岁。对照组中,男32例、女24例;年龄41~75岁,平均(65.8±6.2)岁。本研究获得医院伦理委员会审议批准,所有受试者均自愿加入本研究,并签署知情同意书。两组患者的性别构成、年龄分布等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 对照组 给予培美曲塞、卡铂方案化疗。根据规范使用叶酸和维生素B12,3周重复。予以培美曲塞(江苏奥赛康药业股份有限公司)500 mg/m2,卡铂AUC=5,第1天静脉滴注,3周重复。化疗4~6周期后若肿瘤无进展,改为培美曲塞维持治疗,3周重复。化疗期间配合抗过敏、止吐、保肝、保胃等对症处理。
1.2.2 观察组 给予重组人血管内皮抑制素注射液联合培美曲塞、卡铂方案化疗。培美曲塞、卡铂方案化疗同对照组。另予以重组人血管内皮抑制素注射液(山东烟台先声麦得律生物工程有限公司)30 mg,加入500 mL生理盐水稀释后缓慢静脉滴注,持续滴注24 h,第1~7天,3周重复。化疗4~6周期后若肿瘤无进展,改为重组人血管内皮抑制素注射液联合培美曲塞维持治疗,3周重复。
1.3 观察指标及评价标准
1.3.1 疗效评价 参照RECIST《可测量病灶疗效评价标准》[5]评价近期疗效,包括原发肺癌病灶及脑转移病灶的疗效。(1)完全缓解(CR):所有靶病灶消失,全部病理淋巴结(包括靶结节和非靶结节)短直径必须减少至<10 mm。(2)部分缓解(PR):靶病灶直径之和比基线水平减少至少30%。(3)疾病进展(PD):以整个研究过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%(如果基线测量值最小就以基线值为参照);除此之外,必须满足直径和的绝对值增加至少5 mm(出现一个或多个新病灶也视为疾病进展)。(4)疾病稳定(SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD水平,介于两者之间,研究时可以直径之和的最小值作为参考。(5)客观缓解率(ORR)、颅内客观有效率(iORR)包括至少相隔4周确认的CR和PR,疾病控制率(DCR)包括CR、PR和初次服用药物至少6周后的SD者。
1.3.2 无进展生存期(progression free survival, PFS)与总生存期(overall survival, OS)[6]患者出院后,每3个月进行1次随访,随访方式包括门诊复查、电话随访。随访至靶向治疗后满18个月或疾病进展、患者死亡。PFS指从开始对肿瘤进行针对性治疗直至50%的患者出现肿瘤进展或因任何原因死亡的时间间隔(以发生在先的事件计算),以中位PFS、中位颅内无进展时间(中位iPFS)比较两组差异。OS指从诊断日期到因任何原因死亡的时间。
1.3.3 不良反应 记录化疗期间发生的各种不良反应。化疗前后,复查血、尿常规,以及肝肾功能,心电图等。
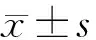
2 结果
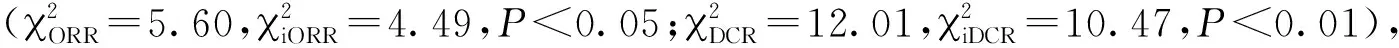
表1 两组客观疗效、ORR及DCR比较 例
2.2 生存情况 末次随访时间截至2018年12月31日,对照组54例患者获随访,随访率96.43%,随访时间为2~18个月,中位随访时间为8.2个月,19例患者数据截尾,其中17例患者到截点时仍健在,各1例患者因肺部感染、心功能衰竭死亡;中位iPFS为4.8个月(95%CI:3.3~18个月),中位PFS为
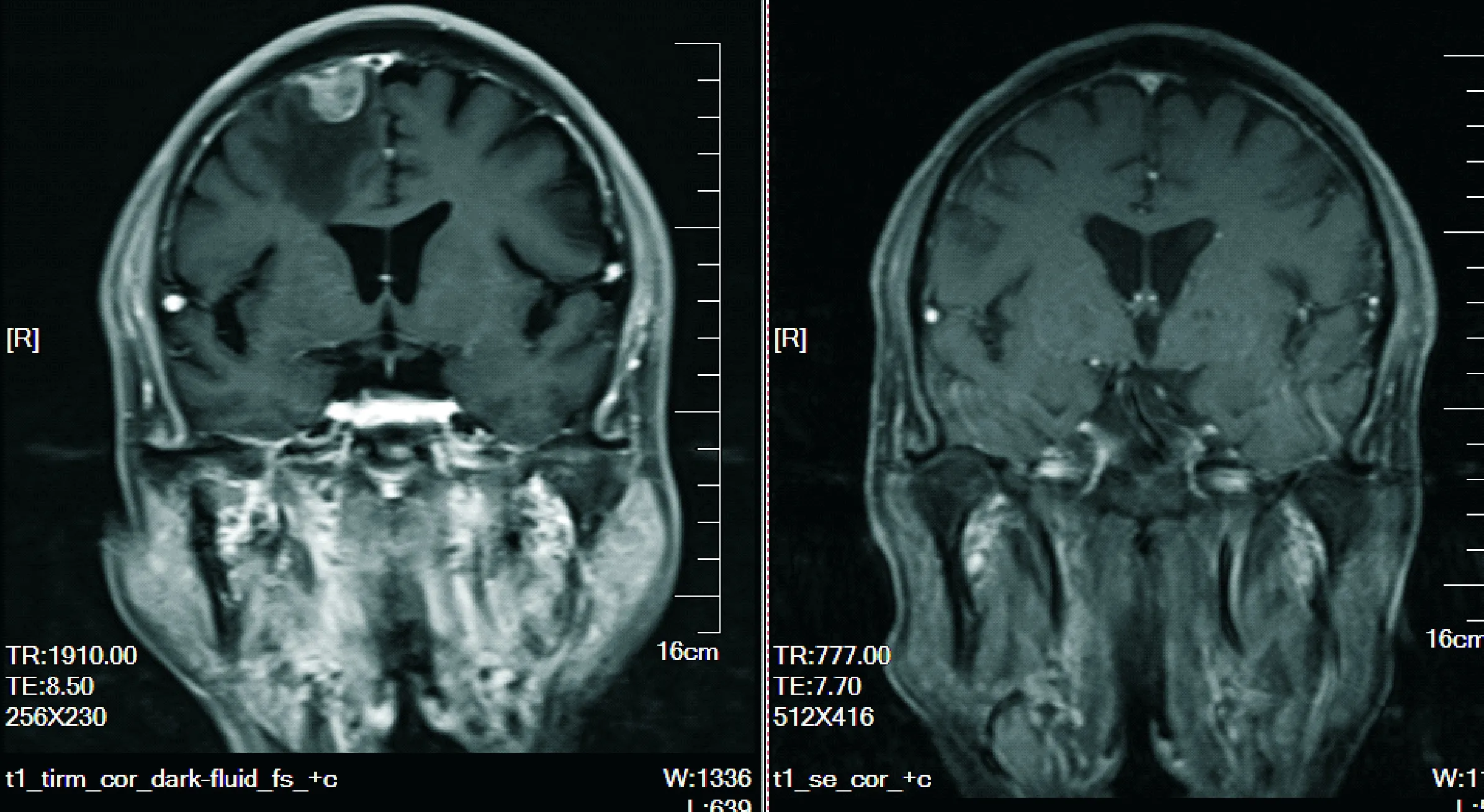
观察组36号患者,男,66岁,左图为治疗前基线颅脑MR照片,右图为重组人血管内皮抑制素注射液联合培美曲塞、卡铂方案化疗4周期后颅脑病灶明显退缩
图1 患者治疗前后颅脑MR的改变
5.7个月(95%CI: 3.3~18个月),中位OS为7.1个月(95%CI: 4.5~18个月)。观察组56例患者均获得随访,随访率100.00%,随访时间为3~18月,中位随访时间为10.5个月,19例患者数据截尾,其中18例患者到截点时仍健在,1例患者因突发脑出血死亡;中位iPFS为6.3个月(95%CI:4.3~18个月),中位PFS为7.8个月(95%CI:4.3~18个月),中位OS为8.3个月(95%CI: 5.1~18个月)。经Log-Rank检验,观察组中位iPFS、中位PFS、中位OS均长于对照组,差异有统计学意义(P<0.01)。
2.3 不良反应 两组患者的不良反应主要表现为骨髓抑制、消化道反应,骨髓抑制主要为白细胞减少;消化道反应有食欲减退、恶心、呕吐和乏力等,患者可耐受,经对症处理后症状可缓解。观察组1例患者心电图轻度ST-T改变,未影响重组人血管内皮抑制素注射液的继续应用,且在重组人血管内皮抑制素注射液应用结束7 d后复查心电图ST-T恢复正常。未出现心肌损害、肝功能损害等毒副反应。观察组与对照组不良反应发生率分别为46.43%、42.86%,差异无统计学意义(2=0.15,P>0.05),见表2。

表2 两组Ⅲ、Ⅳ级不良反应比较 例
3 讨论
生理学研究表明,脑组织的血供量约占体循环容量的1/5,癌细胞很容易经过体循环到达脑组织,因此脑部是肺癌远处转移的最常见部位之一,发生率约为23%~65%,其中腺癌脑转移发生率为43%[3]。肺癌脑转移的诊断主要依赖于影像学检查,目前患者预后较差,中位生存期仅3.1~6个月。目前,对于肺癌脑转移的临床治疗方法较多,包括手术治疗、化疗、立体定向放射治疗(stereotactic radiosurgery, SRS)、全脑照射(whole-brain radiotherapy, WBRT)、分子靶向治疗等[7],由于多方面因素的限制,以化疗为主的综合治疗方案最为常用。传统的观点认为,化疗药物难以透过血脑屏障,难以对脑转移病灶发挥作用。近期研究[7]发现,肺癌脑转移患者的血脑屏障已经发生不同程度的破坏,存在一些通透性,因而部分化疗药物可以透过血脑屏障进入脑内,发挥抗肿瘤作用。
据美国临床肿瘤学会推荐建议[8],由于没有合适的靶点,对于EGFR突变、ALK融合均为阴性晚期肺癌患者使用分子靶向治疗效果差,尽量采用不良反应小的药物联合抗肿瘤治疗。铂类联合新药为基础的化疗方案在临床较为常用,化疗联合抗血管生成治疗是目前研究的主流。本研究化疗所采用的培美曲塞为一种新型细胞毒性药品,属于多靶点式叶酸拮抗剂,通过抑制参与叶酸代谢的关键酶,破坏了对肿瘤细胞叶酸依赖类代谢进程,进而对肿瘤细胞复制中的核酸合成产生抑制,最终起到抗肿瘤作用[9]。PARAMOUNT研究则提示,一线培美曲塞+顺铂4~6周期后没有进展的患者后续用培美曲塞维持治疗,可将OS期从14.0个月延至16.9个月。因此对于晚期肺腺癌培美曲塞+顺铂后续培美曲塞维持治疗是目前标准方案之一[10]。有研究表明培美曲塞联合铂类对肺癌脑转移有一定的疗效,颅内病灶有效率达28.8%[11]。目前单纯化疗对肺癌脑转移疗效不尽人意,探索联合新的疗法或新的药物是当前肺癌脑转移的研究方向。
病理学研究表明,癌组织增生、转移与新生血管密切相关,新血管生成是肿瘤生长和转移的物质基础和先决条件[12]。1971年,Folkman教授提出通过抑制肿瘤血管的生成而“饿死肿瘤疗法”的理论[13]。1997年,Folkman和O′Reiny等分离出血管生成抑制因子——内皮抑素(endostatin,ES)[14]。学者在endostatin肽链N 端添加了9个氨基酸,研究开发了重组人血管内皮抑素注射液,即重组人血管内皮抑制素注射液[15]。综合文献[16-17]观点,重组人血管内皮抑制素注射液主要通过如下的机制发挥抑制肿瘤增殖或转移的效果:(1)抑制血管内皮细胞迁移和增殖,阻断新生血管生成;(2)通过作用于血管内皮生长因子(VEGF)传导通路,减少VEGF的表达,降低蛋白水解酶的活性,阻滞内皮细胞G1期、下调Bcl-2水平,直接诱导肺癌细胞凋亡;(3)降低血管内皮细胞与间质或细胞间接触的概率,使化疗药物更容易攻击血管内皮细胞,诱导其凋亡;(4)增强肿瘤细胞对放疗、化疗的敏感性,并阻断放疗后的血管再形成。重组人血管内皮抑制素注射液主要通过下调VEGF及其受体表达来发挥抗血管生成作用,还可通过抑制VEGF-C信号通路来发挥抗淋巴管生成的作用[18]。此外,重组人血管内皮抑制素注射液还对其他多个重要信号通路有明确的抑制作用,包括低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)、基质金属蛋白酶(matrix metalloproteinases,MMPs)、bFGF、整合素αvβ3等,具有泛靶点的抗血管生成活性[19]。重组人血管内皮抑制素注射液泛靶点抗血管生成作用通过影响肿瘤微环境中血管生成的动态平衡,减少异常血管新生,重构和规整肿瘤脉管系统,促使肿瘤微环境正常化,减少渗漏、减轻肿瘤缺氧和肿瘤组织间隙液压(IFP)、不但增加化疗敏感性,而且减少肿瘤相关性水肿,尤其对肺癌脑转移引起的脑水肿有较佳的疗效[20]。
本研究结果显示,观察组原发肺癌病灶ORR、DCR,以及脑转移病灶iORR、iDCR均高于对照组;观察组中位iPFS、中位PFS、中位OS均长于对照组,这表明观察组患者的原发肺部病灶、脑转移病灶的化疗效果均优于对照组,观察组患者的生存期更长。在不良反应方面,尽管观察组增加了重组人血管内皮抑制素注射液,但两组间的不良反应发生率差异无统计学意义,这也可能与纳入样本量较小、临床用药时间较短等因素有关。
综上所述,重组人血管内皮抑制素注射液联合化疗治疗Ⅳ期EGFR突变、ALK融合均为阴性的肺腺癌并脑转移患者具有较好的临床疗效,控制或延缓了原发肺部病灶、脑转移病灶的进展,延长了生存时间,且安全性较好,对于晚期EGFR突变阴性肺腺癌并脑转移的临床治疗具有一定的指导和借鉴意义。

