甲烷化学链重整制合成气用氧载体的研究进展
靳南南,张 立,朱燕燕*,刘瑞林,马晓迅,王晓东
(1.西北大学化工学院,国家碳氢资源清洁利用国际科技合作基地,陕北能源先进化工利用技术教育部工程研究中心,陕西省洁净煤转化工程技术研究中心,陕北能源化工产业发展协同创新中心,陕西 西安 710069;2.中国科学院航天催化材料重点实验室,中国科学院大连化学物理研究所,辽宁 大连 116023)
全球已探明非传统天然气储量丰富,非传统天然气包含页岩气、致密砂气、可燃冰、煤层气或煤矿气等[1]。根据BP 公司2019 年发布的世界能源展望预测,到2040 年中国天然气需求量将达到总能源体系的50%[2]。甲烷是天然气的主要成分,将甲烷转化为合成气(CO+H2)是天然气间接转化的重要途径,将制取的合成气经过费托合成转化为液体燃料或化工产品等[3-5],用途十分广泛。
利用甲烷制取合成气,根据氧化剂不同,一般有三种合成路线:甲烷水蒸气重整[6-7](SRM),甲烷干重整[8-9](DRM)和甲烷部分氧化[10-12](POM)。其中,甲烷水蒸气重整技术利用H2O 作为氧化剂,表达式为CH4+H2O →CO+3H2,ΔH0298K=206kJ/mol,n(H2)/n(CO)=3。目前90%的合成气来源于该技术,但由于该工艺存在能耗高、设备庞大复杂、投资和操作费用高等缺点,使得合成气的生产成本相对较高,并且n(H2)/n(CO)=3 过高,不适合直接用于费托合成,需要进行后续的调气处理;甲烷干重整以CO2作为氧化剂,表达式为CH4+CO2→2CO+2H2,ΔH0298K=247kJ/mol,n(H2)/n(CO)=1,由于在缓解温室气体CO2减排压力、保护环境上具有重大意义,日益受到人们的重视;但与水蒸气重整技术一样,是强吸热反应,能耗大,此外单质C 在CO2气氛中活性较低,易使积炭覆盖在催化剂表面,造成催化剂失活,目前受贵金属催化剂昂贵、镍基催化剂易烧结积炭失活等问题的困扰,距满足工业化的要求还较远。
甲烷部分氧化技术是利用O2为氧化剂,表达式为 CH4+1/2O2→CO+2H2,ΔH0298K=-36kJ/mol,n (H2)/n(CO)=2。与以上两技术相比,其主要优点为放热反应,反应器体积小、效率高、能耗低,反应可在高空速下进行,而且其产物中H2/CO 比例接近2,可直接用作下游甲醇生产和费托反应的原料气。但是该反应速率很快,极易造成催化剂床层飞温;若使用廉价的空气作为氧化剂,空气中的N2会稀释产物合成气,若使用纯氧作为氧化剂,空气分离系统会大大增加生产成本,并且纯氧的存在易导致甲烷过度氧化为CO2和H2O,降低合成气产率;此外甲烷和氧气直接混合进料,会带来爆炸危险,影响安全生产。
此外,利用H2O-CO2-O2作为氧化剂同时重整甲烷的过程为三重整[13](TRM),该工艺理论上既可以实现自热进行,生产n(H2)/n(CO)=1.5~2.5 的合成气,还可以缓解积炭,但该技术仍需要投资较高的空气分离设备来供应工业氧,并且反应体系复杂,控制难度较大。
近年来,研究者在化学链的基础上提出了一种新型的甲烷制取合成气技术即甲烷化学链重整技术(chemical looping reforming,CLR)[14-18],它的主要思路是利用固体金属氧化物作为氧载体,将传统的气-气反应分解为两个气-固半反应,利用氧载体中的晶格氧来代替气相分子氧,部分氧化甲烷制合成气,之后被还原的氧载体从空气、H2O 或CO2中重新获得晶格氧,完成循环。目前,CLR 技术的研究越来越受到国内外学者的重视。
1 化学链重整技术(CLR)的原理及其特点
1983 年,德国科学家Richter[19]提出了一种基于循环氧载体的新型燃烧概念,即化学链燃烧技术(chemical looping combustion,CLC)[20-23],该技术通过固体氧载体在燃料反应器和空气反应器之间的循环氧传递作用,把燃料的空气燃烧反应分成两个独立的子反应(燃料和氧载体反应,氧载体和空气反应),既实现了氧从空气到燃料之间的转移,又保证了燃料燃烧生成的CO2和空气中N2的内在分离。
CLR 是CLC 的拓展,其基本原理如图1 所示[24],甲烷在还原反应器中与氧载体(MeO)中的晶格氧进行反应产生n(H2)/n(CO)=2 的合成气,与此同时MeO 被还原,被还原的氧载体(Me,代表MeO 的还原态)进入到氧化反应器内与空气、CO2或H2O 反应重新获得晶格氧,完成再生。CLR 具有以下优点:(1)反应为气固反应,体系简单,过程容易控制;(2)没有气相氧参与反应,甲烷被深度氧化的可能性大大降低,合成气的选择性大幅度提高,并且合成气n(H2)/n(CO)接近于2,非常适合直接用于费托合成的原料气;(3)整个反应过程不使用纯氧,省去了制备纯氧的装置,能够大幅降低合成气生产成本;(4)空气与甲烷分开进料,有效地避免了系统发生爆炸的风险;(5)当以H2O、CO2或H2O-CO2为氧化再生气氛时,还可制备高纯H2、CO 或合成气。因而,近年来,国内外学者对甲烷的化学链重整制合成气开展了广泛的研究,图2 显示自1996 年以来每年在Web of Science 上发表的有关化学链重整的论文数量日益剧增。
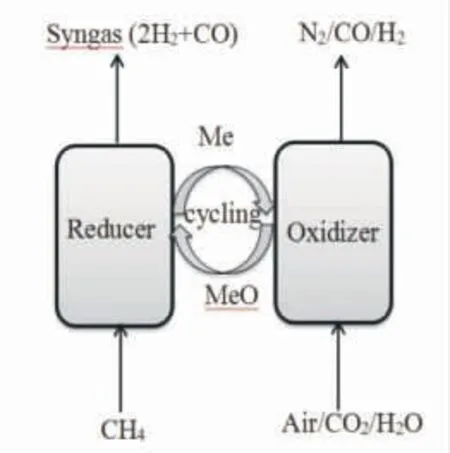
图1 甲烷化学链重整原理示意图[24]
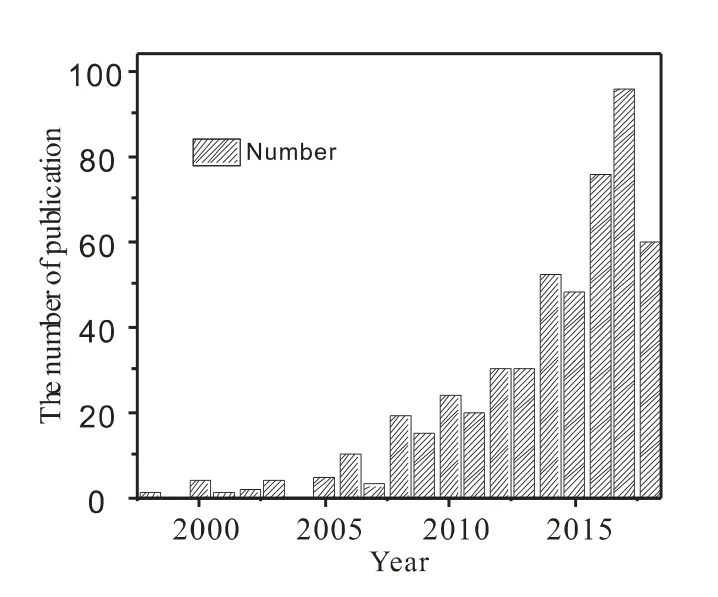
图2 自1996 年以来每年有关化学链重整的论文数量(在Web of Science 中检索)
2 氧载体的研究
金属氧化物颗粒作为氧载体在还原反应器和氧化反应器之间循环使用,是实现CLR 系统运转的关键[25-26]。为了增强氧载体颗粒的整体机械性能和反应活性,金属氧化物需要担载在惰性载体上,因此,氧载体一般由活性金属氧化物和载体构成,它必须满足以下特征:强的氧化还原反应活性和强的氧传输能力,使其能够在较低的温度下以较快的反应速率与燃料和氧化剂反应,优异的高温稳定性和抗热冲击性能,以及良好的机械强度以适应连续切换的反应;此外还要具备积炭少、抗烧结、成本低、环境友好、易制备等特点。
目前,氧载体的研究主要选择过渡金属Ni、Fe、Cu、Co 等[27-29]作为活性组分制备氧载体,并对其反应特性和构效关系进行了大量的研究。此外,研究者对复合金属氧化物,如CeO2类氧载体、钙钛矿型氧载体、六铝酸盐氧载体等也进行了深入细致的研究,具体如下。
2.1 过渡金属系氧载体
2.1.1 镍基氧载体
镍基氧载体是应用最广泛的金属氧载体之一[30-32],其拥有高的反应活性、耐高温性(900~1000℃)、较高的载氧和耐磨损能力等[33]。但是镍基氧载体比其它金属贵,成本较高,对环境有污染,容易积炭,一般都将其负载在载体上或形成复合金属氧化物。Lofberg[34]等人将镍(Ni)颗粒负载在二氧化铈(CeO2)上作为氧载体,CH4/CO2氧化还原循环反应后,发现在CH4气氛中Ni2+和铈阳离子间存在强相互作用,Ni 对反应物的活化和供氧起着重要的作用,在CO2气氛中氧化后,氧载体的晶格氧可以再生,表面的残余碳也可以完全出去,Ni 负载量是控制载体还原行为以及化学链甲烷干重整(CLDRM)过程优化的关键参数。Meshksar[35]等用浸渍法制备了CeO2、NiO 负载的SBA-16 型氧载体,发现由于受SBA-16 骨架的限制和Ni、Ce 间的强相互作用,CeO2纳米颗粒的存在,不仅可以适度消除积炭,同时有利于NiO 在SBA-16 骨架上分散,抑制了NiO颗粒的团聚,达到提高反应活性、延长氧载体寿命的作用。
2.1.2 铁基氧载体
铁有多种氧化态,包括Fe2O3,Fe3O4,FeO,它们的熔点分别为1565℃、1597℃、1377℃[36]。但受热力学的限制,Fe2O3转化为Fe3O4时适合甲烷完全氧化反应,FeO 转化为Fe 时有利于甲烷部分氧化产生合成气[37]。铁基氧载体不容易发生积炭现象,有强烈的抗集聚能力,对硫化物或硫酸盐的含量要求很小,在高温下也能维持较好的反应性、热稳定性和机械性等优良性能[38-39],但是由于其还原能力相对较弱,甲烷转化率不高[40],一般与其他金属氧化物(如CeO2)或金属(如Ni)复合使用。祝星[41]等利用共沉淀法制备Ce/Fe=7:3(摩尔比)的氧载体CeO2-Fe2O3,以水蒸气作为氧化剂,在连续10 次CH4/H2O 循环后,仍然有较高的CO、H2选择性和合适的H2/CO 比,同时在循环使用后的氧载体中检测到CeFeO3固溶体,推测CeFeO3在连续循环反应中起关键作用。李孔斋[42]等制备了不同Ce/Fe 比的复合氧化物作为氧载体,在850℃反应条件下研究了甲烷选择性氧化制合成气的反应机理,发现在二元Ce-Fe 氧化物中,只有少量的铁离子进入CeO2晶格中形成了Ce-Fe 固溶体,剩余的Fe2O3分散在CeO2表面,氧载体表面的铁和Ce-Fe 固溶体之间的强化学相互作用,不仅改善了表面Fe2O3的分散性,而且形成的固溶体可提高合成气生成速率,有利于保持高活性和高稳定性。Veser[43-44]课题组在甲烷化学链干重整实验中,设计了负载在氧化铈上的双金属Fe-Ni 合金氧载体,发现该氧载体能够结合Ni 对甲烷活化的高反应活性和铁对合成气的高选择性,Fe-Ni 合金之间存在强烈的协同效应,并且FexNi1-x/CeO2在多个CH4还原-CO2氧化循环中均能保持其稳定的合金结构。随后,该课题组还发现将Fe/CeO2和Ni/CeO2简单物理混合所达到的协同效果甚至超过FexNi1-x/CeO2。与FexNi1-x/CeO2采用“共享”晶格氧原理不同,物理混合法依赖于“气相”合作机制,即Ni 将甲烷裂解成C 和H2,然后H2还原Fe2O3形成水蒸气,水蒸气再将Ni 上的碳沉积物气化产生CO+H2,从而使活性Ni 表面得以再生,如图3 所示。

图3 Fe-Ni 物理混合物的反应机理[44]
2.1.3 铜基氧载体
铜基氧载体具有低温下高的反应活性、较大的载氧能力、不易与载体发生反应、碳沉积现象不明显、对环境友好、无污染的优势。但铜的氧化物熔点低(CuO 熔点1450℃,Cu2O 熔点1235℃,CuO-Cu2O 共熔点1075℃),使得CuO 单独使用时极易发生烧结[45]。Zheng[46]等制备了CuO-SiO2氧载体,发现通过负载SiO2可以增强其抗烧结能力,使氧载体在反应过程中活性维持稳定。Alirezaei[47]等采用共沉淀法制备了ZrO2修饰的Cu/Al2O3氧载体,采用新型CO2-CLR(CO2和CH4同时进入还原反应器,CO2进入氧化反应器)工艺,对不同还原温度(550~750℃)下的氧载体进行评价,结果表明,20%ZrO2可以有效提高不同还原温度下氧载体的反应效率。在650℃低温和n(CH4)/n(CO2)=1 反应条件下,15wt%Cu/20wt%Zr-Al 氧载体活性最高,CH4转化率达99.2%,在多次氧化还原中ZrO2改性氧载体仍能保持较高的活性和稳定性。以上结果显示将Cu 负载在SiO2或ZrO2改性的Al2O3载体上,可提高其抗烧结能力。
2.1.4 钴基氧载体
Co3O4具有较强的载氧和氧传递能力,但Co3O4在900℃以上不稳定,并会转化为CoO 使性能下降,CoO 和Co 之间的转化多应用在CLC 中[40]。在氧载体的设计与制备中,钴基氧载体使用时一般会负载其它氧化物,以求达到更高效果。Jin[48]等制备了不同氧化物负载的CoO 氧载体,在热重分析仪进行性能测试,发现CoO/YSZ 氧载体表现出良好的氧化还原性和抗积炭能力;而当使用Al2O3、TiO2和MgO 负载Co 时,金属氧化物和载体之间发生强烈的相互作用,形成低反应活性的化合物,如CoAl2O4、CoTiO3和Mg0.4Co0.6O。曾良鹏[49]等采用水热法制备了Co3O4/CeO2和Ce1-yCoyO2-δ(y=0.1~0.4)两个系列复合金属氧化物,考察了这些氧化物作为氧载体参与甲烷化学链转化的反应性能。结果表明,Ce1-yCoyO2-δ氧载体形成了Ce-Co-O 固溶体,储氧能力明显增强,体相晶格氧迁移速率与甲烷活化速率匹配较好,甲烷反应产物以合成气为主,有利于甲烷化学链重整;Co3O4/CeO2氧载体中CeO2与Co3O4之间的相互作用改善了材料的储氧能力和氧化活性,其与甲烷反应时主要生成CO2和H2O,有利于甲烷化学链燃烧;两种氧载体在连续化学链循环实验中均表现出较好的再生性和循环稳定性。
2.2 复合金属系氧载体
与单一金属氧化物相比,复合金属氧化物大多是非化学计量的,在氧化还原反应中具有优异的氧传递能力,并且通常具有良好的热稳定性和高的机械强度[50]。当前研究的复合金属系氧载体主要有钙钛矿型氧载体、CeO2类氧载体和六铝酸盐氧载体等。
2.2.1 钙钛矿型氧载体
钙钛矿型复合金属氧化物的结构通式为ABO3,其中A 位是较大的金属阳离子,通常是镧系金属或碱土金属离子,与氧离子形成12 配位。B 位是较小的阳离子,通常是过渡金属离子,与6 个氧离子形成八面体的BO6型结构。当A、B 位离子被部分取代后,其晶体结构不会发生明显改变,性能却显著改善。对A、B 位进行低价态的阳离子取代能够产生氧缺陷,从而改变氧的吸/ 脱附性质,提高氧载体的储/释氧能力,使氧化还原反应过程更容易发生[51]。

图4 核-壳结构氧化还原催化剂的示意图[52]
代小平等[53]和Mihai 等[54-55]发现钙钛矿中的晶格氧对合成气具有很高的选择性,他们还证实LaFeO3钙钛矿不仅在氧化还原气氛中保持较高的反应活性和结构稳定性,而且LaFeO3有相对高的可逆储氧量,因此,LaFeO3被认为是非常有吸引力的氧载体材料之一。Zhao 等[56]用燃烧法制备了Sr取代的La1-xSrxFeO3(x=0,0.3,0.5,0.9)钙钛矿型氧化物,结果表明,La1-xSrxFeO3中的晶格氧适合甲烷部分氧化生成合成气,这主要是因为Sr2+部分取代La3+增加了氧缺陷位,提高了氧载体的供氧能力。李凡星等[52,57-59]制备了一系列以Fe2O3为核,以钙钛矿为壳的Fe2O3@LaxSr1-xFeO3-δ(LSF)核壳型氧载体,如图4 所示,将Fe2O3的高氧容量和钙钛矿的高合成气选择性结合起来,该核壳型氧载体表现出优异的反应活性、合成气选择性,并在100 次循环反应中没有出现失活现象。显然,氧载体的氧化还原性质与其微观结构密切相关。近来,何方[60-61]课题组发现将钙钛矿型氧化物设计成三维有序大孔(3DOM>5nm)结构,不仅有利于增大氧载体的有效活性表面积,更有利于反应气体在氧载体孔道内的扩散和传质,提高了氧载体的整体反应性能。表1总结了钙钛矿材料在化学链重整中的应用。总之,钙钛矿氧载体作为甲烷化学链重整制合成气技术中一种十分具有前景的氧载体,具有较好的氧移动性和热稳定性,但甲烷转化率低限制了其更高合成气收率的获得,氧载体的性能有待于继续提高。通过不同的制备方法、以不同的A/B 位离子取代、或将钙钛矿与其他材料复合来提高合成气收率是一个值得继续探索的研究方向。
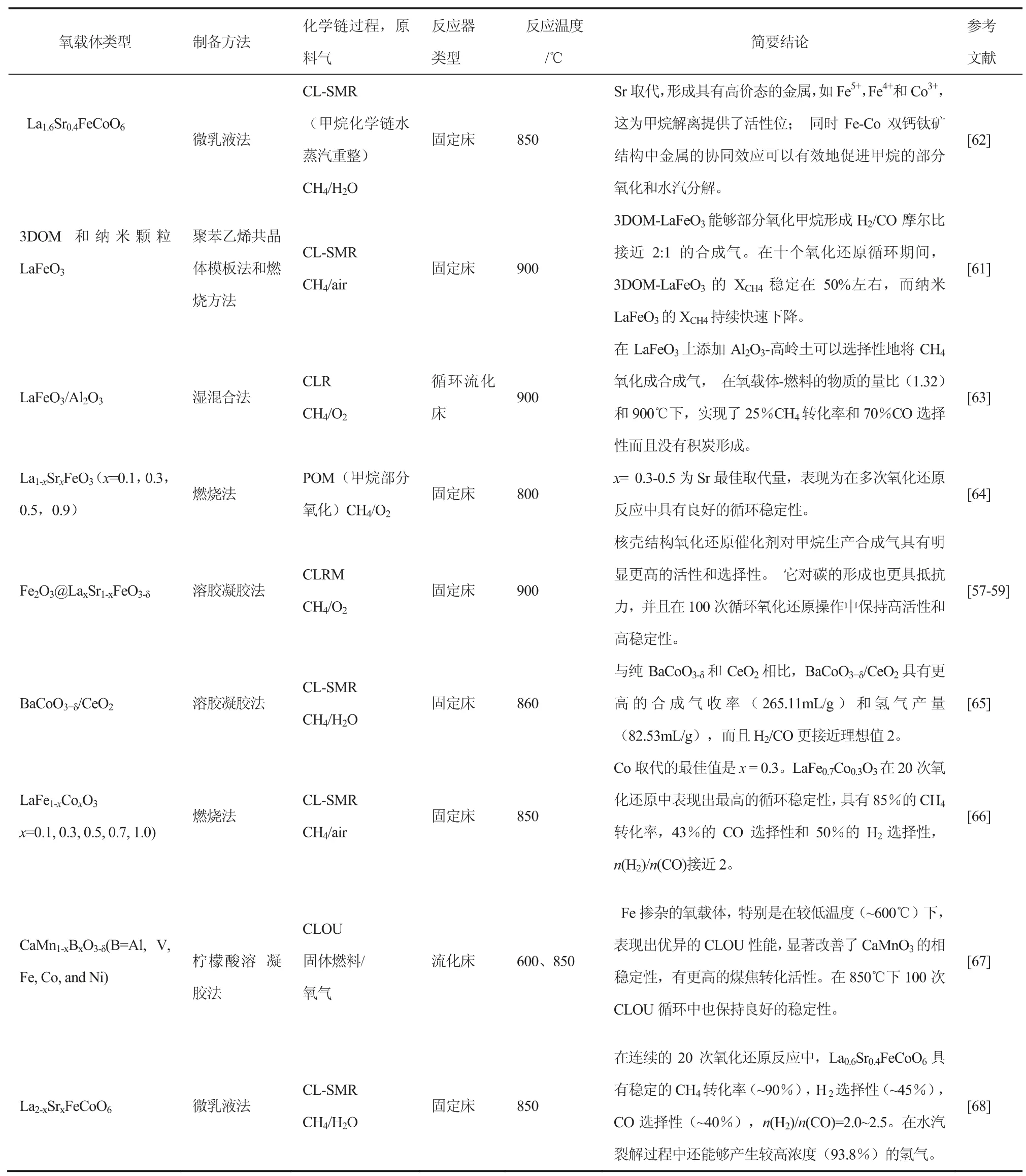
表1 钙钛矿材料在化学链过程中的应用
2.2.2 CeO2型氧载体
CeO2属于典型的萤石型结构,萤石型结构因CaF2而得名,属于等轴晶系面心立方体结构[69]。在这一结构中,金属阳离子按面心立方配位,这样的结构中有许多八面体空位,可允许离子快速扩散,当Ce4+离子被低价阳离子取代时,将产生氧空位[70],此外,Ce4+/Ce3+相互转化易形成氧空位,特别是两个Ce4+离子被两个Ce3+离子取代时,会产生更多的氧空位或晶格缺陷,表现出较高的储存及释放氧的能力[71]。
Zheng[72]等发现大孔CeO2-ZrO2氧载体在CLSRM(甲烷化学链水蒸汽重整)过程中具有比无孔样品更高的还原性和反应性,这是因为多孔结构可以加速体相内氧的释放,增强氧的流动性进而提高氧载体的还原性。
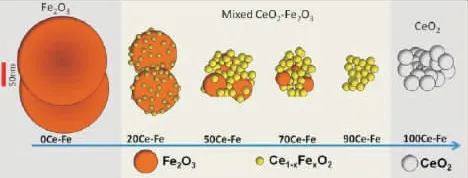
图5 Ce-Fe 结构随组成变化的演变示意图[74]
李孔斋等[73]通过共沉淀法制备了CeO2-Fe2O3、CeO2-ZrO2和ZrO2-Fe2O3三种复合氧载体,发现相比ZrO2-Fe2O3和CeO2-ZrO2,CeO2-Fe2O3氧载体的合成气选择性较高并且n(H2)/n(CO)比接近为2,这归因于分散的Fe2O3和Ce-Fe 固溶体之间的强相互作用,在连续的CH4/air 还原氧化循环中,CeO2-Fe2O3还保持高的反应活性和结构稳定性。Galvita[74]等发现在Fe2O3中加入适量的CeO2,通过形成立方CeO2固溶体二者具有强相互作用,能够有效抑制Fe2O3的烧结,提高其循环稳定性,其Ce-Fe 结构随组成变化的演变见图5。随后,Galvita[75]等制备了双功能5% Ni/CeO2-Fe2O3(1:1)氧载体并将其用于(CH4+CO2)/CO2氧化还原循环过程中。结果表明Ni的加入在还原过程中能够加深CeO2-Fe2O3的还原,在CO2氧化过程中还能够活化更多的CO2,提高了CO 产量。Zheng[76]等人将CeO2(2~3nm)负载在3DOM 的LaFeO3钙钛矿上,发现CeO2-LaFeO3强相互作用导致了Ce3+和Fe2+的形成,Ce3+和Fe2+离子的共存诱导了大量的氧空位,极大地提高了甲烷的反应活性和氧移动性;10%CeO2/LaFeO3氧载体在不产生积炭的情况下,表现出最高的合成气收率(9.94mmol/g)和纯氢产率 (3.38mmol/g),远高于LaFeO3样品(5.73mmol/g 合成气收率和2.00mmol/g纯氢产率)。可见,CeO2的存在不仅可以提高氧载体的抗积炭能力,而且与钙钛矿材料复合还可以提高合成气的产量。总之,CeO2基氧载体因其晶格氧活性高,氧化还原性能好,热稳定性高等在化学链转化中受到了广泛的关注,但纯CeO2氧载体活化甲烷能力较差,合成气收率较低,因此,通过不同制备方法或将CeO2与其他材料复合等手段来提高甲烷转化率和合成气产量仍是需要研究的重点。
2.2.3 六铝酸盐型氧载体

图6 (a)β-Al2O3型和(b)MP 型六铝酸盐的晶体结构示意图[77]
六铝酸盐是由互成镜像的尖晶石结构单元和传导镜面层沿c 轴交替堆积而成的具有六方层状结构的晶体(如图6 所示)[77]。六铝酸盐的表达通式为AMxAl11-xO17-α或AMxAl12-xO19-α,其中A 是碱金属(如Na,K 等)、碱土金属(如Mg,Ca,Sr,Ba 等)或稀土金属(Ln3+=La,Pr,Nd,Sm,Eu,Gd 等)等大阳离子,存在于镜面层中[78-79];M 是过渡金属(Mn,Fe,Co,Cu,Ni 等)或贵金属离子(Ir,Ru,Pd,Rh)等,可部分或完全取代结构中Al 的晶位。根据大阳离子的离子半径、电荷和数目的不同,六铝酸盐的晶体结构分为β-Al2O3和磁铅石(MP)两种类型。当A 为Ba或碱金属时,六铝酸盐的晶体结构类型为β-Al2O3型;当A 为非Ba 碱土金属或稀土金属时,六铝酸盐的晶体结构为MP 型。当六铝酸盐结构中的Al3+被过渡金属或贵金属取代时,一方面利用六铝酸盐的晶格镶嵌作用,可保持活性金属的高度分散,改善六铝酸盐的氧化还原行为,另一方面利用六铝酸盐晶格间的强相互作用,可有效抑制活性金属在高温条件下的烧结,从而保持其高温稳定性[80]。因此,六铝酸盐被认为是最有前景的高温催化材料之一,主要应用在甲烷催化燃烧[81]、甲烷部分氧化[82]、甲烷二氧化碳重整[83]和高温N2O 分解[84]等方面。
2012 年,Bhavsar[85]首次将Fe 负载的六铝酸盐应用于CLDR(化学链干重整)中,并将其与Fe@SiO2进行对比,发现核-壳结构的Fe@SiO2由于Fe2SiO4的形成,在CO2活化中表现出非常低的活性,而Fe 负载的六铝酸盐在500~800℃下CH4/CO2氧化还原循环过程中显示出高的氧化还原活性和稳定性。田鸣[86]等将Fe 取代的BaFexAl12-xO19(x=1~4)六铝酸盐作为甲烷CLC 氧载体,发现其在与CH4反应产生CO2和H2O 的过程中能够依然保持六铝酸盐结构而不被破坏,从而抑制了在后续O2氧化过程中的颗粒聚集,因此在800℃多次甲烷CLC 氧化还原过程中表现出优异的抗烧结性能。随后,田鸣[87]等制备了掺杂La 的Fe2O3/α-Al2O3氧载体并将其用于CLC 技术中,发现加入质量分数为18%的La 的Fe2O3/α-Al2O3在50 次(CH4/O2)循环过程中表现出优异的反应活性和氧化还原稳定性,这种优异的性能主要归因于LaAl12O19六铝酸盐晶相的形成,其可以作为粘合剂阻止Fe2O3和载体Al2O3因烧结和破裂引起的相分离,而相同条件下,以质量分数为5%的La 修饰的α-Al2O3做载体的铁基氧化物则出现烧结和破碎。
近期,我们课题组朱燕燕[88]等将六铝酸盐氧载体应用于CLDRM 中,发现LaFe3Al9O19六铝酸盐氧载体在50 次CH4/CO2氧化还原循环过程中表现出高的合成气收率、CO 产量和循环稳定性。在六铝酸盐结构中,不同晶格氧与CH4的反应活性顺序为O6-Fe3+(Oh)>O5-Fe3+(Tr)>O4-Fe3+(Th),其中,O6-Fe3+(Oh)能够高选择性地将甲烷完全氧化为CO2和H2O,O5-Fe3+(Tr)和O4-Fe3+(Th)可以高选择性地将CH4部分氧化成合成气。与强氧化能力的O2相比,具有弱氧化能力的CO2只能选择性再生O5-Fe3+(Tr)和O4-Fe3+(Th),因此CO2氧化更有利于提高再生后氧载体的合成气选择性,这为CO2利用(定向转化为CO)提供了一种新思路;此外,六铝酸盐氧载体在与CH4反应产生合成气的过程中,深度还原并没有破坏六铝酸盐的晶相结构,归因于Fe3+→Fe2+的还原有效补偿了La 系MP 型六铝酸盐的过多正电荷,即六铝酸盐的电荷补偿机制有利于其保持高循环稳定性。进一步地,朱燕燕[89]等制备了不同温度(900~1200℃)焙烧的La-Fe-Al(LFA)氧载体,并系统考察了焙烧温度和氧化还原处理对其CLDR 性能的影响。研究发现,焙烧温度极大地影响氧载体的晶相结构:当焙烧温度为900℃时,样品为LaFeO3,Fe2O3和α-Al2O3混合晶相;焙烧温度为1000℃时,样品为LaFexAl1-xO3和六铝酸盐的混合晶相;焙烧温度为1100 和1200℃时,样品为纯相的La 系六铝酸盐。900~1000℃焙烧后的样品在CH4/CO2还原氧化过程中均会反复发生相分离,金属Fe 和FeAl2O4的出现会导致严重的CH4裂解和积炭产生。1100~1200℃焙烧后的样品在还原氧化过程中表现出良好的稳定性,但1200℃由于焙烧温度过高导致样品烧结,从而抑制晶格氧从体相到表面的迁移,只有1100℃焙烧的样品具有适中的晶粒尺寸,在10 次CH4/CO2还原氧化循环过程中表现出优异的活性和稳定性,生成H2/CO 接近2 的合成气。六铝酸盐氧载体因其优异的高温稳定性、良好的氧化还原活性以及层状结构特性,在甲烷化学链技术中有很大的应用前景,对六铝酸盐在不同制备方法、不同金属取代或与其他材料复合等方面可进行深入的研究。
3 结语与展望
甲烷化学链重整(CLR)通过引入金属氧化物作为氧载体在还原反应器和氧化反应器之间循环再生,能够避免使用纯氧带来的爆炸风险,并且还能大幅提高合成气的选择性,合成气n(H2)/n(CO)接近于2。开发具有强氧化还原活性、良好机械性能和优异高温稳定性的氧载体是CLR 的关键。在各种金属氧化物中,Ni、Fe、Cu 和Co 等过渡金属的氧化物被认为是最适用于CLR 技术的氧载体材料,但是单一的金属氧载体的部分性能难以满足工艺要求,通常将其担载在惰性载体上或添加其它金属组分以提高其CLR 综合反应性能。除了上述过渡金属氧载体外,复合金属氧载体在CLR 制取合成气方面也取得了显著的成效。其中钙钛矿型和萤石结构的CeO2氧载体分别因其优异的稳定性和丰富的氧空位而受到关注,但其氧化还原活性还有待提高,可以通过调控其形貌、不同离子取代或与其他氧化物复合等方法来提高其合成气收率。近年来,六铝酸盐氧载体也开始应用于甲烷化学链技术中,并取得了不错的进展,六铝酸盐因结构中大阳离子和Al3+离子可取代且取代量可调控的特性,在甲烷化学链技术中展现出了优异的氧化还原活性和高温稳定性。
氧载体的结构特佂决定了其反应性能,尽管大量的研究工作已经对各类氧载体有了比较深入的认识,但是还不够。随着制备技术、原位或准原位表征手段和计算化学的发展,进一步的研究可从以下几方面展开:
(1)建立制备方法、金属取代和与其他氧化物复合对氧载体微观结构和氧移动性的调控规律。利用不同制备方法调控氧载体的形貌、晶粒尺寸、比表面积、金属分散度、化学状态等;考察金属取代和金属与载体相互作用强度对氧载体微观结构和氧移动的影响。
(2)结合多种原位或准原位表征手段,从分子水平上建立起氧载体在CH4还原和air/CO2/H2O 氧化过程中的微观结构变化特征与甲烷CLR 反应性能之间的构效关系。
(3)结合计算机模拟和理论计算,研究氧载体在高温氧化还原环境下甲烷化学链反应机理,氧载体在氧化还原反应过程中的速率控制步骤等,为新型高效长寿命氧载体的设计提供理论基础和研制方向。

