禽沙门菌分离鉴定方法的建立与优化
张富友 宋艳 崔治中 孙淑红
禽沙门菌分离鉴定方法的建立与优化
张富友 宋艳 崔治中 孙淑红*
(山东农业大学动物科技学院 山东 泰安 271018)
本研究旨在建立和优化禽沙门菌分离鉴定的方法。选择山东省某地方品种鸡疑似发生沙门菌病的未出壳死胚样品24份,通过4组不同的培养基组合比较沙门菌的分离情况,选择沙门菌通用引物两对和鸡白痢特异性引物一对进行分离株的PCR检测,比较其特异性,然后进行血清分型和MLST分型,确定沙门菌类型并研究其相关性。结果表明,该批样品中TTB比SC增菌效果好,XLD和XLT4选择培养基对沙门菌分离效果相同,最终通过PCR方法鉴定出沙门菌阳性率为58.3%;发现两对通用引物特异性一致,表明可任选一对引物进行PCR鉴定;用鸡白痢沙门菌特异性引物完成的PCR鉴定结果显示,14株沙门菌中有7株为鸡白痢沙门菌;血清型鉴定结果表明,14株沙门菌中有7株鸡白痢沙门菌、7株肠炎沙门菌,共两种血清型;MLST分子分型结果表明,14株沙门菌分为3个ST型,分别是7株ST11、3株ST92和4株ST2151,其中ST11为肠炎沙门菌,ST92和ST2151为鸡白痢沙门菌;本研究表明,疑似沙门菌感染样品经BPW和TTB增菌、XLD或XLT4选择培养基分离培养,最后通过PCR方法可准确完成沙门菌的分离鉴定;同时,应用该方法可完成对鸡白痢沙门菌的鉴定,并与血清分型和MLST分子分型结果一致。
禽沙门菌 PCR 血清型 MLST 相关性分析
禽沙门菌是一种革兰氏阴性菌,兼性厌氧。鸡感染沙门菌后会引发鸡沙门菌病,包括鸡白痢杆菌病、鸡副伤寒和鸡伤寒等病[1]。其中鸡白痢是国际动物卫生组织法定报告的B类传染病,也是我国农业部要求的重点检测的十四种动物疫病之一[2]。各种品种的鸡对沙门菌均易感,尤其是3周龄以内的雏鸡感染后,死亡率最高[3]。成年鸡感染呈慢性或阴性经过[4]。沙门菌传播途径广,主要经过种蛋传播,此外环境、饮水、饲料等污染后,可以造成鸡群感染[5]。沙门菌病一年四季均可发生,死亡率和造成的经济损失与鸡场净化程度和饲养管理水平密切相关[6]。
近年来沙门菌感染的事件频发,其中从鸡蛋和禽肉中都检测到沙门菌感染,威胁人类饮食安全和健康,同时沙门菌感染鸡群后,造成雏鸡死亡、育成鸡和成鸡生长发育迟缓,产蛋率下降等,给养殖业带来巨大的损失[7]。目前对沙门菌没有有效的治疗方法,只有通过净化淘汰阳性鸡,加强卫生检疫和管理,保护阴性群体等一系列措施,才能有效控制沙门菌造成的损害[8]。对于保种场,只能通过净化淘汰来保证鸡群的百分之百阴性[9]。本研究针对此问题建立并优化了沙门菌的检测方法,为沙门菌净化提供指导建议和技术支持。
1 材料与方法
1.1 材料来源 山东省某地方品种鸡疑似发生沙门菌病的未出壳死胚样品,共24份。
1.2 试剂 沙门菌属诊断血清购自宁波天润生物药业有限公司;细菌基因组DNA提取试剂盒购自北京天根生物科技有限公司;胶回收试剂盒购自OMEGA公司;缓冲蛋白胨水(BPW)、四硫磺酸盐煌绿增菌液基础(TTB)、碘液、0.1%煌绿、XLT4琼脂均购自青岛海博生物技术有限公司;2×Taq Master Mix购自南京诺唯赞生物科技有限公司。
1.3 分离培养 无菌取鸡胚肝脏、部分肠段样品,剪碎,加入BPW预增菌,37℃、220rpm/min培养12~18h,然后共分为四个组合,即分别用SC培养基和TTB培养基培养,37℃、220rpm/min培养18~22h,再分别用三线法接种到XLD和XLT4平板,37℃培养24~48h。
1.4 PCR鉴定 合成两对沙门菌通用引物FimW和invA以及鸡白痢沙门菌特异性检测引物ipaJ[10-12],由睿博兴科生物技术有限公司合成,引物详情见表1。

表1 FimW和ipaJ引物序列及片段大小
从XLD和XLT4平板上分别挑取2~4个可疑菌落,接种到LB培养基中培养,用菌液作为模板,PCR扩增体系为25μl,其中2×PCR Master Mix(含有2×Taq DNA聚合酶、2×PCR Buffer和2×dNTP) 12.5μl、以可疑菌落LB增菌液为模板1μl、上下游引物(10pmol/μl)各1μl、ddH2O 9.5μl。FimW引物反应程序为:94℃ 5min(预变性),94℃ 45s(变性),50℃ 45s(退火),72℃ 1min(延伸),共35个循环,72℃ 7min(延伸),4℃结束。invA引物反应程序为:95℃ 10min(预变性),95℃ 30s(变性),55℃ 45s(退火),72℃ 45s(延伸),共30个循环,72℃ 10min(延伸),4℃结束。ipaJ引物反应程序为:94℃ 10min(预变性),94℃ 45s(变性),58℃ 45s(退火),72℃ 1min(延伸),共30个循环,72℃ 10min(延伸),4℃结束。PCR扩增结束后取8μl用于电泳检测,用1%琼脂糖凝胶电泳,电压120V,电泳45min,以DNA Marker DL2000为参照用凝胶成像仪成像观察。
1.5 血清学鉴定 参考沙门菌属诊断血清试剂盒说明书进行沙门菌血清型的鉴定。
1.6 多位点基因序列分型(MLST) (1)MLST引物设计:参考MLST官方网站(http://mlst.Warwi ck.ac.uk/mlst/dbs/Senterica)上公布的七对管家基因的片段序列(aroC,dnaN,hemD,hisD,purE,sucA,thrA),并由睿博兴科生物技术有限公司合成所需引物。引物序列见表2。(2)细菌DNA的提取:参考细菌基因组DNA提取试剂盒说明书提取沙门菌分离株的DNA。(3)PCR反应条件:PCR扩增体系为50μl,其中2×PCR Master Mix(含有2×Taq DNA聚合酶、2×PCR Buffer和2×dNTP) 25μl、DNA模板2μl、上下游引物(10pmol/μl)各2μl、ddH2O 19μl。反应程序:94℃ 5min(预变性),94℃ 45s,55℃ 45s(退火),72℃ 1min,共35个循环,72℃ 7min(延伸),4℃结束。(4)PCR产物纯化:将PCR产物全部用于电泳检测,用1%琼脂糖凝胶电泳,电压120V,电泳45min,以DNA Marker DL2000为参照用凝胶成像仪成像观察,并将有目的片段的琼脂凝胶切下,装到预先准备好的离心管中,然后参考胶回收试剂盒说明书继续PCR产物的纯化。(5)测序及结果分析:将上述纯化后的PCR产物交于上海生物工程技术有限公司进行测序。下载沙门菌管家基因全部数据库,然后建立本地数据库,对测序结果剪切后进行序列比对,记录七对管家基因的等位基因数值,然后通过PubMLST网站查询ST型。

表2 沙门菌七对管家基因的引物序列
1.7 相关性分析 将菌落形态观察、PCR鉴定、血清学鉴定和MLST分子分型等结果进行相关性分析。
2 结果
2.1 分离培养结果 SC增菌液、TTB增菌液分别在XLT4和XLD两种选择培养基培养后,部分样品均出现无色半透明的菌落或有黑色中心的菌落(疑似鸡白痢沙门菌或其他沙门菌),比例分别为13/24、13/24、14/24和14/24。结果表明,该批样品中TTB比SC增菌效果好,XLD和XLT4对沙门菌分离效果相同(表3)。

表3 不同培养基组合对沙门菌分离结果
2.2 PCR鉴定结果 用invA和FimW两对引物分别用PCR方法鉴定,结果表明:两对通用引物检测结果相同,可以随意任意选择一种使用(图1、2);用ipaJ引物进行PCR方法鉴定,结果显示有7株鸡白痢沙门菌(图3)。
2.3 血清分型结果 平板凝集试验结果表明,14株沙门菌分为2种血清型,即肠炎沙门菌7株(50%)和鸡白痢沙门菌7株(50%)(表4)。

图1 用invA引物对部分菌株的PCR鉴定结果
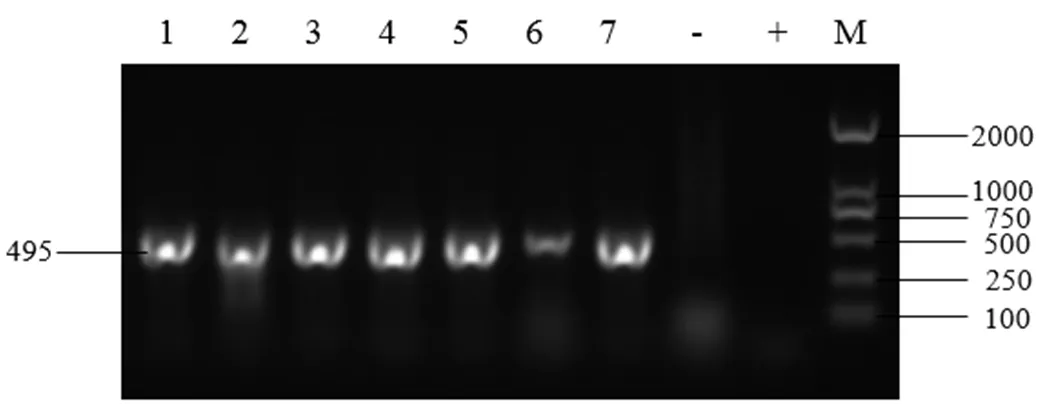
图2 用FimW引物对部分菌株的PCR鉴定结果
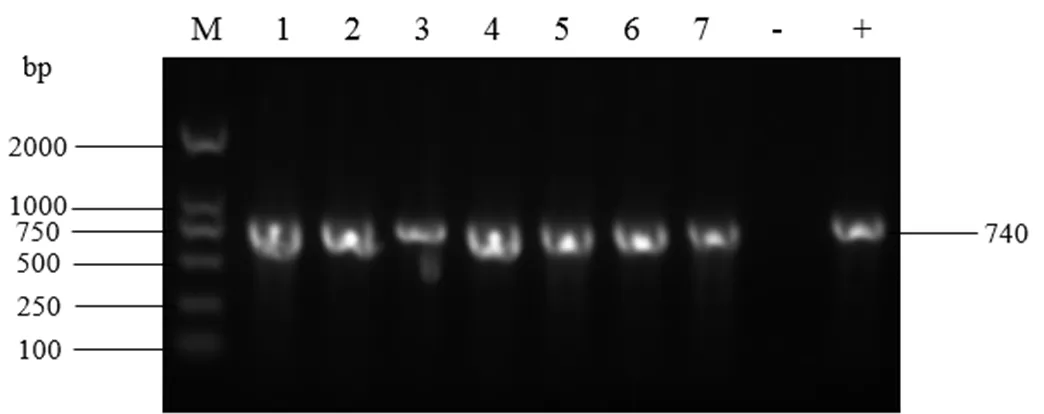
图3 用ipaJ引物对部分菌株的PCR鉴定结果
2.4 多位点基因序列分型(MLST)结果 利用MLST技术对14株沙门菌分离株进行基因分型,14株沙门菌共有3种ST型,分别是ST11、ST92和ST2151,其中ST11为肠炎沙门菌(表4),ST92和ST2151为鸡白痢。

表4 沙门菌分离株的ST型
2.5 相关性分析结果 XLT4和XLD培养基上有14个样品疑似沙门菌,其中有7个样品呈现有黑色中心的菌落形态,7个样品呈现无色半透明小菌落形态(疑似鸡白痢沙门菌);PCR结果显示,有14株沙门菌,其中7株为鸡白痢沙门菌;血清学结果显示,14株沙门菌分为2种血清型,分别为7株肠炎沙门菌和7株鸡白痢沙门菌;MLST结果显示,14株沙门菌分为3种ST型,分别为ST11、ST92和ST2151,其中ST11为肠炎沙门菌,ST92和ST2151为鸡白痢沙门菌。通过对其相关性进行分析,发现菌落形态观察、PCR鉴定、血清分型和MLST分子分型结果一致。
3 讨论
(1)鸡白痢沙门菌在XLD和XLT4培养基上形态为无色半透明菌落,生长较慢,培养48h左右,菌落直径大约0.5㎜,其他沙门菌在该培养基上形态为有黑色中心的菌落,但是在密度较大的情况下,菌落没有黑色中心,并且存在其他形态类似的细菌干扰,因此,只从菌落形态进行判断有一定难度。考虑到鸡白痢沙门菌菌落比较小,通过挑取单菌落接种到LB培养基,更利于PCR结果准确性,并且方便分离菌株的保存。我们参照文献合成鸡白痢特异性引物,并进行验证,发现其可靠性较高,且快速方便。沙门菌属诊断学清可以通过检测沙门菌的抗原结构,从而判断血清型,但是由于结果需要眼观判断,主观性较强,存在误差。MLST分型作为一种分子分型技术,准确性高,但是需要对七对管家基因分别测序,对细菌DNA质量要求较高,并且需要对测序结果进行处理分析,综合七对管家基因的等位基因数值,通过网上数据对比确认相应菌株的ST型,由于ST管家基因存在点突变,ST会改变,因此不能只根据此结果判断菌株的分型。此外还有PFGE方法以及全基因组对菌株进行分型,但是成本高、操作难度大,目前只适用于科学研究。(2)本研究中,观察XLD和XLT4选择培养基上菌落形态,可以看到无色透明小菌落和有黑色中心的疑似沙门菌菌落,也存在一些透明但是正面观察呈现褐色的菌落干扰,显然,眼观判断不够准确;需补充PCR鉴定。本研究结果表明,经分离培养后,眼观判断可疑的菌落再选择沙门菌通用引物经PCR方法鉴定可完成沙门菌的分离鉴定,结果可靠、快速;该方法同样适用于鸡白痢沙门菌的分离鉴定。(3)血清型鉴定表明,14株沙门菌主要血清型是肠炎沙门菌(50%)和鸡白痢沙门菌(50%);MLST结果表明,14株沙门菌分为三种ST型,分别是ST11、ST92和ST2151,其中ST92和ST2151为鸡白痢沙门菌,ST11为肠炎沙门菌,该结果与血清分型结果一致。一种ST型对应着一种血清型或者几种ST型对应着一种血清型,说明这两种方法可以对沙门菌进行准确分型,而两种方法的相互验证,可确保沙门菌分型准确结果。(4)本研究发现,禽沙门菌的分离鉴定可通过菌落形态观察与PCR方法结合等完成其准确鉴定;并发现其与血清分型、MLST分子分型结果完全一致。
[1] Maiden M C J, Van Rensburg M J J, Bray J E, et al. MLST revisited: the gene-by-gene approach to bacterial genomics[J]. Nature Reviews Microbiology, 2013, 11(10): 728-736.
[2]王远能. 鸡白痢的流行症状及诊治措施[J]. 养殖技术顾问, 2010(11): 62-63. DOI: 10.3969/j.issn.1673-1921. 2010. 11. 060.
[3] 李海琴. 鸡白痢流行特点及净化技术要点[J]. 农村百事通, 2014(13).
[4] 李求春, 徐耀辉, 黄金林等. 鸡白痢沙门菌ipaJ基因的克隆与鉴定[J]. 微生物学报, 2010, 50(11).
[5] 杨育楷. 鸡白痢病的诊断与防制[J]. 云南农业, 2017(1): 43-45.
[6] 徐磊, 李军朝, 陶娅等. 鸡白痢沙门菌的分离鉴定与耐药性分析[J]. 中国家禽, 2018.
[7] 鸡白痢沙门菌病原的分离鉴定及耐药性分析[J]. 中国畜牧兽医, 2017(9)..
[8] 程云锋. 沙门菌病—鸡白痢研究概述[J]. 中国畜牧兽医文摘, 2017, 33(3): 203-205.
[9] 赵翠, 张庆, 郭树源等. 山东省动物源沙门菌MLST和血清分型与分布研究[J]. 中国人兽共患病学报, 2017, 33(9): 793-799.
[10] 张江英, 董立伟, 王小舟等. 针对fimW基因沙门菌的特异性PCR检测[J]. 中国预防兽医学报, 2013, 35(10): 837-839.
[11] 张秀芹, 杜柏林, 韩文瑜. 活禽与饲料源沙门菌的分离鉴定及其耐药性对比研究[J]. 饲料工业, 2013, 34(18): 46-48.
[12] 徐黎娟. 基于ipaJ基因鉴定鸡白痢沙门菌PCR方法的建立及IpaJ抑制宿主NF-κB信号通路机制的研究[D]. 扬州大学: 杨州, 2018.
(2019–07–21)
国家十三五重点研发计划项目: 2016YFD0501608;山东农业重大应用技术创新项目(SD2019XM009)
S852.61+2
A
1007-1733(2019)08-0001-04

