7种黄檀属植物心材挥发油的成分分析及其抗菌活性
王军 王昊 杨锦玲 蔡彩虹 王佩 董文化 梅文莉 戴好富


摘 要 為了研究7种黄檀属(Dalbergia L.)植物心材的挥发性成分及其抗菌活性,采用水蒸气蒸馏法提取黄檀属植物心材的挥发性成分,气相色谱质谱联用技术(GC-MS)对其化学成分进行分析;采用滤纸片琼脂扩散法测定挥发性成分的抗菌活性。结果表明,两粤黄檀检出9种成分,占总含量的98.93%;斜叶黄檀检出6种成分,占总含量的91.80%;交趾黄檀检出13种成分,占总含量的86.23%;海南黄檀检出9种成分,占总含量的94.86%;降香黄檀检出8种成分,占总含量的97.38%;东京黄檀检出8种成分,占总含量的97.72%;白沙黄檀检出23种成分,占总含量的79.45%。两粤黄檀和斜叶黄檀相对百分含量最大的成分为榄香素,分别为83.38%和73.03%;交趾黄檀中相对百分含量最大的成分为美迪紫檀素,为27.72%;海南黄檀中相对百分含量最大的成分为亚油酸,为42.80%;降香黄檀和东京黄檀中相对百分含量最大的成分为(7R,10S)-2,6,10-三甲基-7,10-环氧-2,11-十二碳-6-醇及其同分异构体,二者之和分别为60.37%和53.23%;白沙黄檀中已鉴定出且相对百分含量较大的成分为榄香素,为7.81%。黄檀属植物心材挥发性成分主要有苯丙素类、倍半萜类、黄酮类、脂肪酸类和甾体等,黄檀属植物心材的挥发性成分均对金黄色葡萄球菌具有抑制作用,部分挥发油对不同的农业病原菌具有一定的抑制作用。本研究为黄檀属植物的资源保护和开发利用提供了科学依据。
关键词 黄檀属植物心材;化学成分;气相色谱-质谱联用;抗菌活性
中图分类号 S792.28 文献标识码 A
Abstract The volatile constituents of the heartwood from seven different Dalbergia plants were extracted by the water distillation method, and further analyzed with GC-MS aiming to investigate the chemical constituents. The antibacterial activities of the volatile oils were assayed by the filter paper agar disc diffusion method. Nine components were detected from D. benthamii, accounting for 98.93% of the total content. Six components were detected from D. pinnata, accounting for 91.80% of the total content. Thirteen components were detected from D. cochinchinensis, accounting for 86.23% of the total content. Nine components were detected from D. hainanensis, accounting for 94.86% of the total content. Eight components were detected from D. odorifera, accounting for 97.38% of the total content. Eight components were detected from D. tonkinensis, accounting for 97.72% of the total content. 23 components were detected from D. peishaensis, accounting for 79.45% of the total content. Elemicin was the highest component with relative percentage content in D. benthamii and D. pinnata, 83.38% and 73.03% respectively. The highest component of D. cochinchinensis was medicarpin with a value of 27.72%. The highest component of D. hainanensis was linoleic acid with a value 42.80%. The highest component of D. odorifera and D. tonkinensis was (7R,10S)-2,6,10-trimethyl-7,10-epoxy-2,11- dodecadien-6-ol and its isomer, with values of 60.37% and 52.23% respectively. The component identified and with relatively high content of D. peishaensis was elemicin with a value of 7.81%. The phenylpropanoid compounds, sesquiterpenoids, flavonoids, fatty acids, and steroids etc. were the main components of the volatile constituents from the heartwood of Dalbergia plants. All volatile oils from the heartwood of Dalbergia plants exhibited an inhibitory effect on Staphylococcus aureus, and some also had certain inhibitory effects on different agricultural pathogens. This research could provide a scientific basis for the resource conservation and exploitation of Dalbergia plants.
Keywords heartwood of Dalbergia spp.; chemical constituents; GC-MS; antibacterial activity
DOI 10.3969/j.issn.1000-2561.2019.07.013
黄檀属(Dalbergia L.)植物为乔木、灌木或木质藤本,全世界有100~120种,主要分布于亚洲、非洲和美洲的热带和亚热带地区,大洋洲和波利尼西亚仅有数种[1],中国有29种(14个特有种,1个归化种)[2]。该属树种作为紫胶虫的优良寄主植物,具有特殊的经济价值,而其心材又为高档雕刻装饰和家具等的用材。黄檀属多种植物具有药用价值,其中降香黄檀(D. odorifera T. C. Chen)树干和根的干燥心材,即降香,据药典中记载,其性味辛、温、归肝、脾经、化瘀止血、理气止痛、主要用于治疗吐血、外伤出血、肝郁胁痛、胸痹刺痛、跌扑伤痛、呕吐腹痛[3]。近年来,对黄檀属多种植物心材的化学成分及其生物活性的研究表明,黄檀属植物化学成分主要为黄酮及其苷类、香豆素类、醌类、酚类和三萜类等[4],具有抗氧化[5]、抗炎[6]、抗菌[7-10]、抗糖尿病[11]等作用。黄檀属植物心材的化学成分的研究主要集中于降香黄檀,有关降香黄檀的化学成分及生物活性的研究较多[12],其化学成分包括挥发油[13-14]、黄酮类[15-18]、桂皮酰酚类[19]和其他成分[20-21],药理活性有抗氧化[22]、保护心血管[23-24]、抗肿瘤[25]等生物活性。另外,对两粤黄檀(D. benthamii)[26]、斜叶黄檀(D. pinnata)[27]、交趾黄檀(D. cochinchin en sis)[28-31]、东京黄檀(D. tonkinensis)[32-33]和海南黄檀(D. hainanensis)[34]的化学成分及其生物活性报道较少,而尚未见对白沙黄檀的化学成分报道。本文采用水蒸气蒸馏法对7种黄檀属植物心材——两粤黄檀、交趾黄檀、海南黄檀、降香黄檀、白沙黄檀、斜叶黄檀和东京黄檀的化学成分进行提取,利用气相色谱-质谱联用技术(GC-MS)对其化学成分进行分析,并对提取物的抗菌活性进行测试,旨在进一步明确黄檀属植物心材化学成分及其抗菌活性,比较其异同,为黄檀属植物的开发利用提供科学指导。
1 材料与方法
1.1 材料
1.1.1 植物材料 黄檀属植物心材于2014年收集,其中降香黄檀、东京黄檀由海南省黄花梨博物馆提供,交趾黄檀购自广西龙津,其余样品均采自海南,由中国热带农业科学院热带生物技术研究所王军博士和洪少友共同鉴定,凭证标本(DL2014001~DL2014007)均存放于中国热带农业科学院热带生物技术研究所。样品信息见表1。1.1.2 生物活性测试材料 金黄色葡萄球菌(Staphylococcus aureus)ATCC 51650购于海南省药品检验所,硫酸卡那霉素和多菌灵购于上海生工有限公司。培养基采用牛肉膏蛋白胨琼脂培养基(NA):牛肉浸膏3 g,蛋白胨5 g,葡萄糖2.5 g,琼脂20 g,定容至1 L,pH 7.0~7.2。烟草青枯病菌(Ralstonia solanacearum)、香蕉枯萎病菌(Fusarium oxysporum f. sp. cuben)、西瓜枯萎病菌(Fusarium oxysporum)、棉花枯萎病菌(Fusarium oxysporum f. sp. vasinfectum)由云南大学生物资源保护利用重点实验室莫明和教授提供。
1.1.3 仪器与试剂 HP6890/5975C GC/MS联用仪,美国Agilent公司;色谱柱Agilent 19091S-433 HP-5MS 5% Phenyl Methyl Siloxane(30 m 0.25 mm0.25 μm)弹性石英毛细管色谱柱,美国Agilent公司;Laborta 4001旋转蒸发仪,德国HEIDOLPE公司;Rotavac valve tec真空泵,德国HEIDOLPE公司;CA-1111冷却水循环装置,美国Bio-Tek公司;ELX-800酶标仪,美国Bio-Tek公司;HHB11360-S普通培养箱,上海跃进医疗器械厂;SW-40洁净工作台,上海博迅实业有限公司;HVE-50高压蒸汽灭菌锅,日本HIRAYAMA公司;XL-02A手提式粉碎机,杭州旭众机械设备有限公司。
1.2 方法
1.2.1 样品制备 取黄檀属植物心材粉碎称重(200.0 g),装入挥发油提取器中,加入蒸馏水,恒温加热器加热提取5 h,所得揮发油得率见表2。
1.2.2 挥发性成分的分析鉴定 S1气相色谱条件:柱温50 ℃,以3 ℃/min升温至230 ℃;汽化室温度250 ℃;载气为高纯He(99.999%);柱前压7.62 psi,载气流量1.0 mL/min;不分流,溶剂延迟时间:4.0 min。
S2气相色谱条件:柱温50 ℃(保留2 min),以4 ℃/min升温至180 ℃,再以5 ℃/min升温至300 ℃;汽化室温度250 ℃;载气为高纯He(99.999%);柱前压7.62 psi,载气流量1.0 mL/min;不分流,溶剂延迟时间:4.0 min。
S3和S4气相色谱条件:柱温50 ℃(保留2 min),以5 ℃/min升温至310 ℃,保持10 min;汽化室温度250 ℃;载气为高纯He(99.999%);柱前压7.62 psi,载气流量1.0 mL/min;不分流,溶剂延迟时间:4.0 min。
S5和S6气相色谱条件:柱温50 ℃(保留2 min),以4 ℃/min升温至182 ℃,再以6 ℃/min升温至242 ℃;汽化室温度250 ℃;载气为高纯He(99.999%);柱前压6.29 psi,载气流量1.0 mLmin1;不分流,溶剂延迟时间:4.0 min。
S7气相色谱条件:柱温50 ℃(保留2 min),以6 ℃/min升温至310 ℃,保持5 min;汽化室温度250 ℃;载气为高纯He(99.999%);柱前压7.62 psi,载气流量1.0 mL/min;不分流,溶剂延迟时间:4.0 min。
质谱条件:离子源为EI源;离子源温度230 ℃;四极杆温度150 ℃;电子能量70 eV;发射电流34.6 μA;倍增器电压1364 V;接口温度280 ℃;质量范围20~480 amu。
数据处理及质谱检索:对总离子流图中的各峰经质谱计算机数据系统检索及核对Nist2008和Wiley275标准质谱图进行鉴定,用峰面积归一化法测定了各化学成分的相对质量分数。
1.2.3 抗菌活性测定 以金黄色葡萄球菌、烟草青枯病菌、香蕉枯萎病菌、西瓜枯萎病菌和棉花枯萎病菌为指示菌,采用滤纸片琼脂扩散法[35]测定挥发油的抗菌活性。将样品配成质量浓度为10 mg/mL的氯仿甲醇溶液,取样品溶液50 μL、硫酸卡那霉素、多菌灵水溶液25 μL分别滴加于直径为6 mm的灭菌滤纸片上,待溶剂挥干后,将已点样的滤纸片贴于已涂供试菌悬液100 μL(菌液浓度105~107 CFU/mL)的平板上,放置30 min后,放入培养箱中35~37 ℃无光照培养,18~24 h后观察并测量抑菌圈直径。每个样品重复3次,硫酸卡那霉素(金黄色葡萄球菌、烟草青枯病菌)和多菌灵(香蕉枯萎病菌、西瓜枯萎病菌和棉花枯萎病菌)分别作为阳性对照,浓度均为10 mg/mL。
2 结果与分析
2.1 GC-MS分析结果
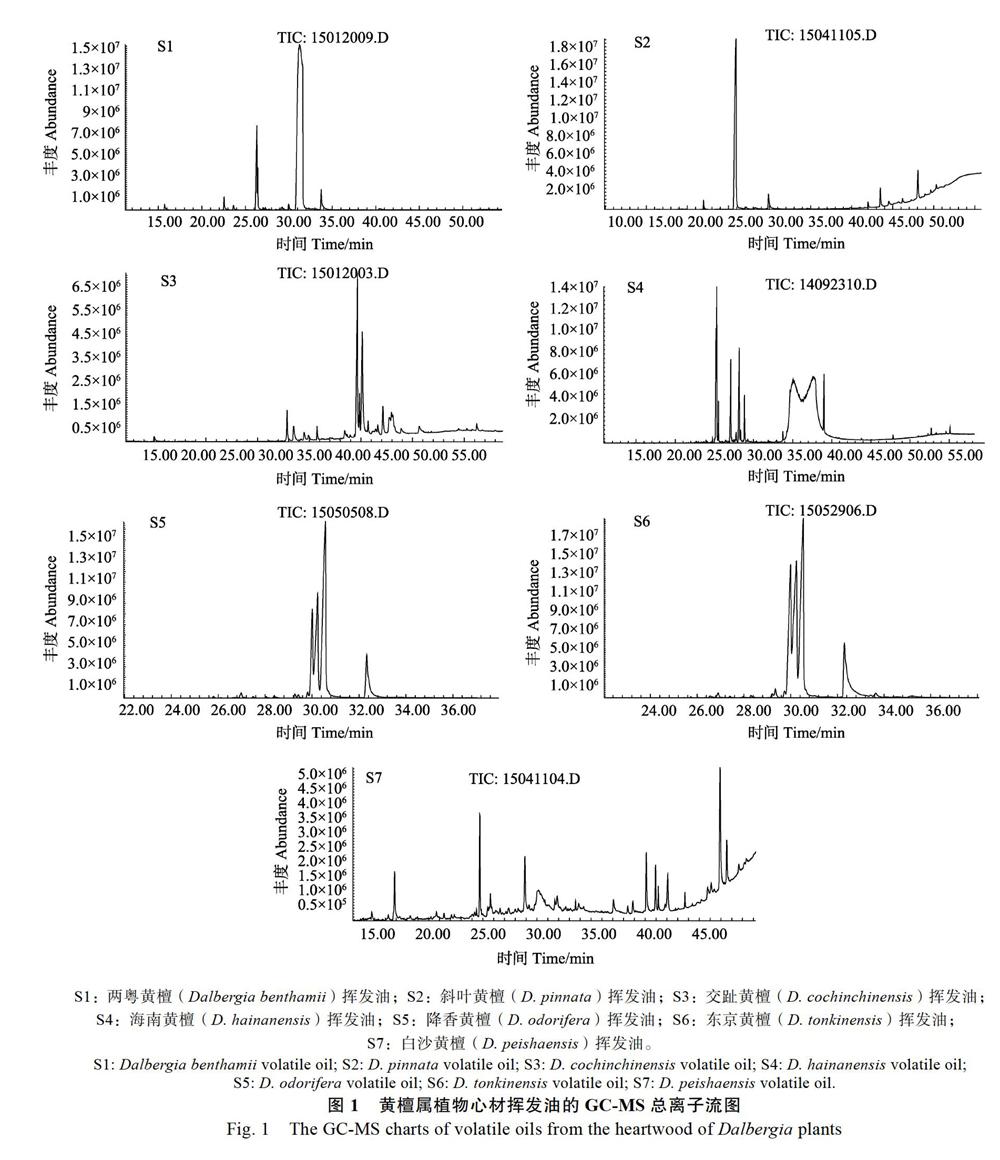
黄檀属植物心材挥发性成分的总离子流图见图1,对总离子流图中的各峰经质谱数据系统检索及核对Nist2005和Wiley275标准质谱图进行鉴定。采用色谱峰面积归一化法计算其相对含量,具体化学成分结果见表3~表6。
本次研究从7种黄檀属植物心材挥发性成分中共检测到59个化学成分,鉴定了39个化合物,其中两粤黄檀检出9种成分,占总含量的98.93%,其中含量最大的成分为苯丙素类化合物榄香素,相对百分含量为83.38%;斜叶黄檀检出6种成分,占总含量的91.80%,其中含量最大的成分也是榄香素,相对百分含量为73.03%;交趾黄檀检出13种成分,占总含量的86.23%,其相对百分含量最大的成分为黄酮类成分美迪紫檀素(27.72%);海南黄檀检出9种成分,占总含量的94.86%,其中相对百分含量较大的成分依次为亚油酸(42.80%)和棕榈酸(36.92%);降香黄檀检出8种成分,占总含量的97.38%,其中含量最大的成分为倍半萜(7R,10S)-2,6,10-三甲基-7,10-环氧-2,11-十二碳-6-醇及其异构体(两者之和为60.37%);东京黄檀检出8种成分,占总含量的97.72%,其中为含量最大的成分也是倍半萜(7R,10S)-2,6,10-三甲基-7,10-环氧-2,11-十二碳-6-醇及其异构体(两者相对含量之和为53.23%);白沙黄檀检出23种成分,占总含量的79.45%,其中相对百分含量较大的2种成分均未能鉴定,分别为15.33%和11.91%,已鉴定出且相对百分含量较大的成分为榄香素(7.81%)。黄檀属植物心材挥发性成分主要有苯丙素类、倍半萜类、黄酮类、脂肪酸类和甾体等。
2.2 抗菌活性测定结果
以滤纸片琼脂扩散法测定黄檀属植物心材挥发性成分对金黄色葡萄球菌、烟草青枯病菌、香蕉枯萎病菌、西瓜枯萎病菌和棉花枯萎病菌的抑制活性,测定结果见表7。黄檀属植物心材挥发性成分对金黄色葡萄球菌均有一定的抑制作用,其中抑菌最强的为海南黄檀的挥发性成分,其抑菌圈直径为13.16 mm,其次为降香黄檀和东京黄檀,分别为11.10和9.58 mm,阳性对照硫酸卡那霉素的抑菌圈直径为17.23 mm。黄檀属植物心材挥发性成分对烟草青枯病菌、香蕉枯萎病菌、西瓜枯萎病菌和棉花枯萎病菌的有一定的抑制活性,其中白沙黃檀挥发性成分对烟草青枯病菌的抑制活性最强,抑菌圈直径为7.39 mm,阳性对照硫酸卡那霉素的抑菌圈直径为26.39 mm;海南黄檀挥发性成分对西瓜枯萎病菌的抑制活性最高,抑菌圈直径为7.42 mm,阳性对照多菌灵的抑菌圈直径为20.10 mm。
3 讨论
本研究中的7种黄檀属植物心材中,有关降香黄檀的研究最多,对交趾黄檀的研究也较多,但未见其挥发性成分研究,近年来,陆续有关于东京黄檀的化学成分研究报道,有关两粤黄檀、斜叶黄檀、海南黄檀及白沙黄檀的化学成分研究很少。本次研究发现上述7种黄檀属植物心材挥发性成分主要有苯丙素类、倍半萜类、黄酮类、脂肪酸类和甾体等。
从前人的报道来看,降香黄檀挥发性成分中的相对含量较大的化合物为橙花叔醇、氧化橙花叔醇及其异构体、氧化石竹烯、7,11-二甲基-10-十二碳烯-1-醇(14.11%)、6,11-二甲基-2,6,10-十二碳三烯-1-醇等[14, 36-37]。此次研究结果表明降香黄檀心材挥发油中含量最大的成分为倍半萜(7R,10S)-2,6,10-三甲基-7,10-环氧-2,11-十二碳-6-醇及其异构体(两者之和为60.37%),而东京黄檀心材的挥发油成分此前未见报道,本研究发现其主要成分与降香黄檀十分接近,其中含量较大的成分与降香黄檀相同,上述倍半萜及其异构体相对含量之和为53.23%,该倍半萜也在海南黄檀中检测到,相对含量为3.40%,其余样品中未发现。两粤黄檀和斜叶黄檀在民间分别被称为“大叶降真香”和“小叶降真香”,在本次研究中,两粤黄檀和斜叶黄檀中的苯丙素类化合物榄香素相对百分含量分别为83.38%和73.03%,其中斜叶黄檀的结果与赵维波等[27]的研究结果近一致;榄香素在交趾黄檀(1.26%)和白沙黄檀(7.81%)中有检测到,其余样品中未发现。交趾黄檀又被称为“大红酸枝”,主产于中南半岛国家,在国家标准《红木》(GB/T 18107-2017)中归为红酸枝木类,本次研究发现其心材中相对百分含量最大的成分为黄酮类成分美迪紫檀素(27.72%),另外还检测到黄酮类成分7,2′-羟基-4′-甲基氧异黄烷(4.38%),而其余样品中均未检测到黄酮类成分。综上所述,降香黄檀和东京黄檀的化学成分相近,两粤黄檀和斜叶黄檀的化学成分相近,交趾黄檀、海南黄檀、白沙黄檀之间及与上述4种样品的化学成分具有一定的区别,这可以为黄檀植物心材标准制定、检测鉴定和等级划分提供依据。
黃檀属植物心材提取物具有非常重要的生物活性,榄香素具有一定的抑制细菌和真菌活
性[38-39],具有抗肺炎及舒张血管作用[40-41];甲基丁香酚具有镇静、镇痛、降压、抑菌、抗氧化、杀虫等作用[42];芳樟醇具有较强的抗菌、抗炎、抗氧化及抗病毒作用[43]。基于上述油中各组分的药理活性报道,两粤黄檀和斜叶黄檀心材在民间被用于辅助治疗心血管疾病应与榄香素、甲基丁香酚等化学成分有关。霍丽妮等[26]研究了两粤黄檀体外抗氧化及α-葡萄糖苷酶抑制活性,结果表明,两粤黄檀茎乙酸乙酯提取物具有优异的抗氧化能力及α-葡萄糖苷酶抑制活性。美迪紫檀素具有对人宫颈癌Hela细胞、人乳腺癌MCF-7细胞和人肝癌HepG2细胞等显示抗肿瘤活性[44-47],同时还具有抗菌、神经保护及抗雄性激素等作用[48]。亚油酸是功能性多不饱和脂肪酸中最早被认识的一种,具有降低血清胆固醇水平和抑制动脉血栓形成作用[49]。棕榈酸可诱导胰岛素瘤细胞MIN6细胞凋亡作用和胰岛素成熟有影响[50-51],也可诱导大鼠主动脉内皮细胞凋亡[52]。
本研究通过GC-MS分析及滤纸片琼脂扩散法,鉴定了7种黄檀属植物心材挥发性成分,并发现其对金黄色葡萄球菌有抑制作用,同时对烟草青枯病菌、香蕉枯萎病菌、西瓜枯萎病菌和棉花枯萎病菌等农业病原菌也具有一定的抑制活性。本研究对黄檀属植物心材挥发性成分及其抗菌活性进行了初步分析,拓宽了这些药用植物的用途,为保护黄檀属植物资源和开发利用提供科学指导。
参考文献
成俊卿, 李 秾, 孙成志, 等. 中国热带及亚热带木材识别、材性和利用[M]. 北京: 科学出版社, 1980: 258-262.
Flora of China Editorial Board. Dalbergia[M]. Beijing: Sciences Press, 2010, 10: 121-130.
国家药典编委会. 中华人民共和国药典:一部[M]. 北京: 中国医药科技出版社, 2015: 229-230.
赵惠玲, 韦建华. 黄檀属植物化学成分和药理活性研究进展[J]. 中国民族民间医药, 2018, 27(5): 40-47.
Kahlert M, Albert R L, Anttila E L, et al. In vitro Assessment of antioxidant activity of Dalbergia latifolia barks extract against free radicals[J]. European Geriatric Medicine, 2014, 5(7): 188-194.
Lee D S, Li B, Im N K, et al. 4,2,5-trihydroxy-4-methoxy chalcone from Dalbergia odorifera exhibits anti-inflam matory properties by inducing heme oxygenase-1 in murine macrophages[J]. International Immunopharmacology, 2013, 16(1): 114-121.
Zhao X B, Mei W L, Gong M F, et al. Antibacterial activity of the flavonoids from Dalbergia odorifera on Ralstonia solanacearum[J]. Molecules, 2011, 16(12): 9775-9782.
Koma O S, Sani I M. Betulinic acid from antimicrobial root wood extract of Dalbergia saxatilis Hook f. (Fabaceae)[J]. European Journal of Medicinal Plants, 2014, 4(6): 686-694.
Wang H, Dong W H, Zuo W J, et al. Five new sesquiterpenoids from Dalbergia odorifera[J]. Fitoterapia, 2014, 95: 16-21.
王 昊, 梅文莉, 郭志凯, 等. 降香的化学成分研究[J]. 中国中药杂志, 2014, 39(9): 1625-1629.
Kiran V P, Neeraj S V, Vilas K M, et al. Effect of Dalbergia sissoo Roxb. on dexamethasone-induced insulin resistance in mice[J]. Inventi Impact Ethnopharmacology, 2012(1): 13-15.
王 辉, 梅文莉, 赵夏博, 等. 降香檀的化学成分与药理活性研究进展[J]. 中国民族民间医药, 2011, 20(10): 20-22.
王秀丽, 赵保胜. 降香挥发油大鼠体内HPLC测定方法的建立[J]. 中国实验方剂学杂志, 2010, 16(1): 51-52.
赵夏博, 梅文莉, 龚明福, 等. 降香挥发油的化学成分及抗菌活性[J]. 广东农业科学, 2012, 3: 95-96, 99.
郭丽冰, 王 蕾. 降香中黄酮类化学成分研究[J]. 中草药, 2008(8): 1147-1149.
王 昊, 梅文莉, 杨德兰, 等. 降香中的酚性化合物[J].天然产物研究与开发, 2014, 26(6): 856-859.
Wang H, Dong W H, Zuo W J, et al. Three new phenolic compounds from Dalbergia odorifera[J]. Journal of Asian Natural Products Research, 2014, 16(12), 1109-1118.
Wang H, Mei W L, Zeng Y B, et al. Phenolic compounds from Dalbergia odorifera[J]. Phytochemistry Letters, 2014, 9: 168-173.
Goda Y, Kiuchi F, Shibuya M. Inhibitors of prostaglandin biosynthesis from Dalbergia odorifera[J]. Chemical & Pharmaceutical Bulletin, 1992, 40(9): 2452-2457.
Chan S C, Chang Y S, Wang J P. Three new flavoanids and antiallergic, Anti-Inflammatory constituents form the heartwood of Dalbergia odorifera[J]. Planta Medica, 1998, 64(2): 153-158.
Wang W, Weng X C, Cheng D L. Antioxidant activities of natural phenolic components from Dalbergia T. Chen[J]. Food Chemistry, 2000, 71(1): 45-49.
Yu X L, Wang W, Yang M. Antioxidant activities of compounds isolated from Dalbergia odorifera T. Chen and their inhibition effects on the decrease of glutathione level of rat lens induced by UV irradiation[J]. Food Chemistry, 2007, 104(2): 715-720.
余 錕, 尚孝堂, 王大英. “药对”降香、红景天对心肌梗死后大鼠非梗死区胶原改建的影响[J]. 甘肃中医, 2007, 20(11): 54-55.
Yu S M, Kuo S C. Vasorelaxant effect of isoliquiritigenin, a novel soluble guanyLate cyclase activator, in rat aorta[J]. British Journal of Pharmacology, 2012, 114(8): 1587-1594.
Kim N. Butein sensitizes human leukemia cells to apoptosis induced by tumor necrosis factorrelated apoptosis inducing ligand (TRAIL)[J]. Archives of Pharmacal Research, 2008, 31(9): 1179.
霍丽妮, 刘华钢, 廖艳芳, 等. 两粤黄檀体外抗氧化及α-葡萄糖苷酶抑制活性研究[J]. 江苏农业科学, 2014, 42(5): 242-244.
赵维波, 张丹雁, 徐展翅, 等. 斜叶黄檀香材挥发油成分及抗氧化活性研究[J]. 中药新药与临床药理, 2017, 28(5): 659-662.
Pornputtapitak W. Chemical constituents of the branches of Anomianthus dulcis and the branches of Dalbergia cochinchinensis Pierre[D]. Bangkok: Silpakorn University, 2008.
刘荣华, 温新潮, 李于益, 等. 交趾黄檀化学成分研究[J]. 中药材, 2015a, 38(9): 1868-1871.
刘荣华, 温新潮, 张普照, 等. 交趾黄檀异黄酮类化学成分研究[J]. 中草药, 2015, 46(19): 2851-2855.
刘喜明, 马景蕃, 陈瑞英. 交趾黄檀的化学特性研究[J]. 龙岩学院学报, 2016, 34(5): 112-116.
Nguyen M C, Ngu T N, Ninh T S, et al. Daltonkins A and B, two new carboxyethyl flavanones from the heartwood of Dalbergia tonkinensis[J]. Bulletin Korean Chemical Society, 2017, 38(12): 1511-1514.
Ninh T S, Tsuyoshi Y, Yoshiyasu F. Chemotaxonomic aspects of the constituents of the plant Dalbergia tonkinensis[J]. Biochemical Systematics and Ecology, 2018, 78: 98-101.
张培成, 毋 艳, 于德泉. 海南黄檀化学成分研究[J]. 中国中药杂志, 2003, 28(6): 527-530.
徐淑云, 卞如濂, 陈 修. 药理实验方法学[M]. 北京: 人民卫生出版社, 2003: 651.
刘洪玲. GC-MS法分析降香挥发油化学成分[J]. 中成药, 2009, 31(6): 915-917.
纪明慧, 舒火明, 陈光英, 等. 花梨木挥发油的提取及其包合物研究[J]. 中成药, 2009, 31(10): 1526-1530.
Rossi P G, Bao L, Anne L A, et al. (E)-Methylisoeugenol and elemicin: Antibacterial components of Daucus carota L. essential oil against Campylobacter jejuni[J]. Journal of Agricultural and Food Chemistry, 2007, 55(18): 7332-7336.
Jayasinghe L, Kumarihamy B M M, Jayarathna K H R N, et al. Antifungal constituents of the stem bark of Bridelia retusa[J]. Phytochemistry, 2003, 62(4): 637-641.
Grice I D, Rogers K L, Griffiths L R. Isolation of bioactive compounds that relate to the anti-platelet activity of Cymbopogon ambiguous[J]. Evidence-based Complementary and Alternative Medicine, 2010, 2011(11): 1-8.
Jail H, Wan W K, Ro L K, et al. Inhibition of proinflammatory cytokine generation in lung inflammation by the leaves of Perilla frutescens and its constituents[J]. Biomolecules and Therapeutics, 2014, 22(1): 62-67.
周慧秋, 于 滨, 乔婉红, 等. 甲基丁香酚药理作用研究[J]. 中医药学报, 2000, (2): 79-80.
Masson E, Baumes R, Guerneve C L, et al. Identification of a precursor of β-methyl-γ-octalatone in the wood of sessile Oak (Quercus petraea (Matt.) Liebl)[J]. Journal of Agricultural and Food Chemistry, 2000, 48(9): 4306-4309.
Bhargavan B, Singh D, Gautam A K, et al. Medicarpin, a legume phytoalexin, stimulates osteoblast differentiation and promotes peak bone mass achievement in rats: evidence for estrogen receptor β-mediated osteogenic action of medicarpin[J]. Journal Nutritional Biochemistry, 2012, 23: 27-38.
石荣火. 刺果甘草化学成分及抗肿瘤活性研究[D]. 南京: 南京中医药大学, 2001.
Rayanil K O, Bunchornmaspan P, Tuntiwachwuttikul P. A new phenolic compound with anticancer activity from the wood of Millettia leucantha[J]. Archives of Pharmacal Research, 2011, 34(6): 881-886.
Gatouillat G, Magid A A, Bertin E, et al. Cytotoxicity and apoptosis induced by Alfalfa (Medicago sativa) leaf extracts in sensitive and multidrug-resistant tumor cells[J]. Nutrition and Cancer, 2014, 66(3): 483-491.
黎 雄. 資源植物朝鲜槐的化学成分、生物活性及其质量控制研究[D]. 沈阳: 沈阳药科大学, 2011.
张春娥, 张 惠, 刘楚怡, 等. 亚油酸的研究进展[J]. 粮油加工, 2010(5): 18-21.
王 威, 曹翠平, 陈 颖, 等. 棕榈酸诱导胰岛素瘤细胞MIN6细胞凋亡[J]. 基础医学与临床, 2010, 30(4): 401-405.
张晶晶, 孔凡青, 李嘉欣, 等. 棕榈酸对胰岛MIN6细胞胰岛素成熟的影响[J]. 动物医学进展, 2013, 34(2): 44-48.
张 丹, 曹翠平, 王 威, 等. 棕榈酸诱导大鼠主动脉内皮细胞凋亡[J]. 中国现代医学杂志, 2012, 22(8): 19-22.

