上调miR-24对急性肺损伤幼龄大鼠炎症反应的影响及作用机制
赵 瑜,岳彩虹,曹海丽,刘瑞敏
(1. 开封市儿童医院呼吸科,河南开封 475000;2. 河南大学基础医学院免疫教研室,河南开封 475004)
急性肺损伤(acute lung injury, ALI)指由脓毒症、再灌注损伤、失血性休克、烟雾及有毒气体吸入等因素引起的急性进行性呼吸衰竭[1],是幼儿出现急性呼吸衰竭症状的主要原因[2]。由于缺乏自我保护能力及意识,幼儿ALI发病率较高,而ALI可进一步发展成为急性呼吸窘迫综合征,患儿病死率接近50%[3]。现阶段,临床治疗ALI多用呼吸支持疗法配合镇静止痛药,但不能从致病机理上阻止ALI的恶化。据报道,抑制ALI炎症反应可显著减轻肺部病理损伤,阻止ALI的进一步恶化[4]。研究表明,微小型RNA-24(microRNA-24, miR-24)可作为一类抗炎因子,显著抑制炎症因子产生并阻碍NF-κB信号通路的激活,从而减轻炎症反应引起的病理组织损伤[5-8]。由于目前还没有关于miR-24对ALI作用机制的报道,因此,本文通过上调miR-24,对其在ALI中的作用及机制进行了深入探究。
1 材料与方法
1.1 试剂脂多糖(LPS)购自美国Sigma;Lipofectamine 2000转染试剂盒、Trizol、反转录试剂盒及实时定量PCR试剂盒购自美国Thermo Fisher;HE染色试剂盒、Tunel细胞凋亡检测试剂盒及BCA试剂盒购自上海碧云天;磷酸化核因子κB p65(nuclear factor κB p65, NF-κB p65)、磷酸化核因子κB抑制蛋白(phosphorylation inhibitor of NF-κB, p-IκBα)及IκBα激酶(IκBα kinase, p-IKK)抗体购自美国Santa Cruz,实验二抗购自北京中杉金桥;PCR引物利用Primer 3网站设计,购自北京六合华大;胎牛血清(FBS)购自美国Corning;青霉素、链霉素购自美国BI;DMEM/F-12+GlutaMAX培养基、肿瘤坏死因子α(tumor necrosis factor, TNF-α)、白介素-6(interleukin-6, IL-6)、IL-1α和IL-1β ELISA试剂盒购自美国Invirtrogen。
1.2 幼龄大鼠分组及模型建立将幼龄大鼠(新生3~8 d)分为Control、ALI、ALI+miR-24 mimic mock及ALI+miR-24 mimic组,每组20只。ALI组大鼠腹腔注射LPS(3 mg/kg)建立ALI模型,ALI+miR-24 mimic mock及ALI+miR-24 mimic组大鼠建立ALI模型后,分别从尾静脉注射miR-24 mimic mock及miR-24 mimic。miR-24 mimic mock是将miR-24 mimic基因随机打乱后的序列,不与任何基因同源。Control组为空白对照,以等量生理盐水替代LPS及miRNA进行处理。将各组大鼠饲养7 d后处死,并收集大鼠外周血及肺组织。称量右肺干湿重,并对肺干湿重比进行计算。石蜡包埋肺组织,用于后期检测。
1.3 HE染色石蜡切片脱蜡,用苏木精染色10 min,PBS洗涤3次,伊红复染2 min,切片脱水后封片。于显微镜下观察,细胞核为蓝紫色,细胞质及细胞外基质为红色。
1.4 Tunel检测石蜡切片脱蜡修复,用内源性过氧化物酶封闭5 min,PBS洗涤3次,Tunel检测液37 ℃避光孵育1 h。PBS洗涤3次,DAB显色液避光显色,苏木精复染。于暗室显微镜观察,凋亡细胞为棕色,正常细胞为蓝色。
1.5 Western blot实验1.2中各组大鼠肺组织研磨匀浆后,加入RIPA裂解,提取组织蛋白。BCA试剂盒对组织蛋白定量并调平浓度。取各组蛋白30 μg,SDS-PAGE分离蛋白,半干转膜法将蛋白转移到PVDF膜上,脱脂奶粉室温封膜2 h,1.1中一抗4 ℃孵育过夜,二抗37 ℃孵育1 h,曝光显色,GAPDH为内参。
1.6 细胞培养及分组大鼠肺泡巨噬细胞NR8383由美国典型培养物保藏中心(American Type Culture Collection, ATCC)提供。用含有150 mL/L FBS、100 U/mL青霉素和100 μg/mL链霉素的DMEM/F-12+GlutaMAX培养细胞,培养箱条件为37 ℃、50 mL/L CO2,次日换液,细胞融合率达到85%以上时,以1×104/mL的浓度进行传代。
NR8383细胞分为Control、LPS、LPS+miR-24 mimic、LPS+pcDNA-IL-1α(pc-IL-1α)及LPS+miR-24 mimic+pc-IL-1α组。LPS组巨噬细胞利用1 μg/mL的LPS处理,LPS+miR-24 mimic、LPS+pc-IL-1α及LPS+miR-24 mimic+pc-IL-1α组细胞经LPS处理后,分别或同时用miR-24 mimic及pc-IL-1α转染,Control组细胞则加入等量空载。转染步骤参考转染试剂盒说明书,6 h后换液,继续培养用于后续实验。
1.7 荧光素酶报告实验生物信息学分析miR-24与IL-1α的连续结合片段,PCR扩增将片段插入荧光素酶报告载体,构建野生型IL-1α质粒(IL-1α wt)。突变连续结合片段的核苷酸位点,构建突变型IL-1α质粒(IL-1α mut)。将miR-24 mimic与IL-1α wt或IL-1α mut共同转染到NR8383细胞,培养24 h后,检测各组细胞的荧光素酶活性。
1.8 qRT-PCR实验1.2中各组大鼠肺组织匀浆及1.6中各组细胞用Trizol进行裂解,于通风橱中进行总RNA抽提。定量分析后,取等量RNA逆转录为cDNA,利用实时定量PCR试剂盒通过实时荧光定量PCR仪进行定量并分析结果。结果计算方法:对照组2ΔCt平均值设为基准1,实验组2ΔCt平均值与对照组2ΔCt平均值相比得到的2ΔΔCt值为mRNA的相对变化倍数。
1.9 ELISA检测1.2中各组大鼠外周血清及1.6中各组细胞上清中TNF-α、IL-6、IL-1α和IL-1β浓度测定步骤参考Invirtrogen ELISA试剂盒说明书。避光显色后,利用酶标仪检测各组样品A值,根据标准样品曲线公式计算各样品A值对应的蛋白浓度。

2 结 果
2.1 ALI及miR-24 mimic对幼龄大鼠肺组织中miR-24的影响与Control组比较,miR-24在ALI幼龄大鼠肺组织中的mRNA降低(P<0.01)。与ALI组比较,ALI+miR-24 mimic mock组无统计学差异,ALI+miR-24 mimic组中miR-24的mRNA表达升高(P<0.01,图1)。
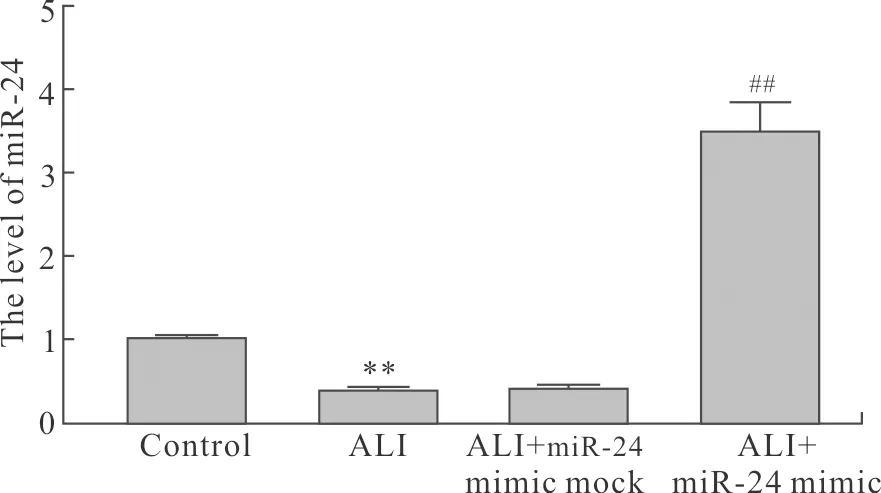
图1 各组中miR-24的mRNA水平
Fig.1 The mRNA level of miR-24 in each group (n=6)
与Control组比较,**P<0.01;与ALI组比较,##P<0.01。
2.2 miR-24 mimic对ALI幼龄大鼠肺病理损伤的影响HE染色可见Control组幼龄大鼠肺泡形态规则、清晰且结构完整。与Control组比较,ALI组幼龄大鼠肺泡结构杂乱,大量炎性细胞及红细胞充满肺泡腔中。与ALI组比较,ALI+miR-24 mimic mock组无统计学差异,ALI+miR-24 mimic组中肺泡形态较为规则,炎性细胞及红细胞减少(图2)。

图2 各组幼龄大鼠肺病理变化
Fig.2 The pathologic change of lung tissue in the infant rats of each group (×200,n=6)
2.3 miR-24 mimic对ALI幼龄大鼠肺水肿的作用与Control组比较,ALI组幼龄大鼠肺干湿重比值增大(P<0.01)。与ALI组比较,ALI+miR-24 mimic mock组无统计学差异,ALI+miR-24 mimic组肺干湿重比值减小(P<0.01,图3)。
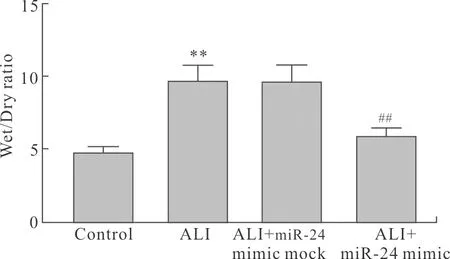
图3 各组幼龄大鼠肺干湿重比值
Fig.3 The ratio of lung wet/dry weight in the infant rats of each group (n=6)
与Control组比较,**P<0.01;与ALI组比较,##P<0.01。
2.4 miR-24 mimic对ALI幼龄大鼠肺组织细胞凋亡的影响与Control组比较,ALI组幼龄大鼠肺组织凋亡细胞百分比升高(P<0.01)。与ALI组比较,ALI+miR-24 mimic mock组无统计学差异,ALI+miR-24 mimic组凋亡细胞百分比降低(P<0.01,图4)。
2.5 miR-24 mimic对ALI幼龄大鼠炎症反应的作用与Control组比较,ALI组幼龄大鼠外周血清中炎症因子TNF-α、IL-6、IL-1α和IL-1β的水平升高(P<0.01)。与ALI组比较,ALI+miR-24 mimic mock组无统计学差异,ALI+miR-24 mimic组中TNF-α、IL-6、IL-1α和IL-1β的水平降低(P<0.01,图5)。
2.6 miR-24 mimic对ALI幼龄大鼠肺组织中NF-κB信号通路的影响与Control组比较,ALI组幼龄大鼠肺组织中p-IKK、p-IκBα及NF-κB p65的表达增多(P<0.01)。与ALI组比较,ALI+miR-24 mimic mock组无统计学差异,ALI+miR-24 mimic组中p-IKK、p-IκBα及NF-κB p65的表达减少(P<0.01,图6)。
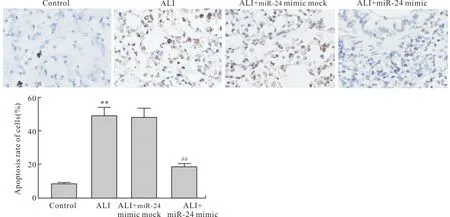

图4 各组幼龄大鼠肺组织细胞凋亡情况Fig.4 The apoptosis level of lung tissue in the infant rats of each group (n=6, ×400)与Control组比较,∗∗P<0.01;与ALI组比较,##P<0.01。

图5 各组幼龄大鼠血清中TNF-α、IL-6、IL-1α和IL-1β的水平比较
Fig.5 The serum concentrations of TNF-α, IL-6, IL-1α and IL-1β in the infant rats of each group (n=6)
与Control组比较,**P<0.01;与ALI组比较,##P<0.01。
2.7 LPS及miR-24 mimic对大鼠肺泡巨噬细胞中miR-24的影响与Control组比较,miR-24在经LPS处理大鼠肺泡巨噬细胞中的mRNA水平降低(P<0.01)。与LPS组比较,LPS+miR-24 mimic mock组无统计学差异,LPS+miR-24 mimic组中miR-24的mRNA水平升高(P<0.01,图7)。
2.8 miR-24与IL-1α的靶向关系生物信息预测miR-24与IL-1α之间存在连续结合片段,同时,miR-24 mimic可降低IL-1α wt的荧光素酶活性(P<0.01,图8),而对连续结合片段位点突变后的IL-1α mut没有影响。
2.9 miR-24 mimic及pc-IL-1α对经LPS处理大鼠肺泡巨噬细胞中炎症反应的作用与Control组比较,LPS组大鼠肺泡巨噬细胞培养上清中TNF-α、IL-6、IL-1α和IL-1β的水平升高(P<0.01)。与LPS组比较,LPS+miR-24 mimic组中TNF-α、IL-6、IL-1α和IL-1β的水平降低,LPS+pc-IL-1α组中TNF-α、IL-6、IL-1α和IL-1β的水平升高(P<0.01,图9)。与LPS+miR-24 mimic组比较,LPS+miR-24 mimic+pc-IL-1α组中TNF-α、IL-6、IL-1α和IL-1β的水平升高。
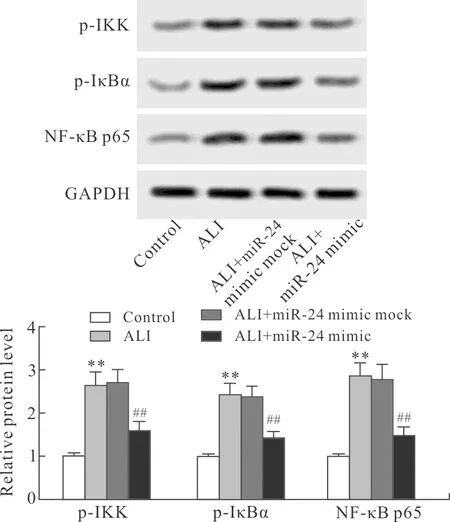
图6 各组幼龄大鼠肺组织中p-IKK、p-IκBα及NF-κB p65的表达
Fig.6 The expression of p-IKK, p-IκBα and NF-κB p65 in lung tissue of the infant rats in each group (n=6)
与Control组比较,**P<0.01;与ALI组比较,##P<0.01。
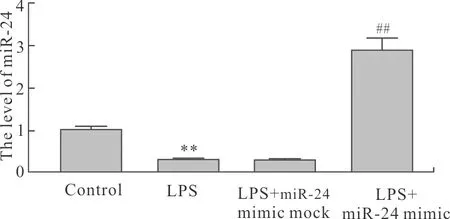
图7 各组大鼠肺泡巨噬细胞中miR-24的mRNA水平比较
Fig.7 The mRNA level of miR-24 in the rat alveolar macrophages of each group (n=6)
与Control组比较,**P<0.01;与LPS组比较,##P<0.01。
3 讨 论
miR-24是一类多功能调节因子。据报道,miR-24具有抗凋亡作用,可在急性肝衰竭中抑制肝细胞凋亡的发生[9];具有抑癌作用,可在骨肉瘤中显著抑制癌细胞侵袭及迁移[10];具有抗炎作用,如在血管平滑肌细胞中,miR-24可通过阻碍NF-κB信号通路及降低炎症因子TNF-α及IL-6表达水平,减轻糖尿病患者的血管病变[5];在软骨组织中,miR-24可通过抑制炎症反应改善模型大鼠骨关节炎组织损伤[6];在巨噬细胞中,过表达miR-24可抑制金黄色葡萄球菌诱导炎症因子产生[8]。临床研究发现,ALI可引起肺组织产生严重的炎症反应,减轻炎症反应可改善ALI造成的肺部病理损伤[4]。在ALI中,miR-24是否具有抗炎作用还有待进一步的研究。因此,本文通过上调miR-24,对其在ALI中的作用机制进行了深入研究。本研究首先检测了miR-24在正常肺组织和ALI幼龄大鼠肺组织、正常大鼠肺泡巨噬细胞和经LPS处理大鼠肺泡巨噬细胞中的mRNA水平。LPS是革兰氏阴性菌细胞壁的重要组分,常被用于ALI模型的建立,可诱导肺组织及细胞产生炎症反应[11]。实验结果发现,miR-24在ALI幼龄大鼠肺组织及LPS处理大鼠肺泡巨噬细胞中的mRNA水平降低,提示miR-24下调与ALI发生有关。
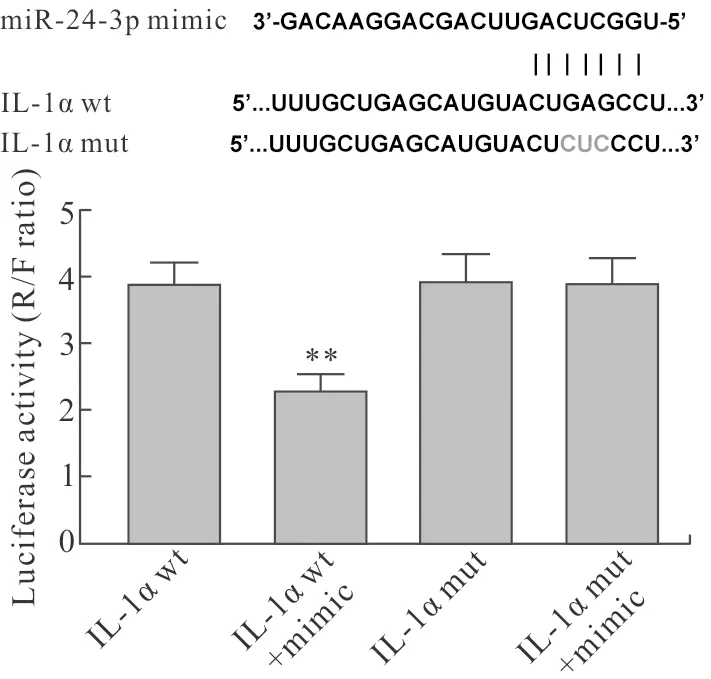
图8 miR-24与IL-1α的靶向关系
Fig.8 The target relationship between miR-24 and IL-1α (n=6)
与IL-1α wt组相比,**P<0.01。
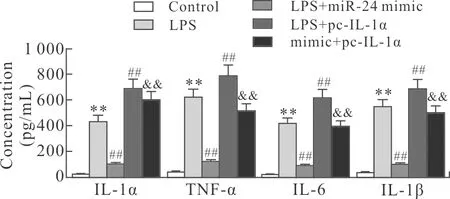
图9 各组大鼠肺泡巨噬细胞上清中的TNF-α、IL-6、IL-1α和IL-1β水平比较
Fig.9 The concentrations of TNF-α, IL-6, IL-1α and IL-1β in the rat alveolar macrophage supernatant of each group (n=6)
与Control组相比,**P<0.01;与LPS组相比,##P<0.01;与LPS+miR-24 mimic组相比,&&P<0.01。
ALI可引起肺泡水肿、肺组织炎性细胞浸润及组织细胞大量凋亡,抑制炎性细胞浸润及抵抗细胞凋亡可减轻ALI引起的组织损伤[12]。研究发现,miR-24具有抗炎作用,如在糖尿病患者血管病变中,miR-24可通过阻碍血管平滑肌细胞NF-κB信号通路的激活及抑制炎症因子产生,减轻血管组织炎性浸润现象[5];同时,miR-24具有抗凋亡作用,如在急性肝衰竭中,提高miR-24表达水平可降低肝细胞凋亡[9];在胃癌细胞中,miR-24可通过抑制促凋亡蛋白表达促进癌细胞增殖并阻碍细胞凋亡的发生[13]。本研究利用miR-24 mimic上调miR-24后发现,miR-24可减少ALI模型幼龄大鼠肺泡内的炎性细胞,降低肺干湿重比值及肺组织凋亡细胞百分比。同时,miR-24 mimic还可降低ALI幼龄大鼠血清及经LPS处理大鼠肺泡巨噬细胞上清中炎症因子TNF-α、IL-6、IL-1α和IL-1β的浓度。TNF-α、IL-6、IL-1α和IL-1β均为炎症因子,可诱导肺泡巨噬细胞及呼吸道上皮细胞产生炎性趋化因子,刺激白细胞及薄壁细胞分泌黏附分子,促进肺组织炎症反应的发生及发展[14]。同时,TNF-α和IL-1β可刺激其他细胞炎症因子的产生,并诱导NF-κB信号通路过度激活,进一步推进炎症反应的发展进程[15]。实验结果说明,miR-24可减轻ALI导致的肺泡水肿、炎性细胞浸润及肺组织细胞凋亡。
NF-κB信号通路与炎症反应密切相关。研究发现,在ALI中,NF-κB信号通路被高度激活,并促进肺部组织炎症反应的发生[16]。有报道表明,miR-24有阻碍NF-κB核位移及其与DNA结合的作用[5]。在NF-κB信号通路激活过程中,需要由细胞外信号刺激IκBα激酶IKK活化为p-IKK,p-IKK磷酸化IκBα,使NF-κB p65从无活性的复合体中分离出来,位移至细胞核,从而诱导下游靶基因的转录[17-18]。本文研究发现,miR-24可减少ALI幼龄大鼠肺组织中p-IKK、p-IκBα及NF-κB p65的表达,说明miR-24可抑制ALI中NF-κB信号通路的激活,提示miR-24可能通过此途径抑制ALI幼龄大鼠肺组织炎症反应。
IL-1α是IL-1存在形式之一,在组织炎症反应及宿主早期固有免疫反应中发挥重要作用[19]。IL-1α具有双重作用,除了通过与细胞表面受体结合发挥功能外,因其本身N段具有核定位位点,IL-1α还能直接调节基因的表达[20]。研究表明,IL-1α可促进IL-1R1依赖性促炎性因子的转录[21]。在肺组织中,IL-1α可在机体受到细菌病毒感染、吸入性损伤及氧化应激的条件下被应激及坏死细胞释放,从而诱导炎症反应及细胞凋亡的发生[22-25]。本研究利用生物信息预测发现,miR-24-3p与IL-1α之间存在连续结合片段,通过荧光素酶报告实验证明,miR-24-3p可靶向下调IL-1α。此外,研究结果表明,miR-24 mimic可降低经LPS处理大鼠肺泡巨噬细胞上清中炎症因子TNF-α、IL-6、IL-1α和IL-1β的浓度,而pc-IL-1α可升高这些炎症因子,并减弱miR-24 mimic对炎症因子的抑制作用,这提示miR-24可通过靶向下调IL-1α抑制ALI引起的炎症反应。
综上所述,miR-24在ALI幼龄大鼠肺组织及LPS处理大鼠肺泡巨噬细胞中的mRNA水平降低,miR-24 mimic可上调miR-24,并减轻ALI导致的肺泡水肿、炎性细胞浸润、炎症因子高度表达及肺组织细胞凋亡。miR-24可抑制ALI中NF-κB信号通路的过度激活,同时靶向下调IL-1α。研究结果提示,miR-24可通过这两种机制抑制ALI引起的炎症反应,为ALI治疗提供新的思路。

