水稻条斑病菌内源质粒分析
曾晨 李康佳 尹朝群 牛祥娜 赵嘉城 朱平川 姜伟 何勇强







摘要:【目的】明確水稻条斑病菌(Xanthomonas oryzae pv. oryzicola, 简称Xoc)内源质粒分布状况、类型及其含有的主要功能基因,为下一步开展该菌与质粒相关的毒力进化研究、抗逆机制分析及穿梭载体构建打下基础。【方法】采用数据库检索法和质粒分离鉴定法,调查水稻条斑病菌内源质粒的分布状况;以GenBank数据库中Xoc菌株基因组序列为研究对象,开展质粒信息检索,并对已发表的Xoc内源质粒序列进行系统进化分析;以Xoc中国菌株菌种库为研究对象,采用碱裂解法提取质粒,进行质粒酶切带型分析和主要功能基因鉴定。【结果】GenBank全基因组数据库中Xoc菌株内源质粒检出率为11.76%,系统进化分析结果表明这些质粒属于不同的进化分支。在257株Xoc中国菌株中,有29株菌株含有质粒,质粒检出率为11.28%,带有内源质粒的菌株均来自于华南稻区,且大部分来自广西。通过质粒酶切图谱比较,确认新发现的质粒属于9种新型Xoc内源质粒。按照已知Xoc内源质粒pXOCgx01上主要功能基因序列设计引物,PCR扩增结果表明新鉴定的Xoc质粒含有重金属抗性和DNA转移相关的基因,但在菌株间存在明显的多样性。【结论】部分Xoc菌株中含有一定数量的内源质粒,质粒类型和所含功能基因等具有一定的多样性,携带内源质粒的Xoc菌株有明显地域性。
关键词: 水稻条斑病菌;内源质粒;调查;酶切图谱;抗逆基因
中图分类号: S435.111.49 文献标志码: A 文章编号:2095-1191(2019)08-1718-10
Analysis of indigenous plasmids in Xanthomonas oryzae
pv. oryzicola
ZENG Chen, LI Kang-jia, YIN Chao-qun, NIU Xiang-na, ZHAO Jia-cheng,
ZHU Ping-chuan, JIANG Wei, HE Yong-qiang*
(State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources/College of Life Science and Technology, Guangxi University, Nanning 530004, China)
Abstract:【Objective】The aim was to fully understand the distribution, types and biological function of the indigenous plasmids of Xanthomonas oryzae pv. oryzicola(Xoc), and lay the foundation for the future study of virulence evolution analysis, mechanism of resistance and construction of shuttle vector. 【Method】The distribution of endogenous plasmids in Xoc strains was investigated by database mining and plasmid isolation. With Xoc strain genome sequence in GenBank as the research target, plasmids information searching was conducted, and phylogenetic analysis on published Xoc indigenous plasmids sequence was also carried out. With Xoc Chinese strains database as the research target, the plasmids were extracted by alkaline lysis, plasmidrestriction endonuclease pattern was analyzed and main functional genes were identified. 【Result】The detection rate of Xoc strainindigenous plasmids in GenBank whole genome database was 11.76%. The phylogenetic analysis indicated that these plasmids were clustered into different phylogenetic branches. Among the 257 Xoc Chinese strains, 29 contained plasmids with a detection rate of 11.28%. The strains containing indigenous plasmid all came from southern China, and most of them were from Guangxi. Nine novel indigenous plasmids of Xoc were confirmed by restriction endonuclease pattern. The primers were designed based on main functional gene sequence of the known indigenous plasmid pXOCgx01. The PCR amplification analysis indicated that the novel plasmids contained heavy metal tolerance and DNA transposition related genes, but there was diversity among the strains. 【Conclusion】Partial Xoc strains contain indigenous plasmids, with diversities in plasmid types, functional genes(DNA transposition and heavy metal resistance), and the Xoc strains with indigenous plasmids have obvious geographical origins.
Key words: Xanthomonas oryzae pv. oryzicola; indigenous plasmid; general survey; restriction pattern; resistance gene
0 引言
【研究意义】质粒是独立于染色体外可自主复制的遗传物质,多为环状双链DNA分子,是一些细菌基因组的组成部分(Thomas et al.,2017)。质粒常携带有抗生素抗性、重金属耐性及功能蛋白分泌系统等相关基因,可帮助宿主菌适应生存环境,提高致病能力(Vivian et al.,2001;Sundin,2007)。质粒也是基因水平转移的主要载体,在细菌抗药、抗逆,乃至毒力进化中发挥重要作用(De Feyter and Gabriel,1991;Carattoli,2013;Suhartono et al.,2018)。水稻条斑病菌也称水稻细菌性条斑病菌,学名为Xanthomonas oryzae pv. oryzicola,简称Xoc(Niño-Liu et al.,2006),汉译为水稻黄单胞菌稻生致病变种或水稻黄单胞菌栖稻致病变种(肖永胜等,2011)。该菌引起的水稻细菌性条斑病(Bacterial leaf streak,BLS)广泛发生在热带、亚热带稻作区,可导致水稻减产20%~60%(Niño-Liu et al.,2006)。近年来,该病在我国多个稻区发病较重,至今尚未发现水稻抗BLS的主效基因,也缺乏高效防治该病的方法(马路等,2018)。明确病原菌的致病机理和环境适应机理是发展高效、有针对性、环境友好的病害防治药物和方法的基础。最近,人们在Xoc菌株中发现了内源质粒(Niu et al.,2015;Wilkins et al.,2015),研究表明,Xoc的内源质粒能提高受体菌的抗逆性(Niu et al.,2015)。因此,开展Xoc内源质粒的调查和分析,不仅有助于明确Xoc内源质粒分布状况、质粒类型,揭示内源质粒在病菌毒力、抗胁迫和环境适应等方面的生物学功能,还能为阐明病原菌毒力因子进化、转移等方面的机理提供参考。【前人研究进展】前期本课题组从广西贺州分离的一株Xoc菌株中分离鉴定出一个内生质粒pXOCgx01(Niu et al.,2015),该质粒全长53206 bp,注释64个编码基因,包括3个重要的功能基因簇:(1)czcCBA基因簇(简称czc基因簇,包括czcA、czcB和czcC 3个基因),编码钴—锌—镉抗性蛋白(Cobalt-zinc-cadmium resistance protein),在金属抗逆性方面发挥作用(Nies,1995;Niu et al.,2015);(2)复合转座系统tnpA-tnpS-tnpT cassette结构,简称tnp基因簇,推测在毒力因子基因水平转移方面发挥重要作用(Ferreira et al.,2015);(3)virB/virD4基因簇,简称vir基因簇,在DNA转运、vir毒力因子分泌等方面发挥作用(Voth et al.,2012)。将pXOCgx01导入不含质粒的水稻白叶枯病菌(学名X. oryzae pv. oryzae,简称Xoo;译为水稻黄单胞菌水稻致病变种)PXO99A菌株,能显著提高该菌株对重金属的抗性(Niu et al.,2015)。DNA限制修饰系统在不同物种,甚至是同一物种的不同个体间存在明显差异,内源质粒的分布状况非常复杂。已有研究表明,绝大多数水稻黄单胞菌排斥外源质粒,被转化率仅为6%左右(吴神怡等,2010)。迄今为止,已分离和鉴定了近百株水稻条斑病菌亚洲和非洲分离株(Gonzalez et al.,2007;Ji et al.,2014),一部分菌株如Xoc BLS256等已完成基因组测序(Bogdanove et al.,2011;Wilkins et al.,2015),但仅从两个Xoc菌株中发现内源质粒,分别为pXOCgx01(Niu et al.,2015)和pXOC2286(Wilkins et al.,2015)。目前,人们对水稻条斑病菌内源质粒的存在状况、种类、功能等缺乏了解。【本研究切入点】长期以来,本课题组持续开展黄单胞菌致病分子机理研究,建立了黄单胞菌菌种库,从全国多个省份分离获得数百株Xoc菌株。在Xoc的其他菌株是否存在有质粒,如果存在质粒,这些质粒会有怎样的基因组成、行使何种生物学功能,这些质粒在与其他黄单胞菌中的质粒可能会有怎样的进化关系,以及这些质粒与Xoc核染色体间是否存在协同进化关系等均有待进一步探究。【拟解决的关键问题】通过大规模GenBank数据库搜索与大规模质粒提取分离鉴定相结合检测Xoc内源质粒,并对获得的Xoc内源质粒进行酶切图谱分析和功能基因PCR法检测,以期对水稻条斑病菌内源质粒的分布状况、质粒类型和潜在的生物功能有一个全新的了解,为下一步开展该菌与质粒相关的毒力进化、逆境适应机制等研究及穿梭载体构建打下基础。
1 材料与方法
1. 1 试验材料
1. 1. 1 菌株、质粒和引物
1. 1. 1. 1 菌株来源和质粒 为研究水稻条斑病菌的致病分子机理,广西大学生命科学与技术学院植物病原细菌功能基因组学实验室(本课题组属于该实验室,以下简称本实验室)建立了水稻黄单胞菌菌种库,本研究涉及的水稻条斑病菌中国菌株分别从来自于安徽、江苏、浙江、福建、广东、海南、云南和广西等地的水稻病株中分离获得,共257株菌株。其他菌株和质粒信息见表1。
1. 1. 1. 2 生物试剂 限制性内切酶购自Promega公司、Taq酶购自TaKaRa公司。化学试剂为分析纯级(AR)、培养基材料为生化实验级(BR)。PCR原料dNTP Mix购自索莱宝公司。用于DNA样品凝胶电泳的染料Gel Red(膠红)购自美国Biotium公司。
1. 1. 1. 3 PCR扩增引物 采用Vector NTI 11.5软件,按照pXOCgx01质粒(Niu et al.,2015)中目标基因的序列设计引物(表2),引物合成和DNA测序由深圳华大基因股份有限公司完成。
1. 1. 1. 4 质粒提取试剂 Solution I配方:45.0 mL(50 mmol/L)20%(w/v)葡萄糖、2.0 mL(10 mmol/L)0.5 mol/L EDTA(pH 8.0)、2.5 mL(25 mmol/L)1 mol/L Tris-HCl(pH 8.0)。用于细菌质粒提取第一步,重悬菌体,高压灭菌,4 ℃短期保存。Solution II配方:10.0 mL(0.2 mol/L)2 mol/L NaOH、10.0 mL(1%,w/v)10%(w/v)SDS。用于细菌质粒提取第二步,裂解菌体,需现配现用。Solution III配方:60.0 mL的5 mol/L醋酸钾、11.5 mL醋酸。用于细菌质粒提取第三步,沉淀蛋白等杂质,高压灭菌,4 ℃短期保存(萨姆布鲁克和拉塞尔,2002)。
1. 1. 1. 5 电泳缓冲液和上样缓冲液 电泳缓冲液TBE(10×)配方: 5.5 g(5.5%,w/v)Boric acid(硼酸)、4.0 mL(20 mmol/L) 0.5 mol/L EDTA(pH 8.0)和2.5 mL(25 mmol/L)Tris碱(pH 8.0),可作为DNA样品电泳缓冲液,制备琼脂糖凝胶,或作为母液制备0.5×TBE。高压灭菌,室温保存(萨姆布鲁克和拉塞尔,2002)。上样缓冲液Loading Buffer(10×)配方:0.02 g (0.2%,w/v)二甲苯青FF、0.02 g(0.2%,w/v)溴酚蓝、40.0 mL(200 mmol/L) 0.5 mol/L EDTA(pH 8.0)、1.0 mL(0.1%,w/v)10%(w/v)SDS和50.0 mL(50%)甘油,用于DNA样品凝胶电泳,可于室温保存(萨姆布鲁克和拉塞尔,2002)。
1. 1. 2 培养基及培养条件
1. 1. 2. 1 培养基 水稻条斑病菌各参试菌株均采用NB(Nutrient broth)培养基(配方:5.0 g/L高聚蛋白胨、3.0 g/L牛肉膏、1.0 g/L酵母提取物、10.0 g/L蔗糖、pH 7.0)进行液体培养,采用NA(Nutrient agar)培养基进行固体培养[在NB培养基配方的基础上加入1%(w/v)琼脂粉](Niu et al.,2015)。
1. 1. 2. 2 培养条件 水稻条斑病菌的最适培养温度为28 ℃。固体培养时,培养基倒置于培养箱中,24~48 h后可出现菌落;液体培养时,摇床转速为200 r/min,培养16~20 h。
1. 2 试验方法
1. 2. 1 DNA操作
1. 2. 1. 1 碱裂解法提取质粒 新鲜活化的Xoc菌株接种到含有10.0 mL NB培养基的30 mL通用培养瓶中,于28 ℃下200 r/min摇床培养16~20 h。收集1.5 mL菌液于1.5 mL EP管中,以12000 r/min离心1 min,弃去上清。加入200 μL保存在4 ℃冰箱的Solution I,充分混匀。加入400 µL新鲜配制的Solution II,轻柔混匀。立刻加入300 µL保存在4 ℃冰箱的Solution III,轻柔混匀,白色或淡黄色絮凝状沉淀产生。1200 r/min离心10~15 min,至沉淀聚集成块在EP管底部。吸取700~750 μL上清液移至另一新的1.5 mL离心管中,12000 r/min离心10 min。吸取500~600 μL上清液移至另一新的1.5 mL离心管中,加入2倍体积无水乙醇后混匀,于-20 ℃下静置20 min以上。静置后的混合液12000 r/min离心10 min使质粒DNA析出,弃上清液。加入500 µL 75%乙醇洗涤质粒DNA,上下晃动使乙醇溶液覆盖整个EP管内壁,12000 r/min离心3~5 min,弃上清液。用真空干燥器将质粒DNA干燥3~5 min,或将EP管倒置在吸水纸上,自然干燥10~15 min。在干燥后的DNA中加入40~50 μL灭菌的去离子水,待充分溶解后-20 ℃保存备用。
1. 2. 1. 2 限制性酶切体系 分离纯化质粒DNA,用不同的限制性内切酶(BamH I、EcoR I、Sma I、Kpn I和Pst I)分别进行单酶切。以20.0 μL酶切体系为例,单酶切时各组分添加比例如下:2.0 μL 10×Buffer、0.2 μL乙酰化BSA(10 μg/μL)、1.0 μL质粒DNA(1.0 μg/μL)、16.0 μL双蒸水、0.8 μL内切酶(10.0 U/μL)。各反应组分均加入后用移液器吸打使充分混匀,短暂离心,在相应的酶切温度(推荐温度)下反应4 h。
1. 2. 1. 3 琼脂糖凝胶电泳 根据DNA样品的分子量,确定琼脂糖凝胶的浓度与大小,本研究用1.0%琼脂糖,0.5×TBE缓冲液。将DNA样品和标度DNA(Marker)分别与已混有Gel Red的10×上样缓冲液混匀后,加入上样孔。打开电泳仪,100 V电泳至上样缓冲液移动到凝胶的3/4处。停止电泳,取出凝胶放入凝胶成像系统,拍照记录结果,用于酶切图谱分析。
1. 2. 1. 4 PCR扩增 反应体系10.00 μL:50 ng/μL DNA模板0.25 μL,10 μmol/L正、反向引物各0.50 μL,10 mmol/L dNTP 0.25 μL,Taq Buffer 1.00 μL,稀释Taq酶(1 U)1.00 μL,双蒸水6.50 μL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,退火温度60 ℃(根据引物而定,见表2)下退火45 s,72 ℃ 2 min,进行30个循环;72 ℃延伸2 min。在BIOER PCR仪上完成相关基因的扩增。反应结束后,取1.00 μL瓊脂糖凝胶电泳、凝胶成像、拍照记录。
1. 2. 2 生物信息学分析 采用Local BLAST对相关水稻黄单胞菌质粒序列进行比对,通过MEGAX进行全序列数据分析,采用Neighbor-joining法构建系统发育进化树(陈铭,2018),并用Evolview进行标注,采用圆形分支图进行呈现(He et al.,2016)。已知序列的pXOCgx01和pXOC2286的电子酶切图在Vector NTI所带的Gel Analysis组件中完成。
2 结果与分析
2. 1 水稻条斑病菌内源质粒的序列信息和特征
为掌握现有Xoc内源质粒的分布状况和序列信息,对GenBank数据库中公布的已完成或正在开展的Xoc全基因组测序数据库进行分析,结果(表3)显示已完成Xoc全基因组测序的17株水稻条斑病菌中只有2株菌株含有内源质粒,其中,pXOCgx01来源于中国Xoc GX01菌株,pXOC2286来源于马来西亚的Xoc CFBP2286菌株。数据库检索结果表明,Xoc內源质粒检出率为11.76%。同时发现43株水稻白叶枯病菌(同属于水稻黄单胞菌)中也仅有2株菌株含有内源质粒(表3),Xoo内源质粒检出率仅为4.65%。
质粒序列信息分析结果(表3)显示,水稻黄单胞菌4种质粒的GC含量在60.19%~61.25%,低于水稻黄单胞菌染色体DNA的GC含量(63.00%~64.00%),但差异不明显。基因比对分析结果表明,pXOCgx01、pXOC2286和pXOO43的基因具有一定的同源性,序列中存在较长的共线性片段;pXOC2286和pXOO43均含有完整的oriV复制区和vir基因簇,但没有czc基因簇和tnp基因簇;pXOOYN24质粒与其他3种质粒的基因构成完全不同,不仅没有oriV复制区,也没有pXOCgx01质粒携带的其他功能基因簇(Niu et al.,2015)。
系统发育进化分析结果(图1)表明,4株水稻黄单胞菌的内源质粒分属于黄单胞菌内源质粒不同的进化分支。水稻条斑病菌中的2种质粒pXOCgx01和pXOC2286也存在较远的进化距离。同一分支上的质粒具有类似的序列特点及基因构成等,但这些质粒来源于不同种的黄单胞菌。这一结果提示黄单胞菌在属水平上来看,接纳的质粒差异性很大,质粒是否能在黄单胞菌中存在,与菌株本身的限制修饰系统及质粒类型密切相关。从携带的基因来看,相当一部分质粒带有vir基因簇(包括缺少部分基因的非完整vir基因簇)、tnp基因簇和tal基因簇,少部分质粒带有czc基因簇。
2. 2 水稻条斑病菌中国菌株中内源质粒的鉴定结果
为掌握水稻条斑病菌中国菌株中内源质粒的分布情况,采用碱裂解法提取质粒,再凝胶电泳,对本实验室分离保存的257株Xoc菌株(其中79株来自安徽、75株来自广西、58株来自海南、22株来自广东、13株来自福建、8株来自浙江、1株来自江苏、1株来自云南)进行质粒鉴定,凡是电泳后经DNA染色有质粒条带的表示该菌株含有质粒(见图2中的质粒代表),没有质粒条带的确定为不含质粒。结果(表4)表明,在257株水稻条斑病菌中国分离株中共检测到29株含内源质粒,质粒检出率为11.28%;从分离菌株的地域来看,带有内源质粒的菌株均来自于华南地区,且大部分来自广西(质粒检出率为31.58%),其原因正在进一步研究。
2. 3 水稻条斑病菌中国菌株内源质粒酶切带型分析结果
分别采用BamH I、Kpn I、Pst I、EcoR I和Sma I等常用内切酶对pXOCgx01及其他被分离的质粒进行酶切,电泳图谱见图3。通过合并因酶切带型一致而被认为是同种质粒的样品后,共得到9种不同类型的新内源质粒,分别根据菌株名命名为pXOCgx02、pXOCB116、pXOCB209、pXOCB216、pXOCB220、pXOCB409、pXOC709、pXOC820和pXOC905。从酶切带型初步判断pXOC209与pXOCgx01、pXOCgx02与pXOC905、pXOCB216与pXOC709较类似。pXOCB409的长度最短,而pXOCB220的长度可能最长。
比较pXOCgx01质粒的酶切和电子酶切图谱,结果发现pXOCgx01测序组装正确,说明电子酶切图谱可用于DNA带型比较。从电子酶切图谱来看,pXOC2286与其他质粒明显不同。本研究结果表明,目前从水稻条斑病菌共发现11种类型的内源质粒,除pXOCgx01和pXOC2286外,其他9种质粒属于新型质粒。
2. 4 水稻条斑病菌中国菌株内源质粒主要功能区段的PCR鉴定结果
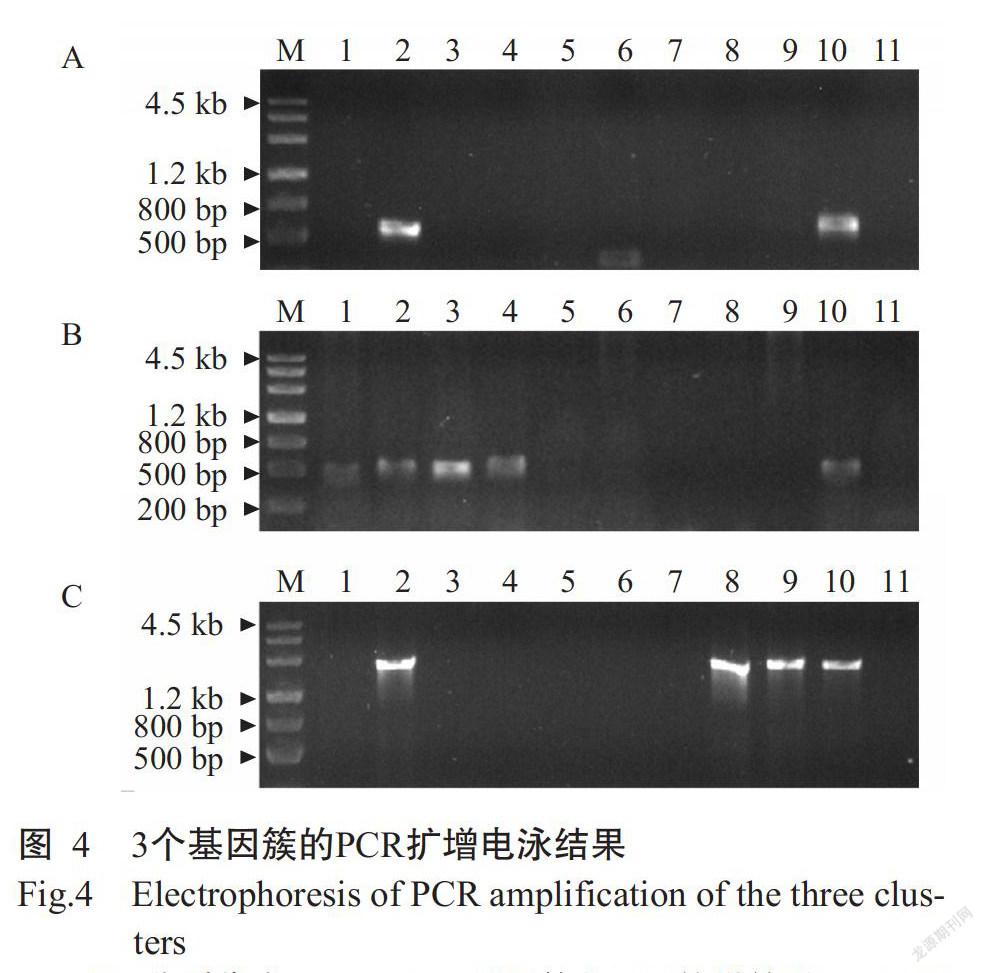
基于pXOCgx01质粒中含有的功能基因簇进行序列比对分析,结果显示在已完成测序的几个水稻黄单胞菌内源质粒中,这些基因簇的分布存在明显的多样性,值得对中国Xoc菌株内源质粒进行相关基因簇鉴定。根据pXOCgx01中3个基因簇的保守基因设计3对引物(表2),分别以分离的内源质粒为模板进行PCR扩增。电泳结果(图4)显示,只有pXOCB209质粒能扩增出3条条带;pXOCB116、pXOCB216和pXOCB220质粒中能扩增出tnp基因带;pXOC905和pXOCgx02质粒中能扩增出vir基因带;pXOC709中能扩增出1条明显小于预计产物的条带;pXOCB409和pXOC820中未扩增出任何条带。PCR扩增电泳结果提示pXOCB209质粒含有相应的3个基因簇(表5),pXOCB116、pXOCB216和pXOCB220质粒含有tnp基因簇,pXOC905和pXOCgx02质粒含有vir基因簇,pXOC709中可能含有变异的czc基因,而pXOCB409和pXOC820可能不含相关的3个基因簇,详细结果待完成序列测定。
本研究初步鉴定到9种新类型的Xoc内源质粒,加上已报道的2种质粒,目前已从Xoc中发现11种内源质粒,这些质粒在大小和携带的功能基因方面呈现出多样性。酶切图谱(图3)与PCR扩增电泳结果关联分析(图4和表5)可初步将这些质粒进行分组:(1)Xoc B209菌株携带的pXOCB209质粒,与pXOCgx01具有接近的酶切带型和PCR产物。推测pXOCB209具有类似于pXOCgx01的质粒结构和功能基因;(2)pXOCB116、pXOCB216和pXOCB220在酶切带型和PCR产物条带上也非常相似,均具有tnp基因簇;(3)pXOCgx02和pXOC905两个质粒均含有vir基因簇,与pXOC2286(马来西亚)所带功能基因相似(表3);(4)pXOCB409和pXOC820均未扩增出功能基因条带;(5)pXOC709能扩增出1条小于目标基因的条带,推测该同源基因内部发生了缺失变异。
3 讨论
质粒作为染色体外的遗传物质,具有可移动、易变异等特点,尽管质粒较少参与细菌的基本代谢,但在宿主菌的环境适应和毒力进化方面发挥重要作用(Carroll and Wong,2018)。近年来,质粒在人类和动物超级病菌进化、传播等方面的作用机理研究已成为人们关注的热点问题之一(Wang et al.,2018),而质粒在植物病原细菌方面的研究工作相对较少(Niu et al.,2015;Gochez et al.,2018)。本研究分别采用数据库检索和质粒提取两种方式对Xoc不同地域分离菌株中的内源质粒进行调查,两种方式的质粒检出率分别为11.76%和11.28%。Xoc群体中含有内源质粒的菌株比例为11.52%,大致为1∶10的关系,推测质粒对Xoc正常的致病机制或环境适应具有一定贡献,但不是主要因素。在黄单胞菌属中,不同菌种带有内源质粒的比例相差很大,据不完全统计,几乎所有的柑橘黃单胞菌(Xanthomonas citri)菌株均含有内源质粒,每个菌株含2~4个不同型质粒,柑橘黄单胞菌在致病机制或环境适应方面对内源质粒具有较大的依赖(Gochez et al.,2018)。从黄单胞菌质粒携带的基因来看,vir基因、tnp基因和tal基因最常见,少部分质粒带有czc基因,这些基因在内源质粒中的差异是否会影响黄单胞菌的寄主特异性目前尚不清楚,值得进一步关注。
系统进化分析结果显示,Xoc中已发表的2种质粒pXOCgx01和pXOC2286位于不同的进化分支,表明质粒间存在较大进化差异,提示同类菌株可携带不同类型的质粒。本研究也发现同一分支上的质粒却来源于不同种的黄单胞菌,提示黄单胞菌在属水平上质粒接纳的菌株特异性不高,质粒是否能在黄单胞菌中存在,与菌株个体本身的限制修饰系统及质粒类型密切相关。
从GenBank数据库基因组信息可看出,除了中国和马来西亚2株Xoc菌株含有内源质粒外,世界其他稻区(非洲、印度、日韩和菲律宾等国家和地区)分离的Xoc菌株均未发现携带内源质粒。Xoc中国分离株的内源质粒提取结果也显示出,带有内源质粒的Xoc菌株分布具有明显地域特征,均来源于华南稻区,尤其是广西稻区,内源质粒检出率高达31.58%。华东地区(4省)104株被检菌株中均无内源质粒检出。从被检菌株的数量来看,质粒分布的这种不均衡性似乎不是人为取样偏差造成,有关广西菌株中拥有内源质粒比例相对较高的原因有待进一步探究。广西是世界范围内野生稻资源最丰富的地区之一,全基因组关联分析(Genome-wide association study,GWAS)结果表明,广西野生稻可能是栽培稻的最近祖先,也是主要的栽培稻驯化地区之一(Huang et al.,2012);同时,广西属于多民族地区,水稻耕作方式各异,常规稻品种繁多,推测Xoc菌株面对多样的水稻品种、复杂的地理环境等因素,在长期的进化过程中,一方面自身在不断变异,限制系统发生变化,降低了对质粒的排斥作用;另一方面,通过接纳质粒获得水平转移来的基因,增强自身的生存能力。前期本课题组鉴定的Xoc第一例内源质粒pXOCgx01携带有完整的czcCBA基因簇,编码钴—锌—镉抗性蛋白,在金属抗逆性方面发挥作用(Niu et al.,2015;Hülter et al.,2017)。该质粒分离自广西贺州市,该市是我国著名的有色金属之乡,多处农田重金属超标(李忠义等,2009)。推测pXOCgx01携带有完整的czcCBA基因簇有利于宿主菌在高污染环境下生存。质粒能提高宿主菌重金属抗性的研究在多种细菌中已有报道(范丽平等,2010)。从质粒酶切图谱和PCR扩增电泳结果来看,来自于广西梧州市藤县的Xoc B209菌株携带的pXOCB209质粒与pXOCgx01具有接近的酶切带型和PCR产物,推测pXOCB209具有类似于pXOCgx01的质粒结构和功能基因。这两株菌株的分离地点原属于同一行政区,不能排除是同一菌株随种子等在该地区扩散引起。质粒在不同菌株间自主转移的问题,也可能是同型质粒出现在不同地域的原因之一(Yanagiya et al.,2018)。pXOCB116、pXOCB216和pXOCB220在酶切带型和PCR产物条带上也非常相似,均具有tnp基因簇,而且这些质粒的宿主菌来自于广西玉林和博白,两地相邻,也有可能是同一菌株扩散的结果。pXOCgx02(广西灵川)和pXOC905(广东英德)两个质粒均含有vir基因簇,与pXOC2286(马来西亚)所带功能基因相似(Wilkins et al.,2015)。本研究结果还显示,部分质粒没有扩增出相应基因的条带,可能不含相关基因,也可能是由于引物问题造成的假阴性,尚有待进一步探究。
4 结论
部分Xoc菌株中含有一定数量的内源质粒,质粒类型、所含功能基因等具有一定的多样性,主要包括vir毒力因子、DNA转移及重金属抗性基因等。携带内源质粒的Xoc菌株有明显的地域性,主要集中在华南稻区,特别是广西稻区。本研究中鉴定的一系列内源质粒将为构建一系列穿梭质粒载体提供材料,同时这些质粒将在植物病害流行病学中跟踪毒性菌株的流行路径、菌体密度等方面发挥重要作用。
参考文献:
陈铭. 2018. 生物信息学[M]. 第3版.北京:科学出版社. [Chen M. 2018. Bioinformatics[M]. The 3rd Edition. Beijing: Science Press.]
范丽平,王亚峰,霍贵成. 2010. 乳酸乳球菌镉抗性质粒的鉴定及镉抗性功能片段的获取[J]. 中国食品学报,10(3): 205-212. [Fan L P,Wang Y F,Huo G C. 2010. Identification of Lactococcus lactis cadmium resistance plasmid and acquisition of the cadmium resistance functional fragment[J]. Journal of Chinese Institute of Food Science and Technology,10(3): 205-212.]
J. 萨姆布鲁克,D. W. 拉塞尔. 2002. 分子克隆实验指南[M]. 黄培堂译. 第3版. 北京:科学出版社. [Sambrook J,Ru-ssell D W. 2002. Molecular cloning laboratory manuals[M]. Translated by Huang P T. The 3rd Edition. Beijing: Science Press.]
李忠义,张超兰,邓超冰,顾明华,李磊,刘敏. 2009. 铅锌矿区农田土壤重金属有效态空间分布及其影响因子分析[J]. 生态环境学报,18(5): 1772-1776. [Li Z Y,Zhang C L,Deng C B,Gu M H,Li L,Liu M. 2009. Analysis on spatial distribution of soil available heavy metals and its influential factors in a lead-zinc mining area of Guangxi,China[J]. Ecology and Environmental Sciences,18(5): 1772-1776.]
馬路,方媛,肖飒清,周纯,金哲伦,叶雯澜,饶玉春. 2018. 水稻条斑病抗性QTL的挖掘及相关基因的表达[J]. 植物学报,53(4): 468-476. [Ma L,Fang Y,Xiao S Q,Zhou C,Jin Z L,Ye W L,Rao Y C. 2018. QTL exploration of bacterial leaf streak and their gene expression in rice[J]. Chinese Bulletin of Botany,53(4): 468-476.]
吴神怡,刘书言,刘君梁,段承杰,冯家勋. 2010. 一株能通过接合导入外源质粒的水稻黄单胞菌水稻致病变种菌株的获得及鉴定[J]. 广西农业科学,41(9): 873-876. [Wu S Y,Liu S Y,Liu J L,Duan C J,Feng J X. 2010. Isolation and identification of a Xanthomonas oryzae pv. oryzae strain capable of efficiently accepting exogenous plasmid by conjugation[J]. Guangxi Agricultural Sciences,41(9): 873-876.]
肖永胜,韦雪雪,郜惠苹,牛祥娜,岑贞陆,黄萍,吴玥,汪嵘,何勇强. 2011. 一株水稻细菌性条斑病菌的鉴定与遗传操作系统的建立[J]. 基因组学与应用生物学,30: 1211-1217. [Xiao Y S,Wei X X,Gao H P,Niu X N,Cen Z L,Huang P,Wu Y,Wang R,He Y Q. 2011. Characterization of a Xanthomonas oryzae pv. oryzicola strain and the establishment of its genetic manipulation system[J]. Genomics and Applied Biology,30: 1211-1217.]
Bogdanove A J,Koebnik R,Lu H,Furutani A,Angiuoli S V,Patil P B,Van Sluys M A,Ryan R P,Meyer D F,Han S W,Aparna G,Rajaram M,Delcher A L,Phillippy A M,Puiu D,Schatz M C,Shumway M,Sommer D D,Trapnell C,Benahmed F,Dimitrov G,Madupu R,Radune D,Sullivan S,Jha G,Ishihara H,Lee SW,Pandey A,Sharma V,Sriariyanun M,Szurek B,Vera-Cruz C M,Dorman KS,Ronald P C,Verdier V,Dow J M,Sonti R V,Tsuge S,Brendel V P,Rabinowicz P D,Leach J E,White F F,Salzberg S L. 2011. Two new complete genome sequen-ces offer insight into host and tissue specificity of plant pathogenic Xanthomonas spp.[J]. Journal of Bacteriology,193(19): 5450-5464.
Carattoli A. 2013. Plasmids and the spread of resistance[J]. International Journal of Medical Microbiology,303(6-7): 298-304.
Carroll A C,Wong A. 2018. Plasmid persistence: Costs,benefits,and the plasmid paradox[J]. Canadian Journal of Microbiology,64(5): 293-304.
De Feyter R,Gabriel D W. 1991. At least six avirulence genes are clustered on a 90-kilobase plasmid in Xanthomonas campestris pv. malvacearum[J]. Molecular Plant-Microbe Interactions,4(5): 423-432.
Ferreira R M,de Oliveira A C,Moreira L M,Belasque J Jr,Gourbeyre E,Siguier P,Ferro M I,Ferro J A,Chandler M,Varani A M. 2015. A TALE of transposition: Tn3-like transposons play a major role in the spread of pathogenicity determinants of Xanthomonas citri and other Xanthomonads[J]. MBIO,6(1): e02505-02514.
Gochez A M,Huguet-Tapia J C,Minsavage G V,Shantaraj D,Jalan N,Strauß A,Lahaye T,Wang N,Canteros B I,Jones J B,Potnis N. 2018. Pacbio sequencing of copper-tolerant Xanthomonas citri reveals presence of a chimeric plasmid structure and provides insights into reassortment and shuffling of transcription activator-like effectors among X. citri strains[J]. BMC Genomics,19(1): 16.
Gonzalez C,Szurek B,Manceau C,Mathieu T,Séré Y,Verdier V. 2007. Molecular and pathotypic characterization of new Xanthomonas oryzae strains from west Africa[J]. Molecular Plant-Microbe Interactions,20(5): 534-546.
He Z L,Zhang H K,Gao S H,Lercher M J,Chen W H,Hu S. 2016. Evolview v2: An online visualization and ma-nagement tool for customized and annotated phylogenetic trees[J]. Nucleic Acids Research,44(1):236-241.
Huang X H,Kurata N,Wei X H,Wang Z X,Wang A,Zhao Q,Zhao Y,Liu K Y,Lu H Y,Li W J,Guo Y L,Lu Y Q,Zhou C C,Fan D L,Weng Q J,Zhu C R,Huang T,Zhang L,Wang Y C,Feng L,Furuumi H,Kubo T,Miyabayashi T,Yuan X P,Xu Q,Dong G J,Zhan Q L,Li C Y,Fujiyama A,Toyoda A,Lu T T,Feng Q,Qian Q,Li J Y,Han B. 2012. A map of rice genome variation reveals the origin of cultivated rice[J]. Nature,490(7421):497-501.
Hülter N,Ilhan J,Wein T,Kadibalban A S,Hammerschmidt K,Dagan T. 2017. An evolutionary perspective on plasmid lifestyle modes[J]. Current Opinion in Microbiology,38:74-80.
Ji Z Y,Zakria M,Zou LF,Xiong L,Li Z,Ji G H,Chen G Y. 2014. Genetic diversity of transcriptional activator-like effector genes in Chinese isolates of Xanthomonas oryzae pv. oryzicola[J]. Phytopathology,104(7): 672-682.
Nies D H. 1995. The Cobalt,Zinc,Cadmium efflux system CzcABC from Alcaligenes eutrophus functions as a ca-tion-proton antiporter in Escherichia coli[J]. Journal of Bacteriology,177(10): 2707-2712.
Niño-Liu D O,Ronald P C,Bogdanove A J. 2006. Xanthomonas oryzae pathovars: Model pathogens of a mo-del crop[J]. Molecular Plant Pathology,7(5): 303-324.
Niu X N,Wei Z Q,Zou H F,Xie G G,Wu F,Li K J,Jiang W,Tang J L,He Y Q. 2015. Complete sequence and detailed analysis of the first indigenous plasmid from Xanthomonas oryzae pv. oryzicola[J]. BMC Microbiology,15(1): 233-247.
Suhartono S,Savin M C,Gbur E E. 2018. Transmissible plasmids and integrons shift Escherichia coli population toward larger multiple drug resistance numbers[J]. Microbial Drug Resistance,24(3):244-252.
Sundin G W. 2007. Genomic insights into the contribution of phytopathogenic bacterial plasmids to the evolutionary history of their hosts[J]. Annual Review of Phytopathology,45: 129-151.
Thomas C M,Thomson N R,Cerdeño-Tárraga A M,Brown C J,Top E M,Frost L S. 2017. Annotation of plasmid genes[J]. Plasmid,91: 61-67.
Vivian A,Murillo J,Jackson R W. 2001. The roles of plasmids in phytopathogenic bacteria: Mobile arsenals[J]. Microbiology,147(4): 763-780.
Voth D E,Broederdorf L J,Graham J G. 2012. Bacterial Type IV secretion systems: Versatile virulence machines[J]. Future Microbiology,7(2): 241-257.
Wang R,van Dorp L,Shaw LP,Bradley P,Wang Q,Wang X,Jin L,Zhang Q,Liu Y,Rieux A,Dorai-Schneiders T,Weinert L A,Iqbal Z,Didelot X,Wang H,Balloux F. 2018. The global distribution and spread of the mobilized colistin resistance gene mcr-1[J]. Nature Communication,9(1): 1179.
Wilkins K E,Booher N J,Wang L,Bogdanove A J. 2015. TAL effectors and activation of predicted host targets distinguish Asian from African strains of the rice pathogen Xanthomonas oryzae pv. oryzicola while strict conservation suggests universal importance of five TAL effectors[J]. Frontiers in Plant Science,6: 536-552.
Yanagiya K,Maejima Y,Nakata H,Tokuda M,Moriuchi R,Dohra H,Inoue K,Ohkuma M,Kimbara K,Shintani M. 2018. Novel self-transmissible and broad-host-range plasmids exogenously captured from anaerobic granules or cow manure[J]. Frontiers in Microbiology,9: 2602.
(責任编辑 麻小燕)

