解磷拮抗真菌分离鉴定及其对猕猴桃软腐病的生防评价
卯婷婷 莫维弟 赵玳琳 王廿 陶刚







摘要:【目的】篩选可应用于猕猴桃果实软腐病的高效生防菌株,为猕猴桃软腐病生防制剂研发提供菌种资源。【方法】采集有猕猴桃软腐病发生的猕猴桃种植园健康植株根际土壤,利用解磷选择性培养基分离土壤中解磷真菌,采用平板对峙法、菌落直径法、继代培养及发酵液抑菌试验等从中筛选对猕猴桃软腐病菌具有拮抗作用的菌株,通过形态学结合分子生物学方法对拮抗菌株进行鉴定。【结果】从猕猴桃根际土壤中分离得到35株解磷真菌菌株,通过对峙培养从中筛选出5株对猕猴桃软腐病菌具有拮抗作用且抑菌率超过50.00%的菌株,其中MHT0308菌株的抑菌效果最佳,对猕猴桃软腐病菌的抑菌率达87.71%,复筛抑菌圈也明显,抑菌直径达33.50 mm;MHT0308菌株的含菌发酵液和无菌发酵液均对靶标菌生长有抑制作用,抑菌率分别达88.13%和80.87%;猕猴桃果实经MHT0308菌株发酵液处理后对猕猴桃软腐病的离体防效达87.00%;根据MHT0308菌株形态学特征结合其分子生物学鉴定结果,确定MHT0308菌株为哈茨木霉菌(Trichoderma harzianum)。【结论】MHT0308菌株对猕猴桃软腐病具有较好的防治效果,可作为一种重要的生防菌资源用于猕猴桃软腐病防治研究。
关键词: 猕猴桃软腐病;解磷菌;抑菌作用;离体防效;木霉菌
中图分类号: S436.634 文献标志码: A 文章编号:2095-1191(2019)08-1748-08
Isolation and identification of phosphate-solubilizing antagonistic
fungus and its biocontrol effects against kiwifruit soft rot
MAO Ting-ting1, MO Wei-di2, ZHAO Dai-lin1, WANG Nian1, TAO Gang1*
(1Institute of Plant Protection,Guizhou Academy of Agricultural Sciences, Guiyang 550006, China;
2Agricultural College, Guizhou University, Guiyang 550025, China)
Abstract:【Objective】The aim of the study was to screen the efficient biocontrol strains that could be applied to the green prevention and control of kiwifruit soft rot, and provide resources for biocontrol agent development for kiwifruit soft rot. 【Method】The healthy rhizosphere soil of kiwifruit plantation with kiwifruit soft rot was collected, and the phosphate- solubilizing fungus was separated from the soil using selective phosphate-degrading medium. At the same time, the antagonistic fungus against kiwifruit soft rot were screened by using plate confront culture, colony diameter inhibition assay, subculture and fermentation broth inhibition test. The fungi were classified through the morphological characteristics and molecular biology. 【Result】Thirty-five strains of phosphorus-releasing fungi were isolated from the rhizosphere soil of kiwifruit, five strains with an antagonistic effect on soft rot of kiwifruit and the inhibition rate more than 50.00% were selected through confrontation culture. Among them, MHT0308 strain had the best inhibitory effect and it had 87.71% control efficiency to soft rot of kiwifruit. And the inhibition zone was obvious with the inhibition diameter of 33.50 mm. Both sterilized and non-sterilized fermentation liquid of MHT0308 strain were effective against target pathogen hyphae, the inhibitory rates were 88.13% and 80.87%, respectively. The control effect of kiwifruit in vitro was 87.00% after trea-ted with MHT0308 fermentation broth. According to the morphological characteristics and molecular biology, the strain MHT0308 was identified as Trichoderma harzianum. 【Conclusion】Strain MHT0308 has sound control efficacy against kiwifruit soft rot and can be used as an important biocontrol resource for the prevention and treatment of kiwi soft rot.
Key words: kiwifruit soft rot; phosphate-solubilizing fungus; bacteriostatic effect; control effect in vitro; Trichoderma
0 引言
【研究意义】猕猴桃(Actinidia chinensis Planch)又名长寿果、美容果,每100 g猕猴桃果肉中维生素C含量可达652~930 mg,故又被誉为维C之王(杨宗正,2018)。猕猴桃在我国陕西、甘肃、河南、广西、广东、福建、云南、贵州和四川等省(区)均有种植分布。近年来,猕猴桃种植面积逐渐扩大,在产量和效益上升的同时,猕猴桃病害也日益突出,尤其是猕猴桃果实软腐病作为储藏期病害对猕猴桃产业危害尤为严重,通常采摘时无症状,储藏期开始发病,发病率一般为20%,严重时可达50%(马松涛等,2000),直接影响猕猴桃的经济价值。目前国内外对该病害的防控主要以化学防治为主,研究表明,抗菌素402、退菌特、抗菌素401、波尔多液(余桂萍和周洪旗,2009),多菌灵(王小洁等,2017),肟菌酯戊唑醇、己唑醇、戊唑醇、异菌脲、苯醚甲环唑(吴文能等,2018)等化学药剂对猕猴桃软腐病均有较好的防治效果。但化学药剂的大量使用既增加了猕猴桃软腐病菌的抗药性风险,还容易造成农药残留和环境污染等问题。随着人们对绿色食品的需求,生物防治逐渐在病害防控方面体现出其优势,因此,挖掘可利用的生防菌资源对猕猴桃产业的可持续发展具有重要意义。【前人研究进展】猕猴桃软腐病是一类真菌病害,不同国家及地区猕猴桃软腐病病原菌存在明显差异,主要有拟茎点霉菌(Phomopsis sp.)(Luongo et al.,2011)和葡萄座腔菌(Botryosphaeria dothidea)(Zhou et al.,2015)等真菌。李黎等(2016)对我国猕猴桃主产区的28个果园样本进行病原菌分离鉴定,发现拟茎点霉菌(P. lithocarpus)是我国猕猴桃果实软腐病的主要病原菌,葡萄座腔菌(B. dothidea)和小孢拟盘多毛孢菌(Pestalotiopsis microspora)是次要病原菌,并且拟茎点霉菌是贵州、四川及江西等地区的主要为害病原菌。近年来,国内外已有学者对猕猴桃病害的生物防治进行了研究,其中针对猕猴桃灰霉病的研究较多(Dodd et al.,2004;Kim et al.,2015),而对猕猴桃软腐病的研究相对较少。Mohamed等(2011)发现用1-甲基环丙烯预处理后再用解淀粉芽孢杆菌处理可降低冷藏过程中猕猴桃软腐病的发病率。何应红等(2016)在青蒿内生真菌中筛选出一株对猕猴桃软腐病有抑制作用的菌株青蒿21号,并进一步证明其发酵液粗提物对该病原菌的抑菌活性达100%,但并未对菌株进行鉴定。胡容平等(2017)通过木霉与猕猴桃软腐病菌的对峙培养及其难挥发性代谢产物的拮抗试验,发现木霉菌株T156-37对猕猴桃软腐病有较好的抑制效果,抑制率达66.11%,另一株菌株T163-8的代谢产物则表现出对猕猴桃软腐病菌的拮抗优势,其抑制率达63.26%。王小洁等(2017)通过平板对峙法筛选发现多粘芽胞杆菌(Paenibacillus polymyxa)对猕猴桃软腐病菌的菌丝生长和孢子萌发有显著的抑制作用。【本研究切入点】目前国内外报道用于防治猕猴桃软腐病的可用生物菌株资源较少,缺少可替代化学农药的高效生防制剂。为丰富可有效防控猕猴桃软腐病害的生防微生物种类,进一步为开展生防菌制剂研发提供菌種资源,有必要分离筛选更多不同类型的微生物功能菌。【拟解决的关键问题】利用解磷菌的溶磷特性从土壤中选择分离解磷菌株,并利用平板对峙法、菌落直径法、继代培养及发酵液抑菌试验等从中筛选对猕猴桃软腐病菌有拮抗作用的菌株,同时通过形态学结合分子生物学方法对拮抗菌株进行鉴定,以期为猕猴桃软腐病生防制剂研发提供菌种资源。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试材料 供试猕猴桃品种为贵长猕猴桃。供试猕猴桃软腐病病菌为MHTRF160420,2015年10月分离自贵州省修文县猕猴桃果园所采集的猕猴桃软腐病果实病样,保存于贵州省植物保护研究所植物病理研究室。
1. 1. 2 培养基 解磷选择性培养基:葡萄糖10.00 g,NaCl 0.3 g,KCl 0.30 g,MgSO4·7H2O 0.30 g,FeSO4·7H2O 0.03 g,MnSO4 0.03 g,(NH4)2SO4 0.50 g,磷酸钙5.00 g,蒸馏水1000 mL,琼脂15.00~20.00 g,pH 6.8~7.0。木霉培养基:马铃薯200.00 g,葡萄糖20.00 g,琼脂20.00 g,链霉素(Streptomytin)0.10 g,氯霉素(Chloramphenicol)0.30 g,玫瑰红(Rose bengal)0.02 g,蒸馏水1000 mL,自然pH。PD液体培养基:葡萄糖 20.00 g,土豆200.00 g,蒸馏水1000 mL,自然pH。
1. 2 试验方法
1. 2. 1 猕猴桃软腐病拮抗菌株的分离与筛选 解磷菌株筛选:在贵州省修文县中哨村猕猴桃园区(东经106°34′25″,北纬26°47′42″,海拔1314.0±3.0 m)选择猕猴桃软腐病等病害发生严重的地块为土样采集点,利用五点法采集健康植株的根际土壤。将土样与无菌水以1∶10的比例稀释,于150 r/min振荡20 min后制成土壤初悬液备用,按逐级梯度稀释法制备浓度为10-3、10-4和10-5的悬浮液,在冷凝的解磷选择性培养基上涂布100 μL土壤悬浮液并置于25 ℃的培养箱中培养,每个浓度重复5板。培养2 d后开始观察,纯化保存有解磷圈产生的菌落,从而分离获得解磷真菌菌株。
平板对峙法试验:以猕猴桃软腐病菌MHTRF 160420为靶标病原菌,分离保存的解磷真菌菌株为待测菌进行平板培养,在PDA培养基两侧分别接种直径为5 mm的病原菌及待测菌菌饼,25 ℃培养7 d后,计算待测菌的抑制率,抑制率的计算参照梁建根等(2007)的方法,根据菌株抑制率初筛出猕猴桃软腐病菌拮抗菌株,然后进行抑菌圈复筛。
拮抗菌复筛试验:将猕猴桃软腐病菌培养9 d以上待其产孢后,用无菌水洗脱制成1×106 CFU/mL的孢子悬液,按1∶10的比例将其与PDA培养基混匀后倒板,然后在含有病原菌的PDA培养基中央接种初筛拮抗效果较好的菌株,25 ℃黑暗培养,3 d后记录抑菌圈直径,筛选出效果最好的拮抗菌株进行下一步试验。
1. 2. 2 拮抗菌株继代培养试验 对筛选获得的拮抗菌进行继代培养,根据其生长速率,28 ℃培养条件下每生长3 d为1代,然后于菌落边缘打取菌块后继续培养3 d为第2代,以此类推,继代培养后获得第1、5、10、15和20代拮抗菌株,用平板对峙法分别测定拮抗菌不同培养代数的拮抗活性,评估其拮抗性状的遗传稳定性。
1. 2. 3 拮抗菌发酵液抑菌活性试验 将活化好的拮抗菌株接种到PD液体培养基中,25 ℃下150 r/min发酵培养7 d,利用单层无菌纱布过滤掉发酵液中的菌丝块,将滤液分为两份,一份放入10000 r/min的离心机中离心3 min,充分离心2次,得到的上清液为不含菌体发酵液,主要含有拮抗菌的次生代谢产物;另一份滤液再过一次无菌单层纱布后,放入3000 r/min的离心机中离心3~5 s,并利用血球计数板将其发酵滤液分生孢子浓度调整为1×106 CFU/mL,获得的上清液为含有菌体发酵液。以猕猴桃软腐病菌为指示菌,用菌落直径法测定拮抗菌两种发酵液的抑菌特性。
两种发酵液抑菌活性测定:分别将拮抗菌的两种发酵液与PDA培养基按体积1∶10的比例混匀后倒板,冷凝后在中央接种猕猴桃软腐病菌菌饼,以普通PDA培养基为对照,将处理与对照同时放于25 ℃的生化培养箱中培养7 d后,调查猕猴桃软腐病菌的菌落生长直径,计算两种发酵液对猕猴桃软腐病菌菌丝生长的抑制率,每处理3次重复。
1. 2. 4 拮抗菌发酵液对猕猴桃软腐病的离体防效测定 取新鲜健康的猕猴桃果实用75%酒精浸泡30~60 s,然后用无菌水浸洗3次,擦干果实表面水分,用接种针过火消毒后刺伤果皮,每果刺孔数相同,待猕猴桃表皮毛软化后将其分为两组,一组用1.2.3试验中制得的无菌发酵液喷雾整个猕猴桃果实后于伤口处接种猕猴桃软腐病菌菌饼,另一组喷雾无菌水后接种猕猴桃软腐病菌作为对照,两组同时放入用无菌纱布保湿的保鲜盒中,用保鲜膜密封保鲜,置于温度26 ℃、相对湿度90%的恒温室中12 h光照黑暗交替培养,每处理重复3组,每组设6次重复。3 d后开始观察猕猴桃的发病情况,7 d后调查猕猴桃软腐病发病率及拮抗菌发酵液的防治效果。
1. 2. 5 拮抗菌株鉴定 形态学方法鉴定:刮取新生长3 d的菌落边缘菌丝,用1%葡萄糖溶液制成拮抗菌菌悬液,吸取1滴菌悬液制片并观察其菌丝形态;将1%葡萄糖溶液倒入平板后用无菌刷洗菌落,制成孢子悬浮液后,吸1滴孢子悬浮液制片并观察分生孢子形态特征。
分子生物学方法鉴定:在冷凝的PDA培养基上铺无菌玻璃纸,在培养基中央隔离接种拮抗菌,待菌丝长满培养皿后,收集约20 mg菌丝体用液氮研磨成粉末加入到15 mL的无菌离心管中,利用生工生物工程(上海)股份有限公司的Ezup柱式真菌基因组DNA抽提试剂盒进行标准步骤抽提获得拮抗菌DNA备用。PCR扩增和反应体系参照White等(1990)的方法。PCR反应体系25.0 μL:DNA模板1.0 μL,2×Es Taq Master Mix 12.5 μL,上、下游通用引物ITS1和ITS4各1.0 μL,无菌水9.5 μL。系统发育进化树构建及进化分析:先将测得的拮抗菌株ITS序列在NCBI数据库中进行相似性检索,利用拮抗菌株的ITS序列及GenBank相近似真菌的ITS序列在MEGA 7.0中采用ClustalW进行对齐,用Neighbor-joining法构建系统发育进化树,采用自举法对其进行检验,重复1000次,进而分析拮抗菌株的分类地位。
2 结果与分析
2. 1 解磷拮抗菌株对猕猴桃软腐病菌的抑菌作用
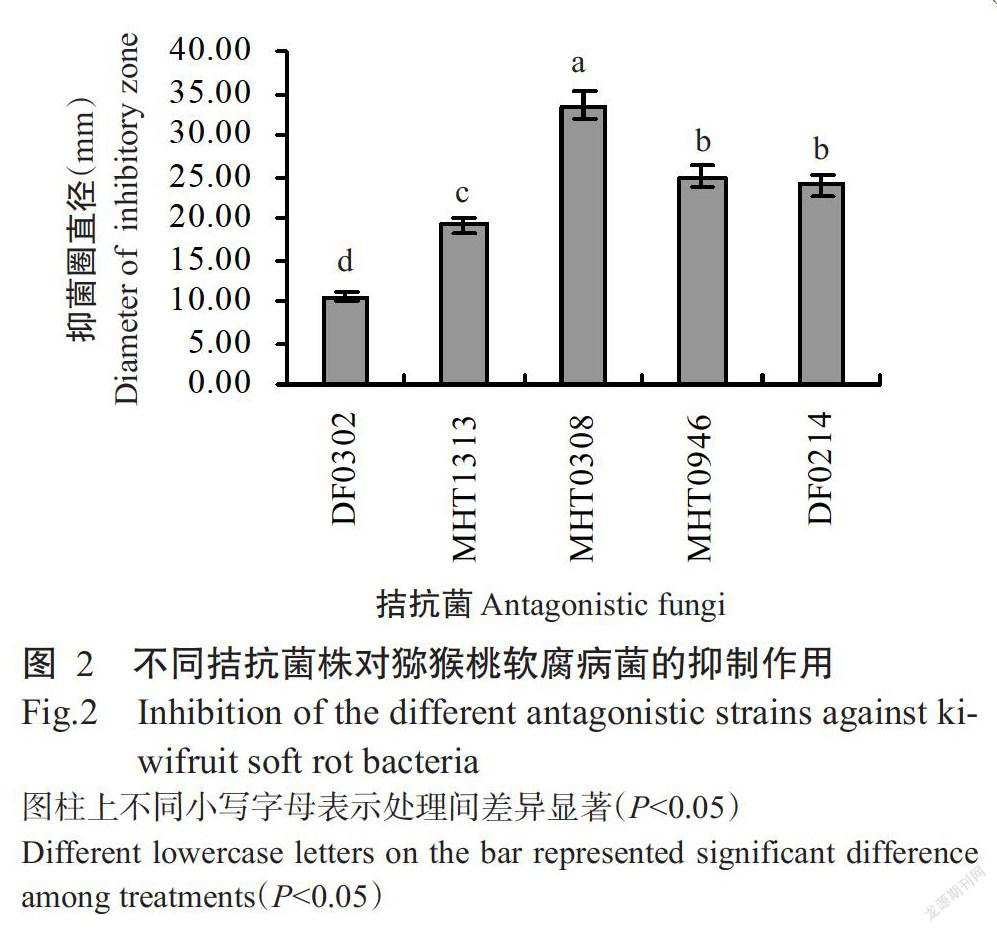
从猕猴桃根际土样中分离得到35株解磷真菌菌株,对峙培养结果(表1)显示,从35株解磷真菌中共筛选出5株对猕猴桃软腐病菌有拮抗作用且抑菌率超过50.00%的菌株,其中对峙抑菌效果最好的为MHT0308菌株,其对猕猴桃软腐病菌的抑菌率达87.71%,其次为MHT0946菌株,两者对猕猴桃软腐病菌的抑菌率差异不显著(P>0.05,下同),但均显著高于其他3株菌株(P<0.05,下同)。5株菌株均能產生抑菌圈,其中MHT0308菌株所产生的抑菌圈最大(图1),其复筛抑菌圈直径在培养第3 d时达33.50 mm,而MHT0946菌株复筛第3 d的抑菌圈直径为24.90 mm(图2),复筛效果稍差。经对峙初筛及抑菌圈复筛两次筛选后,最终选择MHT0308菌株进行后续试验。
2. 2 MHT0308菌株继代培养结果
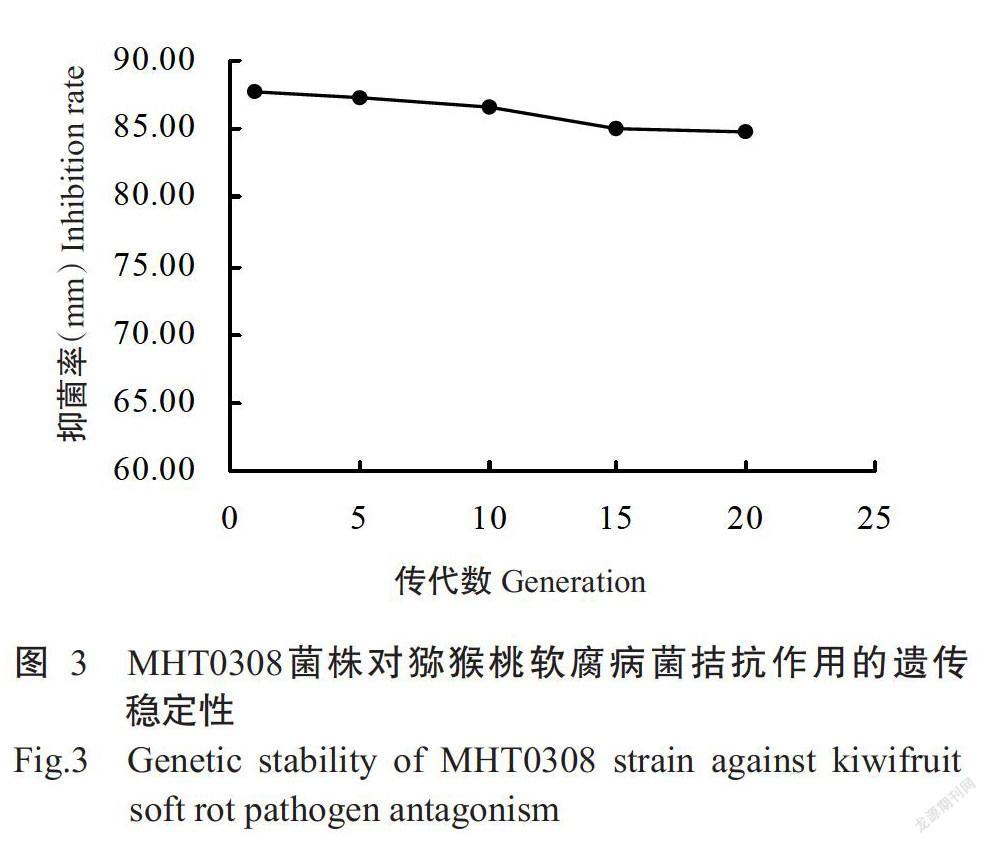
对2.1中筛选获得拮抗效果最好的MHT0308菌株进行继代培养,结果(图3)表明,MHT0308菌株子代拮抗病原菌能力在第10代之前无显著差异,其对猕猴桃软腐病的抑制率仅从第1代的87.71%变为第10代的86.64%,第15代开始对猕猴桃软腐病菌的拮抗能力稍有下降,其抑菌率为85.02%,MHT0308菌株一直继代培养至20代时仍有较强的拮抗能力,抑菌率为84.92%。试验结果表明,虽然MHT0308菌株随着继代数的增加,其拮抗能力稍有下降,但对猕猴桃软腐病菌的拮抗能力总体趋于稳定,故可判定MHT0308菌株对猕猴桃软腐病的拮抗能力遗传较稳定,有利于菌株的进一步研究和生产实践应用。
2. 3 MHT0308菌株发酵液的抑菌特性
菌落直径法测定结果(表2、图4-a和图4-b)显示,MHT0308菌株的含菌和无菌发酵液对猕猴桃软腐病菌均具有抑制作用,其中含菌发酵液的抑菌效果较好,猕猴桃软腐病菌受到明显抑制,其抑菌率为88.13%,而无菌发酵液对猕猴桃软腐病菌的抑制率也在80.00%以上。表明MHT0308菌株发酵液中产生的某些次生代谢产物具有主要抑菌活性,此特性有利于该菌株的下一步应用研发。
2. 4 MHT0308菌株发酵液对猕猴桃软腐病的离体防效
MHT0308菌株发酵液对猕猴桃软腐病的离体防效试验结果(表3和图5)表明,其发酵液对猕猴桃软腐病有明显的防治效果,喷雾MHT0308菌株发酵液后再接种猕猴桃软腐病菌处理的发病程度很轻,而未喷雾MHT0308菌株发酵液处理第3 d开始显症时,其针刺处仍然光洁无显症;第10 d未喷雾MHT0308菌株发酵液处理的病情指数达78.90,且猕猴桃果实开始从里向外软烂变色,而经MHT0308菌株发酵液处理的猕猴桃果实只有轻微显症,其病情指数仅为10.30,对猕猴桃软腐病的防效达87.00%,且经发酵液处理过的猕猴桃果实连续存放15 d以上不腐烂。可见,MHT0308菌株发酵液对猕猴桃果实软腐病有防效,可进一步研发作为猕猴桃储藏期病害的有效生防菌剂。
2. 5 MHT0308菌株鉴定结果
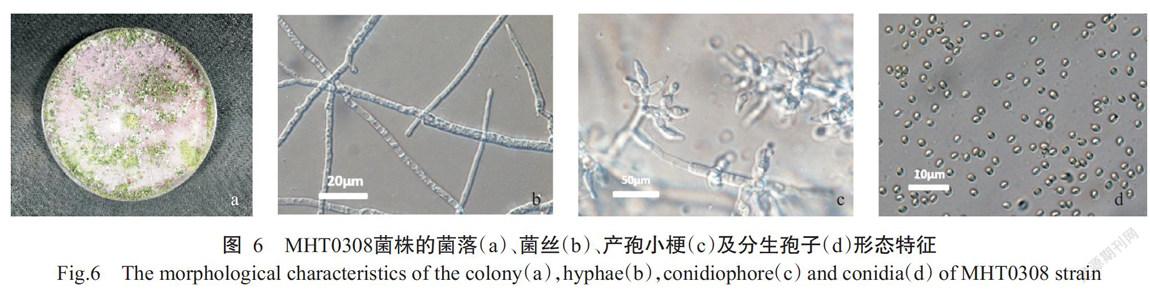
2. 5. 1 形态特征鉴定结果 MHT0308菌株在PDA培养基上菌丝呈放射状生长,其生长速度快,3 d即可长满整个培养皿,随后形成分生孢子且开始产生色素,7 d左右形成正面浅绿色至绿色的菌落,菌落背面颜色较浅,若遇胁迫可产生黄色或黄绿色色素(图6-a)。菌丝无色,有隔,可生长形成无色分生孢子梗(图6-b);其上产生产孢小梗,产孢小梗常对生或轮生形成轮枝状结构(图6-c);上着生大量分生孢子,椭圆形或卵圆形大小,2.2~3.5 μm×2.5~3.2 μm,产生初期无色,后期浅榄黄色或浅榄绿色(图6-d)。综上所述,MHT0308菌株的培养性状及形态学特征与哈茨木霉菌(Trichoderma harzianum)一致。
2. 5. 2 分子生物学鉴定结果 PCR扩增MHT0308菌株的ITS全长序列,大小为580 bp。将测序结果与GenBank中的ITS序列进行BLAST比对分析,结果表明,与其同源性最高的为木霉属的哈茨木霉真菌及其有性态(Hypocrea lixii),相似性均在99%以上。再根据ITS序列利用MEGA 5.0对同源性较高的序列进行序列分析并构建木霉属的系统发育进化树,结果(图7)显示,MHT0308菌株与哈茨木霉在同一分支。因此,根据形态学观察和分子鉴定结果可确定MHT0308菌株为哈茨木霉菌(T. harzianum)。
3 讨论
筛选有益微生物对水果等果实类采后病害进行生物防治是国内外近年来的新研究领域。研究表明,酵母菌(Pichia)对梨灰霉病(Botytis cinerea)、桃子根霉腐烂(Rhizopus oryzae)、柑橘和苹果青霉病(Penicillium sp.)等有很好的防治效果(Lu et al.,2013;Lutc et al.,2013;Xu et al.,2013);芽孢杆菌(Bacillus)对柑橘的7种不同病原真菌具有抗菌活性,且从中提取出伊草枯菌素A对柑橘采后病害有抑制效果(Arrebola et al.,2009),另外,芽孢杆菌对果实采后炭疽病和拟茎点霉软腐病、青曲霉病等有防效(Hao et al.,2011;Mohamed et al.,2011)。在前人的研究报道中,针对水果果实采后病害的生防菌资源主要集中在酵母菌和芽孢杆菌等方面,可用于果实采后病害防控的真菌类菌株资源报道相对较少。本研究以西南地区致猕猴桃软腐病的主要为害病原菌拟茎点霉菌作为靶标病原菌所筛选获得的MHT0308菌株属于哈茨木霉真菌,对丰富猕猴桃软腐病生防菌资源库及利用木霉菌防治猕猴桃软腐病具有重要意义。但介于该病害在全国范围内的致病菌差异较明显,因此下一步将开展MHT0308菌株对其他地区猕猴桃软腐致病菌的广谱拮抗试验,或在扩大所筛靶标病原菌范围的基础上找寻适用范围更广的高效生防菌株。
木霉不仅对植物病原真菌具有广谱拮抗活性,部分还兼具促进植物生长的作用(Altomare et al.,1999),同时可产生许多次生代谢产物如酶类、抗生素或抗菌肽、水溶性化合物等,对病原菌起生防作用(Howell,2002),是一类具有应用价值的有益微生物。本研究的平板对峙中MHT0308菌株对猕猴桃软腐病病原菌有明显的竞争和拮抗作用,且其含菌和无菌发酵液对猕猴桃软腐病菌均有抑制作用,说明该菌株可产生具有抑菌活性的物质。张承等(2016)发现采前喷施壳聚糖与生防菌代谢产物抗菌肽等制成的復合膜对猕猴桃软腐病的防效达69.23%,提高了果实的抗病性,从而提高了猕猴桃耐贮性。结合MHT0308菌株可产生有效次生代谢产物这一特征,后续将进一步重点研究该菌株的抗菌活性物质,并对抑菌活性物质的有效应用及果实绿色保鲜技术进行探索,从而为利用该菌开发新的生物农药提供理论指导。
4 结论
筛选出一株对拟茎点霉菌引起的猕猴桃软腐病有较强抑制作用的菌株MHT0308,根据其形态学特征结合分子生物学鉴定结果,确定MHT0308菌株为哈茨木霉菌(T. harzianum),该菌株对猕猴桃软腐病有较好的防治效果,可作为一种重要的生防资源菌用于猕猴桃软腐病防治研究,具有一定的开发潜力。
致谢: 本文在猕猴桃软腐病病原菌材料方面得到贵州省农业科学院植物保护研究所吴石平老师和黄露老师的大力支持,特此致谢!
参考文献:
何应红,钱一鑫,康冀川,雷帮星. 2016. 猕猴桃病原真菌拮抗菌筛选[J]. 山地农业生物学报,35(2):68-72. [He Y H,Qian Y X,Kang J C,Lei B X. 2016. Screening of antagonistic fungi against pathogenic fungi of kiwifruit and determination of its antimicrobial activity[J]. Journal of Mountain Agriculture and Biology,35(2):68-72.]
胡容平,石军,林立金,叶慧丽,姚琳,周游. 2017. 四川猕猴桃软腐病防治初步研究[J]. 西南农业学报, 30(2): 366-370. [Hu R P,Shi J,Lin L J,Ye H L,Yao L,Zhou Y. 2017. Preliminary study on control efficiency against soft rot disease of kiwifruit in Sichuan[J]. Southwest China Journal of Agricultural Sciences, 30(2): 366-370.]
李黎,陈美艳,张鹏,韩飞,刘小莉,钟彩虹. 2016. 猕猴桃软腐病的病原菌鉴定[J]. 植物保护学报,43(3): 527-528. [Li L,Chen M Y,Zhang P,Han F,Liu X L,Zhong C H. 2016. Identification of the pathogen causing fruit soft rot on kiwifruit[J]. Journal of Plant Protection,43(3): 527-528.]
梁建根,竺利红,吴吉安,桑金隆,姚杭丽,施跃峰. 2007. 生防菌株B-3对辣椒枯萎病的防治及其鉴定[J]. 植物保护学报,34(5): 529-533. [Liang J G,Zhu L H,Wu J A,Sang J L,Yao H L,Shi Y F. 2007. Control efficacy of biocontrol strain B-3 against pepper wilt and its identification[J]. Journal of Plant Protection,34(5): 529-533.]
马松涛,宋晓斌,张学武,刘艳玲. 2000. 猕猴桃花果病害研究现状及趋势[J]. 西北林学院学报,15(3): 86-89. [Ma S T,Song X B,Zhang X W,Liu Y L. 2000. Present situation and trend of the researches on flower and fruit di-seases of kiwifruit[J]. Journal of Northwest Forestry University,15(3): 86-89.]
Mohamed S O,Dharini S,Lise K. 2011. 生物抑制剂解淀粉芽孢杆菌结合1-甲基环丙烯处理在果实采后病害控制及品质保持中的作用效果[J]. 保鲜与加工,(2):56. [Mohamed S O,Dharini S,Lise K. 2011. Effects of Bacillus amyloliquefaciens combining 1-methyl propylene on di-sease control and fruit quality maintaining of fuits post harvest[J]. Preservation and Processing,(2):56.]
王小洁,李士谣,李亚巍,何容,朱立武,刘普. 2017. 猕猴桃软腐病病原菌的分离鉴定及其防治药剂筛选[J]. 植物保护学报,44(5): 125-131. [Wang X J,Li S Y,Li Y W,He R,Zhu L W,Liu P. 2017. Pathogen identification of kiwifruit soft rot and fungicide screening for control of the disease[J]. Journal of Plant Pathology,44(5):125-131.]
吴文能,张起,雷霁卿,黄亚欣,陈晨蕰,王瑞,曹森. 2018. “贵长”猕猴桃软腐病病原菌分离鉴定及抑菌药剂筛选[J]. 北方园艺,(16): 47-54. [Wu W N,Zhang Q,Lei J Q,Huang Y X,Chen C Y,Wang R,Cao S. 2018. Identification and pharmaceutical screening of kiwifruit soft rot disease on ‘Guichang’ gooseberry[J]. Northern Horticulture,(16): 47-54.]
楊宗正. 2018. 水果之王猕猴桃[J]. 东方药膳,(10): 47-48. [Yang Z Z. 2018. King of fruit:Kiwifruit[J]. Oriental Me-dicated Diet,(10): 47-48.]
余桂萍,周洪旗. 2009. 猕猴桃软腐病的发生规律与防治初探[J]. 资源开发与市场, 25(5): 392-393. [Yu G P,Zhou H Q. 2009. Study on occurrence rule and control technology of soft rot of kiwi fruit[J]. Resource Development & Mar-ket, 25(5): 392-393.]
张承,李明,龙友华,吴小毛. 2016. 采前喷施壳聚糖复合膜对猕猴桃软腐病的防控及其保鲜作用[J]. 食品科学, 37(22): 274-281. [Zhang C,Li M,Long Y H,Wu X M. 2016. Control of soft rot in kiwifruit by pre-harvest application of chitosan composite coating and its effect on preserving and improving kiwifruit quality[J]. Food Science, 37(22): 274-281.]
Altomare C,Norvell W A,Bjorkman T,Harman G E. 1999. Solubilization of phosphate and micronutrients by the plant-growth promoting and biocontrol fungus Trichoderma harzianum Rifai 1295-22[J]. Applied and Environmental Microbiology,65(7): 2926-2933.
Arrebola E,Jacobs R,Korsten L. 2009. Iturin A is the principal inhibitor in the biocontrol activity of Bacillus amyloliquefaciens PPCB004 against postharvest fungal pathogens[J]. Journal of Applied Microbiology,9:15.
Dodd S L,Hill R A, Steward A. 2004. Monitoring the survival and spread of the biocontrol fungus Trichoderma atroviride(c65) on kiwifruit using a molecular marker[J]. Austra-lasian Plant Pathology, 33(2): 189-196.
Hao W N,Li H,Hu M Y,Yang L,Rizwan-ul-Haq M. 2011. Integrated control of citrus green and blue mold and sour rot by Bacillus amyloliquefaciens in combination with tea saponin[J]. Postharvest Biology and Technology,59: 316-323.
Howell C R. 2002. Cotton seedling preemergence damping-off incited by Rhizopus oryzae and Pythium spp. and its biological control with Trichoderma spp.[J]. Phytopatho-logy,92:177-180.
Kim G H,Koh Y J,Jung J S,Hur J S. 2015. Control of postharvest fruit rot diseases of kiwifruit by antagonistic bacterium Bacillus subtilis[J]. Acta Horticulturae,1096: 377-382.
Lu L F,Ye C Z,Guo S H,Sheng K,Shao L X,Zhou T,Yu T,Zheng X D. 2013. Preharvest application of antagonistic yeast Rhodosporidium paludigenum induced resistance against postharvest diseases in mandarin orange[J]. Biological Control,67(2): 130-136.
Luongo L,Santori A,Riccioni L,Belisario A. 2011. Phomopis sp. associated with post-harvest fruit rot of kiwifruit in Italy[J]. Journal of Plant Pathology,93(1): 205-209.
Lutc M C,Lopes C A,Rodriguez M E,Sosa M C,Sangorrín,Marcela P. 2013. Efficacy and putative mode of action of native and commercial antagonistic yeasts against postharvest pathogens of pear[J]. International Journal of Food Microbiology,164(2/3): 166-172.
White T J,Bruns T D,Lee S B. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A,Gelfand D H,Sninsky J J,White T J . PCR protocols: A guide to methods and applications. San Diego: Acad Press: 315-322.
Xu B T,Zhang H Y,Chen K P,Xu Q,Yao Y,Gao H. 2013. Biocontrol of postharvest Rhizopus decay of peaches with Pichia caribbica[J]. Current Microbiology,67(2): 255-261.
Zhou Y,Gong G S,Cui Y L,Zhang D X,Chang X L,Hu R P,Liu N,Sun X F. 2015. Identification of Botryosphaeriaceae species causing kiwifruit rot in Sichuan Province,China[J]. Plant Disease,99(5): 699-708.
(責任编辑 麻小燕)

