急性氨氮胁迫对翘嘴鳜幼鱼抗氧化酶活性及炎症反应相关基因表达的影响
刘雨 丁炜东 曹哲明 邴旭文 徐畅 杨帆 张晨光 谷心池 孙阿君








摘要:【目的】從抗氧化酶活性和炎症反应相关基因表达水平揭示氨氮胁迫对翘嘴鳜(Siniperca chuatsi)幼鱼机体的毒性效应机制,为其健康养殖与水质调控管理提供科学依据。【方法】挑选规格整齐、体表无损伤的翘嘴鳜幼鱼进行96 h急性氨氮胁迫试验,在获得半致死浓度(LC50)的基础上,将翘嘴鳜幼鱼暴露于48.65 mg/L的水体氨氮下,以完全曝气的自来水(氨氮实测值为0.05 mg/L)为对照组,分别于胁迫0、6、12、24、48和96 h后测定抗氧化酶活性及炎症反应相关基因的相对表达量。【结果】翘嘴鳜幼鱼的96 h-LC50为48.65 mg/L(非离子氨0.47 mg/L)。翘嘴鳜幼鱼在96 h的急性氨氮胁迫过程中,其肝脏超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性和谷胱甘肽(GSH)含量均呈先升高后降低的变化趋势;脂质过氧化物(LPO)在肝脏中的累积量随胁迫时间的延长逐渐增加,至胁迫96 h时达最高值(0.50 μmol/g),显著高于对照组(P<0.05,下同)。与对照组翘嘴鳜幼鱼相比,经氨氮胁迫后翘嘴鳜幼鱼肝脏IL-1β和IL-8基因的相对表达量均呈升高—降低—升高的变化趋势,于胁迫6 h起显著上调,分别于胁迫12和96 h时达最高值;TNF-α基因的相对表达量整体上呈先降低后升高的变化趋势,在胁迫6 h时显著低于对照组,但至胁迫96 h时其相对表达量达最高值;IL-1β、IL-8和TNF-α基因的相对表达量在胁迫96 h时均显著高于对照组;HSP90α基因的相对表达量呈先升高后降低的变化趋势,至胁迫96 h时,其相对表达量显著低于对照组。【结论】氨氮胁迫初期,翘嘴鳜幼鱼抗氧化系统被诱导激活,炎症反应相关基因表达上调;至胁迫后期,翘嘴鳜幼鱼抗氧化功能受抑制,而炎症反应相关基因表达持续上调。说明持续炎症反应及抗氧化系统功能受抑制是翘嘴鳜氨氮中毒死亡的主要原因。
关键词: 翘嘴鳜;氨氮胁迫;抗氧化酶;炎症反应相关基因;96 h半致死浓度(96 h-LC50)
中图分类号: S965.127 文献标志码: A 文章编号:2095-1191(2019)08-1860-09
Effects of acute ammonia nitrogen stress on antioxidant enzymes activity and gene expression involved in inflammation
of juvenile Siniperca chuatsi
LIU Yu1, DING Wei-dong2, CAO Zhe-ming2, BING Xu-wen2*, XU Chang1,2,
YANG Fan1,2, ZHANG Chen-guang1,2, GU Xin-chi1, SUN A-jun2
(1Wuxi Fisheries College,Nanjing Agricultural University,Wuxi, Jiangsu 214081,China; 2Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi, Jiangsu 214081, China)
Abstract:【Objective】In this study, antioxidant enzyme activity and expression level of genes involved in inflammation were studied to reveal the toxicity mechanism of juvenile Siniperca chuatsi under ammonia nitrogen stress to provide scientific basis for healthy breeding and water quality control management. 【Method】Undamaged juvenile S. chuatsi similar to each other in size were selected for 96 h acute ammonia nitrogen stress experiments. Using the obtained half lethal concentration(LC50) of ammonia-nitrogen in S. chuatsi as a basic concentration,the juvenile S. chuatsi were exposed to 48.65 mg/L concentration of ammonia nitrogen in water for 96 h. Fully aerated tap water(measured ammonia nitrogen value was 0.05 mg/L) was as control group. The activity of antioxidant enzymes and the expression of genes involved in inflammation were measured at 0, 6, 12, 24, 48 and 96 h respectively after stress. 【Result】The 96 h-LC50 of juvenile S. chuatsi was 48.65 mg/L(nonionic ammonia 0.47 mg/L). In this study, the superoxide dismutase(SOD) activity, catalase (CAT) activity and glutathione(GSH) content in the liver of the experimental group have a tendency of increasing first and then decreasing. The accumulation of lipid peroxide(LPO) in liver increased gradually with the prolongation of stress time, and reached the maximum value at 96 h(0.50 μmol/g), which was significantly higher than the control group(P<0.05, the same below). Compared with control group, the relative expression of IL-1β and IL-8 genes in the liver of juvenile S. chuatsi presented up-down-up trend after ammonia nitrogen stress, and was significantly increased after 6 h stress, and peaked at 12 and 96 h after stress. The relative expression of TNF-α gene presented down-up trend as a whole, and was significantly lower than control after 6 h of stress, and reached the peak at 96 h. At 96 h of stress effect, the relative expressions of IL-1β and IL-8, TNF-α genes were all significantly higher than that of the control group. There was a tendency of increasing first then decreasing in the relative expression of HSP90α gene. After 96 h of stress effect, the relative expression of HSP90α gene was significantly lower than that of the control group. 【Conclusion】In the early stage of stress, the antioxidant system of juvenile S. chuatsi is induced to activation and the relative expression of inflammation-related genes up-regulates. However, in the late stage of stress, antioxidant function is inhibited and the relative expression of inflammation-related genes continue up-regulating. It is suggested that continuous inflammatory reaction and inhibition of antioxidant system may lead to the death of S. chuatsi exposed to ammonia nitrogen.
Key words: Siniperca chuatsi; ammonia nitrogen stress; antioxidant enzymes; inflammation-related genes; 96 h half lethal concentration(96 h-LC50)
0 引言
【研究意义】水体中的氨氮构成主要包括离子氨(NH4+)和非离子氨(NH3)两种形式,且主要来源于食物残渣、动植物生长代谢及死亡个体分解等(徐杨等,2015)。氨氮主要是以NH3的形式经鱼鳃、表皮和肠黏膜等组织进入鱼体,氨氮中毒会导致鱼类生长速度迟缓、免疫水平低下,同时伴有氧化应激和炎症反应的发生,进一步诱发各种疾病(章琼等,2015;付莹和赵玉蓉,2018)。因此,探究氨氮对鱼类的毒性效应与耐受限度,分析氨氮胁迫下鱼类的生理生化指标及相关基因的表达变化规律,对揭示氨氮胁迫对鱼类的毒性作用机制具有重要意义。【前人研究进展】随着生物体内氨氮含量的升高,不仅导致脑肿胀,还能诱导生成具有神经毒性的NO(Veauvy et al.,2005)。NO促使机体产生氧化应激,同时生成对机体危害性更强的NO2,进而引发机体细胞呼吸障碍,诱导细胞凋亡(Rodrigo et al.,2009;Braissant et al.,2013)。黄云(2013)、刘永波和王雅倩(2016)研究表明,氨氮胁迫下鱼类出现生长停滞、免疫水平低下甚至大批量死亡现象。Zhang等(2018)研究发现,黄颡鱼(Pelteobagrus fulvidraco)在氨氮中毒的情况下其肝脏抗氧化与炎症反应相关基因表达水平均显著上调。此外,大量研究表明暴露于高浓度氨氮环境中的鱼类出现不同程度肝脏细胞肿大或空泡化等损伤坏死现象(Sitp-Bobadilla and Alvarez-Pellitero,2009;张武肖等,2015),严重影响肝脏的生理机能。在罗非鱼(Oreochroms mossambcus)(强俊等,2011)、鲤鱼(Cyprinus carpio)(姜会民,2012)、草鱼(Grass carp)(周鑫等,2013)、斑马鱼(Danio rerio)(周莹等,2016)、尖吻鲈(Latescal carifer)(刘亚娟等,2018)的相关研究中均发现氨氮胁迫能诱导抗氧化相关酶活性呈规律性变化,整体上表现为低浓度诱导、高浓度抑制。【本研究切入点】翘嘴鳜(Siniperca chuatsi)隶属于鲈形目(Perciformes)真鲈科(Percichthyidae)鳜属(Siniperca),为凶猛的肉食性鱼类,具有肉质鲜美、高蛋白低脂肪等特点,是营养价值极高的特种水产经济动物(吴斌等,2015;颜元杰等,2019)。近年来,翘嘴鳜野生资源锐减与优质鱼类蛋白需求剧增间的矛盾不断扩大,促使翘嘴鳜规模化养殖得到快速发展,因此如何科学调控翘嘴鳜养殖水体氨氮水平已成为健康养殖管理的重点内容之一。【拟解决的关键问题】探究急性氨氮胁迫下翘嘴鳜幼鱼的抗氧化酶活性及炎症反应相关基因的表达变化规律,从酶活性和基因表达水平揭示氨氮胁迫对翘嘴鳜幼鱼机体的毒性效应机制,为其健康养殖与水质调控管理提供科學依据。
1 材料与方法
1. 1 试验用鱼
翘嘴鳜幼鱼取自南京农业大学无锡渔业学院南泉养殖基地,暂养于室内控温循环水养殖系统(400 L/桶)。选取体表无损伤、规格整齐的翘嘴鳜幼鱼300尾,试验开始前在室内控温循环水养殖系统暂养14 d,暂养期间保持自然光照周期,暂养水体条件:溶氧≥6 mg/L、氨氮≤0.05 mg/L、水温(22±0.5)℃、pH 7.8±0.5。暂养期间以1~2 g/尾的鳊鱼幼鱼为饵料,每2 d投放1次,投喂量为翘嘴鳜体重的2倍。
1. 2 氨氮胁迫96 h半致死浓度(96 h-LC50)测试
于室内控温循环水系统暂养14 d后,选取规格整齐的翘嘴鳜幼鱼120尾(13.55±0.69 g/尾)进行半致死浓度(LC50)测试。设0、30、60和90 mg/L NH4Cl四个梯度浓度,每组浓度3个平行,每个平行放10尾幼鱼。在96 h观测期间保持水体静止,停止进食,持续充氧[溶解氧(DO)=6.28±0.10 mg/L],水温(22±0.5)℃,pH 7.6±0.3,每隔8 h使用W-1型多参数水质分析仪(杭州陆恒生物科技有限公司)检测水体氨氮浓度,以10 g/L NH4Cl母液调整至试验设计的氨氮浓度,每隔24 h换水1/4。观测翘嘴鳜幼鱼的活动变化情况,计数并捞出死亡个体(鱼体侧翻且鳃盖停止扇动视为死亡)。
1. 3 试验设计与样品采集
暂养结束后,依据96 h-LC50设对照组(0 mg/L)和试验组(48.65 mg/L),选取体质量相近、活性良好的翘嘴鳜幼鱼180尾(13.31±0.49 g/尾)随机平均放入6个400 L养殖桶中(试验组和对照组各设3个平行),每桶30尾鱼。对照组为完全曝气的自来水(氨氮实测值为0.05 mg/L)。氨氮胁迫时长为96 h,期间保持水体静止,停止进食,持续充氧(DO=6.13±0.12 mg/L),水温(22±0.5)℃,pH 7.7±0.5,每隔8 h使用W-1型多参数水质分析仪检测水体氨氮浓度,以10 g/L NH4Cl母液调整至试验设计的氨氮浓度,每隔24 h换水1/4。在氨氮胁迫0、6、12、24、48和96 h时,每桶分别随机选择3尾翘嘴鳜并用50 mg/L MS-222进行轻度麻醉,采集幼鱼活体的肝脏用生理盐水漂洗,液氮速冻后-80 ℃保存备用。
1. 4 总RNA提取与实时荧光定量PCR检测
采用宋美泽等(2018)的方法提取肝脏总RNA,即采用北京康为世纪生物科技有限公司提供的RNApure Tissue Kit试剂盒进行提取,然后使用HIFIscript cDNA Synthesis Kit试剂盒反转录合成cDNA。基于NCBI数据库获得的IL-1β、IL-8、HSP90α和TNF-α基因开放阅读框序列,以β-actin为管家基因,在NCBI数据库的Primer-BLAST程序中完成引物设计,委托生工生物工程(上海)股份有限公司合成,引物序列见表1。实时荧光定量PCR反应体系20.0 μL:2×UltraSYBR Mixture 10.0 μL,上、下游各0.4 μL,cDNA模板0.8 μL,ddH2O 8.4 μL。扩增程序:95 ℃预变性10 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 32 s,进行39个循环;60 ℃ 30 s,95 ℃ 15 s。采用2-△△Ct法计算目的基因相对表达量。
1. 5 抗氧化酶活性检测
过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、脂质过氧化物(LPO)检测试剂盒购自南京建成生物工程研究所。取0.1 g肝脏样品加入9倍体积的预冷生理盐水,研磨成组织匀浆,4 ℃下3000 r/min离心10 min,制备待测样本,然后按试剂盒说明进行操作,以BioTek EonTM微孔板分光光度计进行检测读数。
1. 6 统计分析
翘嘴鳜幼鱼96 h-LC50分析采用直线内插法,以SPSS 20.0进行统计分析,包括单因素方差分析(One-way ANOVA)和Duncan’s多重比较。
2 结果与分析
2. 1 翘嘴鳜幼鱼96 h-LC50测定结果
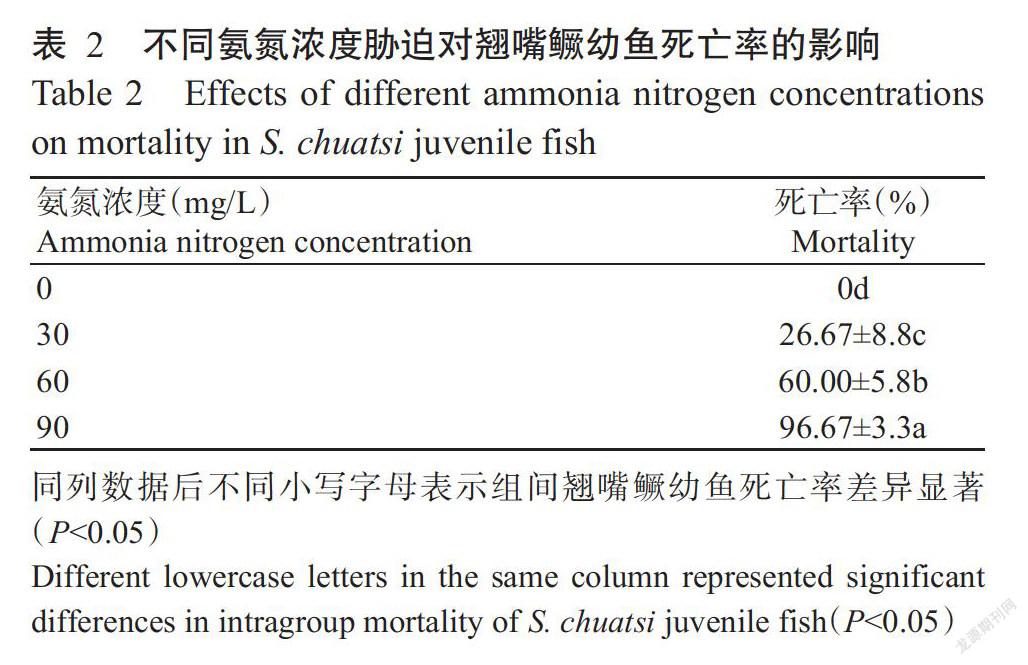
翘嘴鳜幼鱼暴露于不同氨氮梯度浓度水体后均出现躁动不安、四处游动的应激反应,且应激反应时间及程度随氨氮浓度的升高而加剧。氨氮胁迫后期,翘嘴鳜幼鱼尾鳍不同程度地向内侧弓起,尤其在90 mg/L NH4Cl试验组中尾鳍与身体几乎成直角,鱼体游动迟缓,对应的死亡率(96.67%)(表2)也显著高于其他处理组(P<0.05,下同)。氨氮胁迫96 h后统计死亡的翘嘴鳜幼鱼个体,通过直线内插法计算得出翘嘴鳜幼鱼的96 h-LC50为48.65 mg/L(非离子氨0.47 mg/L)。
2. 2 急性氨氮胁迫对翘嘴鳜幼鱼肝脏抗氧化相关酶活性的影响
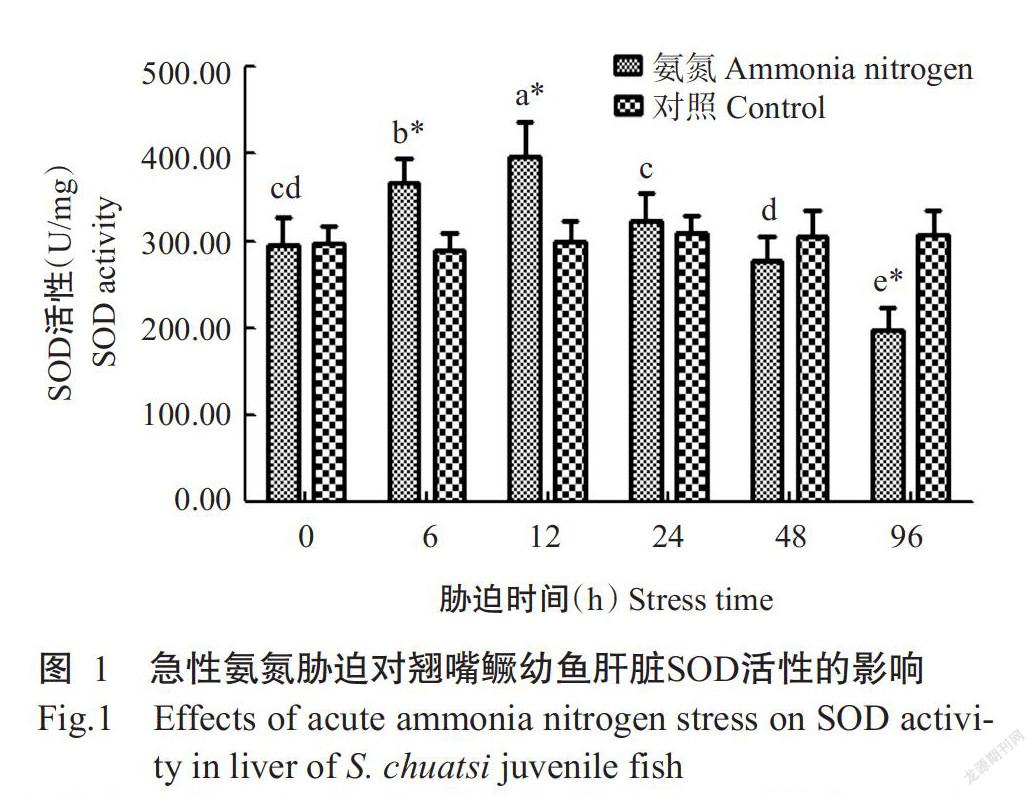
2. 2. 1 SOD活性 如图1所示,对照组翘嘴鳜幼鱼肝脏SOD活性无显著变化(P>0.05,下同),试验组翘嘴鳜幼鱼在96 h的急性氨氮胁迫过程中其肝脏SOD活性呈先升高后降低的变化趋势。氨氮胁迫6 h时,试验组翘嘴鳜幼鱼肝脏SOD活性显著升高,至胁迫12 h时肝脏SOD活性达最高值(396.00 U/mg),是对照组翘嘴鳜幼鱼的1.34倍,随后呈明显的下降趋势,至胁迫96 h时已显著低于对照组。
2. 2. 2 CAT活性 如图2所示,对照组翘嘴鳜幼鱼肝脏CAT活性无显著变化,试验组翘嘴鳜幼鱼在96 h的急性氨氮胁迫过程中其肝脏CAT活性呈降低—升高—降低的变化趋势。氨氮胁迫6 h时,试验组翘嘴鳜幼鱼肝脏CAT活性与对照组无显著差异,但胁迫12 h时试验组翘嘴鳜幼鱼肝脏CAT活性显著高于对照组,且呈持续升高趋势;至胁迫48 h时肝脏CAT活性达最高值(77.09 U/mg),是对照组的1.75倍,随后开始下降,至胁迫96 h时试验组翘嘴鳜幼鱼肝脏CAT活性仍显著高于对照组。
2. 2. 3 GSH含量 如图3所示,对照组翘嘴鳜幼鱼肝脏GSH含量无显著变化,试验组翘嘴鳜幼鱼在96 h的急性氨氮胁迫过程中其肝脏GSH含量变化趋势与CAT活性相似。氨氮胁迫12 h时,试验组翘嘴鳜幼鱼肝脏GSH含量显著高于对照组,且呈持续升高趋势;胁迫至24 h时肝脏GSH含量达最高值(88.84 μmol/g),是对照组的1.57倍,随后开始下降,至胁迫96 h时试验组翘嘴鳜幼鱼肝脏GSH含量显著低于对照组。
2. 2. 4 LPO含量 如图4所示,对照组翘嘴鳜幼鱼肝脏LPO含量无显著变化,试验组翘嘴鳜幼鱼在96 h的急性氨氮胁迫过程中其肝脏LPO含量整体上呈逐渐升高趋势。氨氮胁迫12 h时,试验组翘嘴鳜幼鱼肝脏LPO含量显著高于对照组,随后肝脏LPO含量持续升高,至胁迫96 h时达最大值(0.50 μmol/g),是对照组的3.77倍。
2. 3 急性氨氮脅迫对翘嘴鳜幼鱼炎症反应相关基因表达的影响
2. 3. 1 IL-1β基因 在96 h的急性氨氮胁迫过程中,试验组翘嘴鳜幼鱼肝脏IL-1β基因的相对表达量呈升高—降低—升高的变化趋势(图5)。氨氮胁迫12 h时,试验组翘嘴鳜幼鱼肝脏IL-1β基因的相对表达量达最高值,随后呈下降趋势,至胁迫96 h时肝脏IL-1β基因的相对表达量再次上调;从氨氮胁迫6 h起,试验组翘嘴鳜幼鱼肝脏IL-1β基因的相对表达量均显著高于对照组。
2. 3. 2 IL-8基因 如图6所示,对照组翘嘴鳜幼鱼肝脏IL-8基因的相对表达量无显著变化,而试验组翘嘴鳜幼鱼肝脏IL-8基因的相对表达量在急性氨氮胁迫过程中呈明显升高—降低—升高的变化趋势。氨氮胁迫12 h时,试验组翘嘴鳜幼鱼肝脏IL-8基因的相对表达量出现第一个峰值,但至胁迫24 h时肝脏IL-8基因的相对表达量降至最低值,显著低于对照组,随后再次上调,至胁迫96 h时肝脏IL-8基因的相对表达量上调至最高值,是对照组的1.71倍。
2. 3. 3 TNF-α基因 在96 h的急性氨氮胁迫过程中,试验组翘嘴鳜幼鱼肝脏TNF-α基因的相对表达量整体上呈先降低后升高的变化趋势(图7)。氨氮胁迫6 h时,试验组翘嘴鳜幼鱼肝脏TNF-α基因的相对表达量下调,显著低于对照组,随后肝脏TNF-α基因的相对表达量呈逐渐上调趋势,至胁迫96 h时其相对表达量上调至最高值,是对照组的1.63倍。
2. 3. 4 HSP90α基因 在96 h的急性氨氮胁迫过程中,试验组翘嘴鳜幼鱼肝脏HSP90α基因的相对表达量呈先升高后降低的变化趋势(图8)。氨氮胁迫6 h时,试验组翘嘴鳜幼鱼肝脏HSP90α基因的相对表达量显著上调,至胁迫12 h时其相对表达量上调至最高值,是对照组的4.08倍;随后开始逐渐下调,至胁迫96 h时翘嘴鳜幼鱼肝脏HSP90α基因的相对表达量显著低于对照组。
3 讨论
3. 1 急性氨氮胁迫对翘嘴鳜幼鱼的毒性效应
氨氮是养殖水质检测的重要指标之一,氨氮水平升高会对养殖鱼类造成生长抑制、代谢紊乱、组织损伤及免疫力低下等不良影响,甚至造成鱼类死亡(付莹和赵玉蓉,2018)。不同鱼类对氨氮暴露胁迫的耐受上限存在明显差异,斜带石斑鱼(Epinephelus coioides)幼鱼的96 h-LC50为5.13 mg/L(郑乐云,2012),大黄鱼(Pseudosciaena crocea)幼鱼的96 h-LC50为1.25 mg/L(阮成旭等,2014),团头鲂幼鱼的96 h-LC50为56.49 mg/L(张武肖等,2015),鲫鱼幼鱼的96 h-LC50为0.73 mg/L(Wang et al.,2017),大弹涂鱼(Boleophthalmus pectinirostris)幼鱼的96 h-LC50为8.99 mg/L(宋美泽等,2018)。本研究结果表明,翘嘴鳜幼鱼的96 h-LC50为48.65 mg/L(非离子氨0.47 mg/L),与团头鲂幼鱼(张武肖等,2015)相近,但高于斜带石斑鱼(郑乐云,2012)、大黄鱼(阮成旭等,2014)、鲫鱼(Wang et al.,2017)和大弹涂鱼(宋美泽等,2018)的幼鱼。翘嘴鳜幼鱼的氨氮耐受程度较高,可能与其肉食性且栖于水体底层的生活习性有关。鱼体规格差异也可能导致其氨氮耐受限度不同。刘建魁等(2014)、李之乡等(2017)在史氏鲟(Acipenser schrencki)幼鱼和大菱鲆(Scophthalmus maximus)幼鱼的氨氮毒性研究中发现,96 h-LC50与幼鱼的体质量呈正相关。本研究检测的翘嘴鳜幼鱼体质量为13.55±0.69 g/尾,可能是导致其96 h-LC50较高的原因之一,但具体原因尚有待进一步探究。
3. 2 急性氨氮胁迫对翘嘴鳜幼鱼肝脏抗氧化相关酶活性的影响
在良好的水质环境中,鱼类体内抗氧化系统可有效清除生理代谢活动生成的活性氧自由基(ROS)。当水体中氨氮浓度升高时,鱼体内发生一系列应激反应而产生大量ROS,当ROS含量超出抗氧化系统的调节阈值时,机体即出现氧化损伤,甚至死亡(胡静等,2016)。SOD、CAT和GSH等是机体抗氧化系统的重要组成部分,抗氧化系统通过三者的协同作用以降低氧化应激所造成的损伤(陶易凡等,2016)。本研究结果表明,抗氧化酶SOD、CAT活性和抗氧化物质GSH含量在急性氨氮胁迫过程中均呈先升高后降低的变化趋势。氨氮胁迫12 h时,翘嘴鳜幼鱼肝脏SOD和CAT活性及GSH含量升高,且均显著高于对照组,说明氨氮胁迫初期水质环境中其含量变化引起翘嘴鳜幼鱼体内的ROS含量增加,诱导SOD、CAT活性和GSH含量升高,提高机体的抗氧化防御能力而及时清除过多的ROS,以维持代谢平衡;胁迫24 h后,翘嘴鳜幼鱼肝脏SOD活性和GSH含量出现下降趋势,胁迫48 h后CAT活性也开始回落,至胁迫96 h时翘嘴鳜幼鱼肝脏SOD活性和GSH含量均显著低于对照组,可能是随着氨氮胁迫时间的延长,鱼体内ROS含量已超出抗氧化系统调节阈值,肝脏组织受到氨氮毒性影响,而抑制抗氧化酶活性及抗氧化物质合成,抗氧化功能被削弱,与胡毅等(2012)、Jia等(2017)的研究报道一致。在本研究中,SOD、CAT和GSH三者具有协同作用,但对急性氨氮胁迫的应激响应速度并未同步,可能与三者在氧化应激防御体系中所承担的功能不同有关。
LPO是ROS作用于脂质过氧化反应中产生的细胞毒性物质,其含量能反映机体脂质过氧化水平和细胞损伤程度,同时间接反映机体的ROS含量(何吉祥等,2016;祁红学等,2017)。本研究结果表明,氨氮胁迫6 h时,翘嘴鳜幼鱼肝脏LPO含量与对照组无显著差异,说明在氨氮胁迫初期,SOD、CAT活性和GSH含量显著上升,机体内的氧化自由基能被及时清除;氨氮胁迫48 h后,翘嘴鳜幼鱼肝脏LPO含量急剧上升,说明随着氨氮胁迫时间的延长,鱼体内ROS含量急剧上升,同时SOD活性与GSH含量显著低于对照组,即抗氧化系统受到严重损伤,导致LPO含量急剧增加。
3. 3 急性氨氮胁迫对翘嘴鳜幼鱼肝脏炎症反应相关基因表达的影响
随着机体内氨氮浓度不断升高,鱼类常出现生长迟缓、肝脏病变及免疫水平降低等不良反应;同时,高浓度氨氮能突破血脑屏障,导致神经胶质细胞肿大,激活N-甲基-D天冬氨酸受体而诱发氧化应激、炎症反应及细胞凋亡(Zhang et al.,2018)。Qi等(2017)研究发现,长期低浓度的氨氮胁迫可诱导鲤鱼炎症反应相关基因(TNF-α和IL-1β)的表达。本研究结果表明,氨氮胁迫6 h后,翘嘴鳜幼鱼肝脏IL-1β和IL-8基因的相对表达量显著上调,说明胁迫初期在外源性氨氮的毒性作用下,鱼体代谢平衡受到干扰并产生毒性兴奋效应,在机体内环境稳态调节机制启动抗氧化防御及一系列修复机制的同时,上调炎症反应相关基因表达(Xing et al.,2016);但胁迫12~24 h期間,翘嘴鳜幼鱼肝脏IL-1β、IL-8和TNF-α基因的相对表达量均呈下调趋势,说明炎症反应相关基因大量表达并招募白细胞以应对胁迫时,为避免持续的炎症反应错误破坏正常组织器官生理代谢平衡,鱼体能适时调控炎症反应相关基因的表达(Li et al.,2016),与宋美泽等(2018)的研究结论一致;但胁迫48 h后,翘嘴鳜幼鱼肝脏IL-1β、IL-8和TNF-α基因的相对表达量再次显著上调,可能与过度氨氮暴露导致的ROS与炎症因子累积有关,与Cheng等(2015)的研究报道一致。Chandra等(2000)研究指出,虽然机体生理调节机制能修复应激损伤,但应激水平超过调节阈值时,将诱发代谢紊乱及细胞凋亡等不良反应。持续氨氮胁迫导致氧化应激产生的大量ROS不仅诱导细胞凋亡,还能引发炎症反应,激活NF-κB信号通路,诱导表达一系列炎症反应相关基因,诱发线粒体自噬与细胞凋亡进而应激致死(Ai et al.,2011;Jia et al.,2014)。
热休克蛋白(HSPs)是生物体在应激条件下产生具有抗逆性的应激蛋白(金晔等,2018),其中,HSP90α在多种胁迫条件下均能诱导表达,因此常作为评估生物应激水平的生物标志物(刘童,2015;贾利兴,2016)。本研究结果表明,氨氮胁迫6 h时,翘嘴鳜幼鱼肝脏HSP90α基因的相对表达量显著上调,提示机体的氧化应激和炎症反应水平不断升高,而诱导HSP90α基因表达上调以修复受损细胞与变性蛋白;至胁迫12 h时其相对表达量上调至最高值,随后HSP90α基因的相对表达量持续下调,可能与机体的氧化应激和炎症反应进一步加剧且超出机体调节阈值有关。过度的氧化应激与炎症因子积累可能导致机体免疫水平下降及新陈代谢紊乱,进而导致HSP90α基因的相对表达量下调,机体自我修复功能下降,与王芸等(2013)的研究结论一致。
4 结论
氨氮胁迫初期,翘嘴鳜幼鱼抗氧化系统被诱导激活,炎症反应相关基因表达上调;至胁迫后期,翘嘴鳜幼鱼抗氧化功能受抑制,而炎症反应相关基因表达持续上调。说明持续炎症反应及抗氧化系统功能受抑制是翘嘴鳜氨氮中毒死亡的主要原因。
参考文献:
付莹,赵玉蓉. 2018. 氨氮对鱼类的毒性及鱼类应对氨氮毒性的策略[J]. 水产学杂志,31(3):49-54. [Fu Y,Zhao Y R. 2018. A Review:Toxicity of ammonia and detoxification of ammonia in fish[J]. Chinese Journal of Fisheries,31(3):49-54.]
何吉祥,潘庭双,蒋阳阳,吴明林,陈静,武松,崔凯. 2016. 饲料糖蛋白质比和投喂率对异育银鲫生长及脂质代谢指标的影响[J]. 上海海洋大学学报,25(2):198-206. [He J X,Pan T S,Jiang Y Y,Wu M L,Chen J,Wu S,Cui K. 2016. Effects of dietary carbohydrate to protein ratios and feeding rate on growth and lipid metabolism index of Carassius auratus gibelio[J]. Journal of Shanghai Ocean University,25(2):198-206.]
胡静,叶乐,吴开畅,王雨. 2016. 急性盐度胁迫对克氏双锯鱼幼鱼血清皮质醇浓度和Na+/K+-ATP酶活性的影响[J]. 南方水产科学,12(2):116-120. [Hu J,Ye L,Wu K C,Wang Y. 2016. Effect of acute salinity stress on serum cortisol and activity of Na+/K+-ATPase of juvinile Amphiprion clarkii[J]. South China Fisheries Science,12(2):116-120.]
胡毅,黄云,钟蕾,肖调义,文华,郇志利,毛小伟,李金龙. 2012. 氨氮胁迫对青鱼幼鱼鳃丝Na+/K+-ATP酶、组织结构及血清部分生理生化指标的影响[J]. 水产学报,36(4):538-545. [Hu Y,Huang Y,Zhong L,Xiao D Y,Wen H,Xun Z L,Mao X W,Li J L. 2012. Effects of ammonia stress on the gill Na+/K+-ATPase,microstructure and some serum physiological-biochemical indices of juvenile black carp(Mylopharyngodon piceus)[J]. Journal of Fisheries of China,36(4):538-545.]
黄云. 2012. 维生素C、E对青鱼氨氮胁迫的营养调控研究[D]. 长沙:湖南农业大学. [Huang Y. 2012. Studies on the ammonia-nitrite on juvenile black carp,Mylopharyngodon piceus and nutritional modulation of dietary vitamin C and E[D]. Changsha:Hunan Agriculture University.]
贾利兴. 2016. 壬基酚暴露对斑马鱼热休克蛋白表达量的影响[D]. 广州:暨南大学. [Jia L X. 2016. Effects of exposure to nonylphenol on expression of heat shock protein of zebrafish[D]. Guangzhou:Jinan University.]
姜会民. 2012. 氨氮胁迫对黄河鲤幼鱼肝胰脏、肾脏抗氧化性的影响[J]. 山东大学学报(理学版),47(1):17-22. [Jiang H M. 2012. Effects of ammonia on antioxidant in the liver,pancreas,and kidney of Yellow River Cyprinus carpio[J]. Journal of Shandong University(Nature Scien-ce),47(1):17-22.]
金晔,袁海延,王好,周井祥,刘艳辉,李改娟,祖岫杰. 2018. 鲤HSP90作为锦鲤疱疹病毒核酸疫苗免疫佐剂的效果研究[J]. 大连海洋大学学报,33(2):175-180. [Jin Y,Yuan H Y,Wang H,Zhou J X,Liu Y H,Li G J,Zu X J. 2018. Immune effect of carp HSP90 as an adjuvant of koi herpesvirus nucleic acid vaccine[J]. Journal of Dalian Ocean University,33(2):175-180.]
李之乡,王伟继,胡玉龙,吕丁,吴欢欢,栾生,孔杰. 2017. 养殖水体中氨氮对大菱鲆的急性毒性效应研究[J]. 海洋科学,41(10):109-116. [Li Z X,Wang W J,Hu Y L,Lü D,Wu H H,Luan S,Kong J. 2017. Acute toxicity of ammonia nitrogen on turbot(Scophthalmus maximus)[J]. Marine Sciences,41(10):109-116.]
劉建魁,刘立志,赵文,石振广,李文龙,王云山. 2014. 非离子氨和氨氮对不同规格史氏鲟幼鱼的急性毒性及安全浓度评价[J]. 大连海洋大学学报,29(2):175-178. [Liu J K,Liu L Z,Zhao W,Shi Z G,Li W L,Wang Y S. 2014. Acute toxicity and safe concentration of non-ionic ammonia and ammonia nitrogen to juvenile Amur sturgeon Acipenser schrencki with different sizes[J]. Journal of Dalian Ocean University,29(2):175-178.]
刘童. 2015. 基于菲律宾蛤仔的近海多环芳烃生物监测技术的研究[D]. 青岛:中国海洋大学. [Liu T. 2015. Biological monitoring technology research of offshore PAHs in the clam Ruduapes philippinarum[D]. Qingdao:Ocean University of China.]
刘亚娟,胡静,周胜杰,彭晓瑜,马振华. 2018. 急性氨氮胁迫对尖吻鲈稚鱼消化酶及抗氧化酶活性的影响[J]. 南方农业学报,49(10):2087-2095. [Liu Y J,Hu J,Zhou S J,Peng X Y,Ma Z H. 2018. Effects of acute ammonia nitrogen stress on antioxidant enzymes activity and digestive enzymes activity in larval Lates calcarifer[J]. Journal of Southern Agriculture,49(10):2087-2095.]
刘永波,王雅倩. 2016. 氨氮对养殖鱼类的危害及其控制方法[J]. 渔业致富指南,(4):59-60. [Liu Y B,Wang Y Q. 2016. Harm of ammonia nitrogen to cultured fish and its control method[J]. Fishery Guide to be Rich,(4):59-60.]
祁红学,刘秀萍,安静. 2017. 硫代巴比妥酸法测定鱼体肌肉中脂质过氧化物含量的方法优化[J]. 安徽农业科学,45(10):91-92. [Qi H X,Liu X P,An J. 2017. Improvement of thiobarbituric acid reaction for the dertermination of lipid peroxidation in the muscles of fish[J]. Journal of Anhui Agricultural Sciences,45(10):91-92.]
强俊,徐跑,何杰,王辉,李瑞伟. 2011. 氨氮与拥挤胁迫对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化指标的联合影响[J]. 水产学报,35(12):1837-1848. [Qiang J,Xu P,He J,Wang H,Li R W. 2011. The combined effects of external of ammonia and crowding stress on growth and biochemical activities in liver of(GIFT) Nile tilapia juveniles(Oreochromis niloticus)[J]. Journal of Fisheries of China,35(12):1837-1848.]
阮成旭,袁重桂,吴德峰,李建聪. 2014. 氨氮和亚硝态氮对大黄鱼幼鱼的急性毒性效应[J]. 福州大学学报(自然科学版),42(2):333-336. [Ruan C X,Yuan C G,Wu D F,Li J C. 2014. Acute toxic effects of ammonia and nitrite on juvenile Pseudosciaena crocea[J]. Journal of Fuzhou Nor-mal University(Nature Science Edition),42(2):333-336.]
宋美泽,黎明,李健,袁莉霞,王日昕,石戈. 2018. 急性氨氮暴露对大弹涂鱼炎性反应相关基因表达的影响[J]. 水产学报,42(11):1704-1710. [Song M Z,Li M,Li J,Yuan L X,Wang R X,Shi G. 2018. Effects of acute ammonia exposure on gene involved in inflammation of mudski-pper[J]. Journal of Fisheries of China,42(11):1704-1710.]
陶易凡,强俊,王辉,徐跑,马昕羽,赵文强. 2016. 低pH胁迫对克氏原螯虾鳃和肝胰腺酶活力及组织结构的影响[J]. 中国水产科学,23(6):1279-1289. [Tao Y F,Qiang J,Wang H,Xu P,Ma X Y,Zhao W Q. 2016. Acute toxicity of low-pH stress and its effect on enzyme activity and histological structure of gill and hepatopancreas in Procambarus clarkii[J]. Journal of Fishery Sciences of China,23(6):1279-1289.]
王蕓,李健,张喆,何玉英,常志强,陈萍,李吉涛,刘德月. 2013. pH、氨氮胁迫对中国对虾HSP90基因表达的影响[J]. 渔业科学进展,34(5):43-50. [Wang Y,Li J,Zhang Z,He Y Y,Chang Z Q,Chen P,Li J T,Liu D Y. 2013. Effects of pH and ammonia-N stresses on HSP90 gene expression of Fenneropenaeus chinensis[J]. Progress in Fishery Sciences,34(5):43-50.]
吴斌,方春林,张燕萍,傅培峰,陈文静,熊小英,周辉明,贺刚,王生,王庆萍. 2015. 鄱阳湖翘嘴鳜(Siniperca chuatsi)的生物学参数及资源量的估算[J]. 渔业科学进展,36(4):21-26. [Wu B,Fang C L,Zhang Y P,Fu P F,Chen W J,Xiong X Y,Zhou H M,He G,Wang S,Wang Q P. 2015. The assessment of biological parameters and stock biomass of Siniperca chuatsi in the Poyang Lake[J]. Pro-gress in Fishery Sciences,36(4):21-26.]
徐杨,肖炜,李大宇,邹芝英,祝璟琳,韩珏,杨弘. 2015. 慢性氨氮胁迫对尼罗罗非鱼幼鱼生长及生理功能的影响[J]. 南方农业学报,46(2):327-331. [Xu Y,Xiao W,Li D Y,Zou Z Y,Zhu J L,Han J,Yang H. 2015. Effects of chronic ammonia stress on growth and physiological function of juvenile Nile tilapia(Oreochromis niloticus)[J]. Journal of Southern Agriculture,46(2):327-331.]
顏元杰,曹哲明,丁炜东,邴旭文. 2019. 江苏省6个翘嘴鳜群体的遗传多样性分析[J]. 海洋渔业,41(1):25-33. [Yan Y J,Cao Z M,Ding W D,Bing X W. 2019. On genetic diversity analysis of 6 populations of Siniperca chuatsi in Jiangsu Province[J]. Marine Fisheries,41(1):25-33.]
张武肖,孙盛明,戈贤平,朱健,李冰,缪凌鸿,夏斯蕾,章琼,江晓浚. 2015. 急性氨氮胁迫及毒后恢复对团头鲂幼鱼鳃、肝和肾组织结构的影响[J]. 水产学报,39(2):233-244. [Zhang W X,Sun S M,Ge X P,Zhu J,Li B,Miao L H,Xia S L,Zhang Q,Jiang X J. 2015. Acute effects of ammonia exposure on histopathology of gill,liver and kidney in juvenile Megalobrama amblycephala and the post-exposure recovery[J]. Journal of Fisheries of China,39(2):233-244.]
章琼,蒋高中,李冰. 2015. 水产动物对氨氮胁迫响应的转录组分析研究进展[J]. 江苏农业科学,43(3):227-230. [Zhang Q,Jiang G Z,Li B. 2015. Advances in transcriptome analysis of aquatic animals’ responses to ammonia nitrogen stress[J]. Jiangsu Agricultural Sciences,43(3):227-230.]
郑乐云. 2012. 氨氮和亚硝酸盐对斜带石斑鱼苗的急性毒性效应[J]. 海洋科学,36(5):81-86. [Zheng L Y. 2012. Acute toxic effects of ammonia and nitrite on Epinephelus coioi-des[J]. Marine Sciences,36(5):81-86.]
周鑫,董云伟,王芳,董双林. 2013. 急性氨氮胁迫对于草鱼SOD和HSP90基因表达及鳃部结构的影响(英文)[J]. 水生生物学报,37(2):321-328. [Zhou X,Dong Y W,Wang F,Dong S L. 2013. The effect of high ammonia concentration on gill structure alternation and expression of SOD and HSP90 genes in grass carp,Ctenopharyngodon idella[J]. Acta Hydrobiologica Sinica,37(2):321-328.]
周莹,孙梨宗,刘志红,台培东,李钥莹. 2016. 氨氮对斑马鱼3种酶活性和基因表达的影响[J]. 沈阳师范大学学报(自然科学版),34(1):88-91. [Zhou Y,Sun L Z,Liu Z H,Tai P D,Li Y Y. 2016. Effect of activity and gene expression of three enzymes on Zebrafish(Danio rerio) stressed by ammonia nitrogen[J]. Journal of Shenyang Normal University(Nature Science),34(1):88-91.]
Ai H X,Shen Y F,Min C,Pang S Y,Zhang J X,Zhang S Q,Zhao Z H. 2011. Molecular structure,expression and bioactivity characterization of TNF13B(BAFF) gene in mefugu,Takifugu obscurus[J]. Fish & Shellfish Immunology,30:1265-1274.
Braissant O,Mclin V A,Cudalbu C. 2013. Ammonia toxicity to the brain[J]. Journal of Inherited Metabolic Disease,36(4):595-612.
Chandra J,Samali A,Orrenius S. 2000. Triggering and modu-lation of apoptosis by oxidative stress[J]. Free Radical Biology & Medicine,29(3-4):323-333.
Cheng C H,Yang F F,Ling R Z,Liao S A,Miao Y T,Ye C X,Wang A L. 2015. Effects of ammonia exposure on apoptosis,oxidative stress and immune response in pufferfish(Takifugu obscurus)[J]. Aquatic Toxicology,164:61-71.
Jia R,Cao L P,Du J L,Wang J H,Liu Y J,Jeney G,Xu P,Yin G J. 2014. Effects of carbon tetrachloride on oxidative stress,inflammatory response and hepatocyte apoptosis in common carp(Cyprinus carpio)[J]. Aquatic Toxico-logy,152:11-19.
Jia R,Liu B L,Han C,Huang B,Lei J L. 2017. Effects of ammonia exposure on stress and immune response in juvenile turbot(Scophthalmus maximus)[J]. Aquaculture Research,48(6):3149-3162.
Li M,Lai H,Li Q,Wang R X,Gong S Y. 2016. Effects of die-tary taurine on growth,immunity and hyperammonemia in juvenile yellow catfish Pelteobagrus fulvidraco fed all-plant protein diets[J]. Aquaculture,450:349-355.
Qi X Z,Xue M Y,Yang S B,Zha J W,Wang G X,Ling F. 2017. Ammonia exposure alters the expression of immune-related and antioxidant enzymes-related genes and the gut microbial community of crucian carp(Carassius auratus)[J]. Fish & Shellfish Immunology,70:485-492.
Rodrigo R,Cauli O,Boix J,Eimlili N,Feliu A A,Felipo V. 2009. Role of NMDA receptors in acute liver failure and ammonia toxicity:Therapeutical implications[J]. Neurochemistry International,55(1-3):113-118.
Sitp-Bobadilla A,Alvarez-Pellitero P. 2009. Experimental transmission of Sparicotyle chrysophrii(Monogenea:Polyopisthocotylea) to gilthead seabream(Sparus aurata) and histopathology of the infection[J]. Folia Parasitologica,56(2):143-151.
Veauvy C M,McDonald M D,van Audekerke J,Vanhoutte G,van Camp N,van der Linden A,Walsh P J. 2005. Ammonia affects brain nitrogen metabolism but not hydration status in the Gulf toadfish(Opsanus beta)[J]. Aqua-tic Toxicology,74(1):32-46.
Wang H J,Xiao X C,Wang H Z,Yu Q,Liang X M,Feng W S,Shao J C,Rybicki M,Jungmann D,Jeppesen E. 2017. Effects of high ammonia concentrations on three cyprinid fish:Acute and whole-ecosystem chronic tests[J]. Science of the Total Environment,598:900-909.
Xing X D,Li M,Yuan L X,Song M Z,Ren Q Y,Shi G,Meng F X,Wang R X. 2016. The protective effects of taurine on acute ammonia toxicity in grass carp Ctenopharynodon idellus[J]. Fish & Shellfish Immunology,56:517-522.
Zhang M,Li M,Wang R X,Qian Y X. 2018. Effects of acute ammonia toxicity on oxidative stress,immune response and apoptosis of juvenile yellow catfish Pelteobagrus fulvidraco and the mitigation of exogenous taurine[J]. Fish & Shellfish Immunology,79:313-320.
(責任编辑 兰宗宝)

