栀子苷对酵母多糖致大鼠肠黏膜屏障损害作用的研究
邓怒骄 陈凌波 谭瑛子 兰斌 邓常清 张文兴


〔摘要〕 目的 探讨栀子苷对酵母多糖(zymosan, Zym)致大鼠肠黏膜屏障损害的作用。方法 通过腹腔注射Zym-石蜡混悬液建立大鼠肠黏膜屏障损害模型,将模型大鼠随机分为模型组、栀子苷组、乌司他丁组, 腹腔注射Zym后即刻干预,12 h后重复干预 1 次。另设正常对照组。造模24 h后测定大鼠血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)、白介素-6(interleukin-6, IL-6)、白介素-10(interleukin-10, IL-10)、D-乳酸(D-lactate, D-LA)、二胺氧化酶(diamine oxidase, DAO)、内毒素(endotoxin, ET)水平,并取小肠进行病理组织学检查。结果 模型组大鼠血清TNF-α、IL-1β、IL-6、IL-10、D-LA、DAO、ET水平较正常对照组显著增高(P<0.01);病理组织学检查可见黏膜上皮水肿,黏膜上皮细胞排列紊乱,黏膜上皮炎症细胞增多,固有层松散、充血;与模型组比较,栀子苷可降低肠黏膜屏障损害大鼠血清TNF-α、IL-1β、IL-6、D-LA、DAO及ET水平,增加IL-10水平(P<0.05, P<0.01),减轻肠组织病理性损伤。结论 栀子苷可以减轻Zym导致的大鼠炎症反应,对Zym引起的肠黏膜屏障损害具有保护作用。
〔關键词〕 栀子苷;酵母多糖;肠黏膜屏障;炎症反应
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.04.007
Effects of Geniposide on Intestinal Mucosal Barrier Damage Induced by Zymosan in Rats
DENG Nujiao, CHEN Lingbo, TAN Yingzi, LAN Bin, DENG Changqing, ZHANG Wenxing*
(Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To investigate the effects of geniposide on intestinal mucosal barrier damage induced by zymosan (Zym) in rats. Methods Intestinal mucosal barrier damage model of rats was induced by intraperitoneal injection of zymosan-paraffin suspension. The model rats were randomly divided into the model group, geniposide group and ulinastatin group. Drugs were given after intraperitoneal injection of zymosan-paraffin suspension immediately and 12 h later. The normal control group was set up. Then, 24 h after modeling, the levels of tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β), interleukin-6 (IL-6), interleukin-10 (IL-10), D-lactate (D-LA), diamine oxidase (DAO), and endotoxin (ET) in the serum were measured, and the intestines of rats were taken for histopathological examination. Results The levels of TNF-α, IL-1β, IL-6, IL-10, D-LA, DAO, and ET in the serum in the model group were significantly higher than those in the normal control group (P<0.01). The pathological examination showed intestinal mucosal epithelial edema, disordered arrangement of mucosal epithelial cells, increased mucosal epithelial inflammatory cells, congestive lamina propria. Geniposide could decrease the levels of TNF-α, IL-1β, IL-6, D-LA, DAO and ET, and increase the IL-10 level (P<0.05, P<0.01), reduce pathological damage in intestinal tissue. Conclusion Geniposide could reduce inflammatory reaction, attenuate the intestine mucosal damage induced by zymosan in rats.
〔Keywords〕 geniposide; zymosan; intestinal mucosal barrier; inflammatory response
肠黏膜屏障是指肠道能够防止肠内的有害物质如细菌、毒素等穿过肠黏膜,进而进入到人体内的其他组织器官和血液循环的总和[1]。当机体处于严重感染、休克等应急状态时,一方面可通过肠道菌群失调、内毒素、缺血-再灌注损伤、释放炎症介质等机制损伤肠道黏膜,使得肠黏膜的通透性升高,导致肠道细菌以及内毒素的移位,启动或加重了炎症介质的瀑布效应,从而导致失控性全身炎症反应综合征(systemic inflammatory response syndrome, SIRS),进一步发展成为多器官功能障碍综合症(multiple organ dysfunction syndrome, MODS),另一方面,在上述病理状态下,胃肠道能直接产生和释放多种肠源性炎症介质,更进一步放大全身炎症反应[2],因此,对肠黏膜的屏障功能加以保护,减少炎症介质的释放,对于SIRS和MODS的防治具有重要的临床意义。栀子苷(geniposide)是清热药栀子(Gardenia jasminoides Ellis)的主要活性成分,研究表明栀子苷具有广泛的抗炎作用[3],栀子苷在体外对脂多糖(lipopolysaccharides, LPS)具有显著的直接中和作用[4],可减少LPS刺激巨噬细胞引起的肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-6(interleukin-6, IL-6)的分泌,增加白细胞介素-10(interleukin-10, IL-10)的生成,可减轻LPS引起的小鼠急性肺损伤、小鼠乳腺炎及大鼠神经小胶质细胞炎症[5-8],对脓毒症模型的小鼠具有显著的保护作用[4]。但有关栀子苷对酵母多糖(zymosan, Zym)诱导肠黏膜屏障损害的作用尚未见报道,因此,本文研究栀子苷对Zym诱导的肠黏膜屏障损伤的作用,旨在为临床应用提供部分实验依据。
1 材料与方法
1.1 实验动物
SPF级SD雄性大鼠,4月龄,体质量220~270 g,由湖南斯莱克景达实验动物公司提供,动物许可证号:SCXK(湘)2016-0002。大鼠饲以标准颗粒饲料,12 h交替光线照明,室内通风良好,室温20~25 ℃,相对湿度40%~50%。
1.2 试剂及药品
栀子苷:批号HL-171219,质量分数98.1%,由西安汇林生物科技有限公司提供;注射用乌司他丁:批号031610054,规格10万U/支,由广东天普生化医药股份有限公司提供;酵母多糖:Sigma公司产品(Z4250-5G)批号BCBK3273V;TNF-α(批号2401450615)、IL-10(批号1381455615)、EL-6(批号1331415615)、IL-β(批号1151458615)ELISA试剂盒由武汉博士德生物工程有限公司提供;D-乳酸(D-lactate, D-LA)(批号06/2018)由上海酶联生物科技有限公司提供;二胺氧化酶(diamine oxidase, DAO)(批号V18032498)、内毒素(endotoxin, ET)(批号T11032497)由武汉华美生物工程有限公司提供;医用液体石蜡:批号101520170602,由湖南尔康制药股份有限公司提供。
1.3 儀器
H1650R台式高速冷冻离心机:湖南湘仪实验室仪器开发有限公司生产;PW-812全自动酶标洗板机、MB-530多功能酶标分析仪:深圳市汇松科技发展有限公司生产;DHP-500恒温培养箱:北京市永光明医疗仪器有限公司生产;LEICADMLB2型双目显微镜:德国LEICA公司产生产;Shandon325石蜡切片机:英国Shandon公司生产。
1.4 模型制备及干预
按文献方法[9]将Zym粉剂10 g加至100 mL液体石蜡中(浓度为100 mg/mL),先用磁力搅拌器搅拌均匀,再用高频电动振荡器混匀制成悬浊液,置于100 ℃水浴消毒80 min,冷却后放入4 ℃冰箱备用,使用前将悬浊液加热至40 ℃,摇匀后使用。实验前10 h,SD大鼠开始禁食,造模前1 d,将SD大鼠称体质量后标记,模型组及各给药组大鼠均按体质量腹腔注射Zym 500 mg/mL,正常对照组腹腔注射等容量的液体石蜡,注射后轻揉腹部。大鼠腹腔注射Zym后即刻干预,12 h后重复干预1次。栀子苷组灌胃给予栀子苷40 mg/kg,阳性对照组腹腔注射乌司他丁27 000 U/kg,给药体积均为10 mL/kg,模型组及正常对照组灌胃给予等容量0.5%羧甲基纤维素钠。
1.5 标本采集及指标检测
大鼠腹腔注射Zym或液体石蜡24 h后,用 10%水合氯醛350 mg/kg腹腔注射麻醉后腹主动脉取血约8 mL,分离血清,采用酶联免疫吸附法(ELISA)检测大鼠血清D-LA、DAO、ET、TNF-α、IL-1β、IL-6、IL-10表达水平。处死大鼠后,距回盲部5 cm处取约3 cm回肠末端肠管,置于10%中性甲醛中固定,石蜡包埋切片,苏木精-伊红(HE)染色,进行病理组织学检查。
1.6 统计学分析
实验数据“x±s”表示,应用SPSS 17.0 统计软件进行统计分析,各组间数据经方差齐性检验后,两组间比较采用单因素方差分析。检验水平α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 栀子苷对肠黏膜屏障损伤大鼠肠道病理组织学的影响
正常对照组大鼠末端回肠黏膜结构完整,绒毛排列整齐、紧密,杯状细胞数量中等,无炎症细胞浸润;模型组大鼠腹腔注射Zym 24 h后可见小肠黏膜明显水肿,黏膜上皮细胞排列紊乱,黏膜上皮轻度脱落,固有层充血,杯状细胞减少,炎症细胞增多。栀子苷组、乌司他丁组肠黏膜轻度水肿,固有层充血减轻,杯状细胞增多,炎症细胞浸润减轻。见图1。
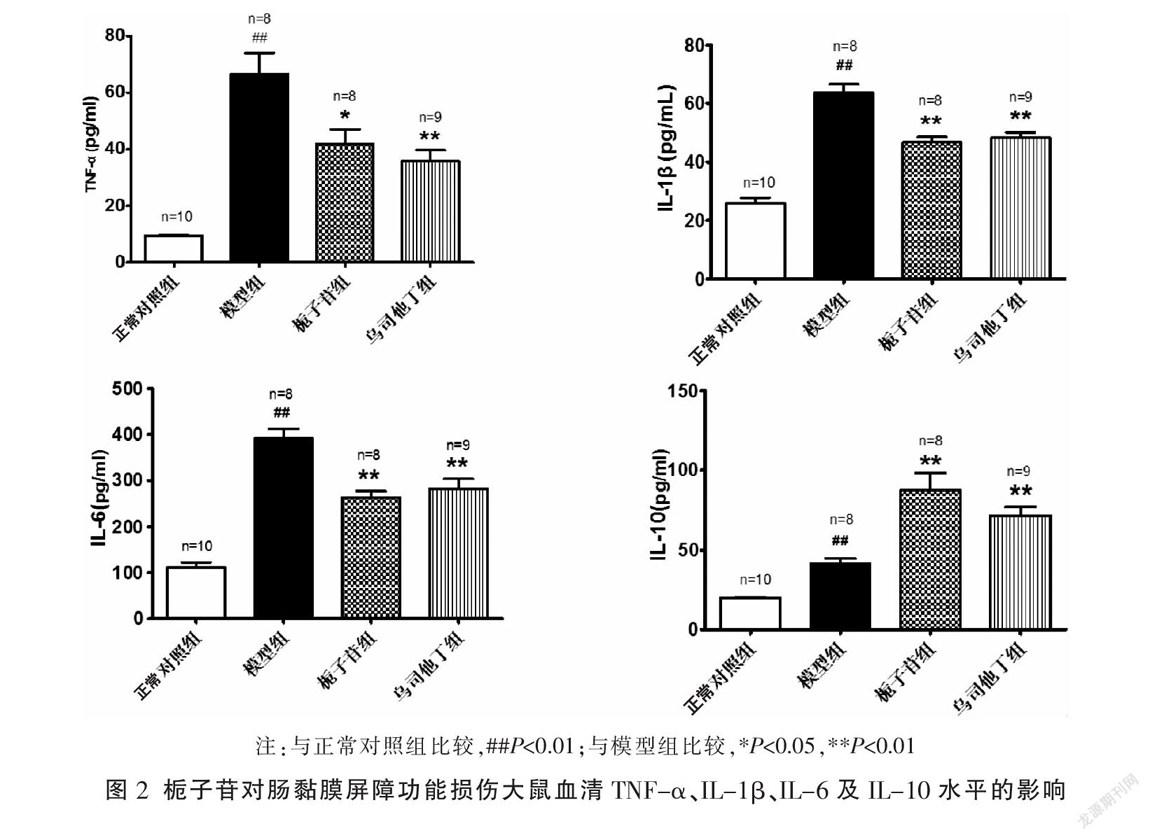
2.2 栀子苷对肠黏膜屏障损伤大鼠血清TNF-α、IL-1β、IL-6及IL-10水平的影响
模型组大鼠腹腔注射Zym 24 h后血清TNF-α、IL-1β、IL-6及IL-10水平明显高于正常对照组(P<0.01);栀子苷组大鼠血清TNF-α、IL-1β、IL-6水平明显低于模型组(P<0.05,P<0.01),IL-10水平明显高于模型组(P<0.01);乌司他丁组大鼠血清TNF-α、IL-1β及IL-6水平明显低于模型组(P<0.01),IL-10明显高于模型组(P<0.01)。见图2。
2.3 栀子苷对肠黏膜屏障损伤大鼠血清D-LA、DAO及ET的影响
模型组大鼠腹腔注射Zym 24 h后血清D-LA、DAO及ET水平明显高于正常对照组(P<0.01),栀子苷组大鼠血清D-LA、DAO及ET水平明显低于模型组(P<0.01),乌司他丁组大鼠血清D-LA、DAO及ET水平明显低于模型组(P<0.01)。见图3。
3 讨论
Zym腹腔注射通过激活补体系统、刺激巨噬细胞释放大量炎性介质,引起无菌性腹腔炎症,从而导致全身性炎症反应以及有效循环血量的减少[10-11],在肠组织中局部过强的炎症反应以及血流量的减少,均可削弱肠屏障的功能,进而增加肠黏膜的通透性,并导致肠内毒素和细菌的移位,从而进一步加重了全身性的炎症反应,甚至可引发MODS。
TNF-α是最早引起全身炎症反应甚至MODS的炎性介质,也是导致炎性介质级联反应的始发因子;SIRS的启动因子IL-1β,也发挥着与TNF-α相类似的作用,因此,血中TNF-α、IL-1β的水平与SIRS、MODS的发生以及严重程度有着很好的相关性。IL-6作为炎症反应的主要诱导者,能够直接反映出各种类型损害的严重程度。IL-10作为主要的抗炎因子,可抑制T细胞、NK细胞以及单核-巨噬细胞的活性,是反映机体免疫状态及预后的灵敏指标[12]。正常情况下,机体的肠腔内含有大量的细菌和ET,由于肠黏膜屏障的存在,导致ET难以入血,但是当SIRS发生时全身血流量重新分布,导致内脏血流量锐减,胃肠黏膜因发生缺血/缺氧代谢障碍而糜烂、坏死,出现肠黏膜屏障破坏,肠道内细菌移位、ET吸收入血,进而激活中性粒细胞,导致炎性因子大量釋放,进一步加剧了SIRS[13-14]。因此,监测血中内毒素水平可以判断由早期肠屏障损伤导致的ET移位,了解肠黏膜屏障功能情况[15]。D-LA是细菌发酵的代谢产物,肠道内多种细菌均可产生D-LA,但在正常情况下很少被吸收,而且哺乳动物不产生D-LA,也不能或是仅能缓慢代谢D-LA,因此,当肠道受损时,肠黏膜的屏障遭到了破坏,肠的通透性增加,肠道细菌产生的D-LA也可以通过肠道进入到血液中,使得血液中的D-LA水平升高,因此,监测血液中D-LA的水平可以及时反映肠黏膜的损害程度和通透性的变化[9]。DAO主要存在于小肠黏膜上皮细胞内,在肠黏膜细胞出现坏死时,DAO可释放入血,或随坏死脱落的肠黏膜细胞进入到肠腔内,导致血液或肠腔内的DAO活性增高[15],DAO在外周血中活性稳定,因此,测定DAO在外周血中的变化,可反映肠黏膜的状态,血液中DAO含量升高反映了肠黏膜上皮细胞的损伤以及肠屏障结构的破坏[15]。而肠黏膜的组织形态学观察是肠屏障功能评价最直接的依据,利用显微镜观察肠黏膜,能够比较准确分析肠黏膜上皮形态结构的变化[16]。
本研究表明,大鼠腹腔注射Zym后血清TNF-α、IL-1β、IL-6、IL-10升高,表明大鼠腹腔注射Zym后出现了炎症反应,大鼠腹腔注射Zym后血清D-LA、DAO、ET水平升高,病理组织学检查可见小肠黏膜明显水肿,黏膜上皮细胞排列紊乱,黏膜上皮轻度脱落,固有层充血,杯状细胞减少,炎症细胞增多,表明大鼠腹腔注射Zym后肠屏障受损、肠黏膜通透性升高,提示造模成功,与文献报道一致[17]。
肠道是应激状态下机体内稳定和全身炎症反应的重要调节者,肠道病变不仅促发SIRS失控,而且在SIRS进程中起着推波助澜的作用,因此,针对肠道进行多角度、多途径的保护治疗,将有助于控制SIRS及MODS的发生。本研究表明,栀子苷可降低Zym所致肠黏膜屏障损伤大鼠血清致炎因子TNF-α、IL-1β、IL-6水平,增加抗炎因子IL-10水平,并可降低该模型大鼠血清ET、D-LA和DAO水平,减轻肠黏膜病理性损伤,说明栀子苷对Zym所致的大鼠炎症反应及肠黏膜屏障损伤具有保护作用。本研究为栀子苷的临床应用提供了实验依据。
参考文献
[1] 吕 宾.肠黏膜屏障与肠功能障碍[J].现代消化及介入诊疗,2013,
18(4):232-234.
[2] 肖 菲,康 焰.肠道细菌移位的研究现状[J].中国普外基础与临床杂志,2006,13(2):240-243.
[3] 万亮琴,张子剑,谭 琰,等.栀子及栀子苷抗炎作用机制的最新研究进展[J].现代中药研究与实践,2017,31(3):80-83.
[4] 伏建峰,赵 华,史清海,等.栀子苷拮抗内毒素的实验研究[J].中国现代应用药学,2013,30(4):352-356.
[5] XIAOFENG Y, QINREN C, JINGPING H, et al. Geniposide, an iridoid glucoside derived from Gardenia jasminoides, protects against lipopolysaccharide-induced acute lung injury in mice[J]. Planta Medica, 2012,78(6):557-564.
[6] 孙 勇,李德鹏.栀子苷对LPS诱导的小鼠乳腺炎的抑制效果[J].中国兽医科学,2013,43(8):876-880.
[7] NA K N, CHOI Y S, JUNG H J, et al. Genipin inhibits the inflmmatory response of rat brain microglial cell[J]. International Immunopharmacology, 2010,10(4):493-499.
[8] FU Y, LIU B, LIU J, et al. Geniposide, from Gardenia jaminoides Ellis, inhibits the inflmmatory response in the primary mouse macrophages and mouse models[J]. International Immunopharmacology, 2012,14(4):792-798.
[9] 张 莉,刘欣艳,杨根妹,等.酵母多糖致全身炎症反应综合征大鼠模型肠屏障功能改变的研究[J].徐州医学院学报,2016,36(11):730-734.
[10] 郑金光,白晓东,胡 森.酵母多糖诱导全身炎症反应及多器官功能障碍综合征模型的研究进展[J].感染、炎症、修复,2015,16(2):122-124.
[11] GORIS R J, BOEKHOLTZ W K, VAN BEBBER I P, et al. Multiple-organ failure and sepsis without bacteria: An experimental model[J]. Archives of Surgery, 1986,121(8):897-901.
[12] 刘海涛,蔡陆丹,吴曙粤.全身炎症反应综合征和多器官功能障碍综合征早期诊断的实验室预警指标研究进展[J].内科,2008,
3(1):89-91.
[13] 王幼黎,路树强,高 举,等.肠道去污在全身炎症反应综合征患者炎症反应的调节中的作用[J].中华危重病急救医学,2015,27(6):484-488.
[14] 常建星.全身炎症反应综合征与肠屏障的损害[J].国外医学外科學分册,2004,31(3):158-160.
[15] 田景华.肠黏膜屏障的研究进展[J].医学理论与实践,2013,26(15): 1992-1993.
[16] 欧阳荣键,路延之,周其全.参芪花粉片对低氧暴露下大鼠胃肠黏膜屏障的保护作用观察[J].湖南中医药大学学报,2018,38(2):154-159.
[17] 张慧苹,马丽千,吕 艺,等.二甲亚砜对酵母多糖致肠道屏障损伤的保护作用[J].中国应用生理学杂志,2017,33(3):193-196.

