油茶CoFAD2-1基因的克隆、亚细胞定位及组织表达
陈潇潇,罗红艳,顾真琪,陈世品,曹光球,曹世江*
(1.福建农林大学林学院,福州 350002;2.福建农林大学植物保护学院,福州 350002)
油茶(Camellia oleifera Abel.)是中国南方重要的木本油料经济树种之一,广泛分布于长江流域以南的大部分地区,与油橄榄(Olea europaea.)、油棕(Elaeis guineensis Jacq.)、椰子(Cocos nucifera L.)并称为世界四大木本油料植物[1-2]中国的油茶栽培和利用历史长达2 000 多年,油茶林栽培面积约为300 万 hm2,油茶籽油年产量约为26 万t,产值高达110 亿元[2]。此外,油茶还可用于开发生物质能源,对优化中国能源结构,减少对化石燃料的依赖,保障国家能源安全具有重大意义[3]。
茶油中包含多种不饱和脂肪酸,其中最主要的两种不饱和脂肪酸油酸和亚油酸的总含量高达90%以上。亚油酸为多不饱和脂肪酸,是人体不可缺少而自身又不能合成的必需脂肪酸[4-5]。从营养学上讲,油酸和亚油酸都能降低血清胆固醇,但因为油酸比亚油酸少一个双键,使油酸比亚油酸具有更高的抗氧化性,因此在提高油酸含量的同时亚油酸的含量也得以提升,这对茶油质量的提高具有重大意义[6-7]。医学研究表明,亚油酸还是胎儿神经发育中十分重要的物质,具有抑制胆固醇合成、调节血压和抗氧化的作用,还可以有效地预防和治疗冠心病、高血压等心血管疾病[8-9]。故而茶油油质极好,经常食用又有预防心血管硬化美容养颜、降血压降血脂、延年益寿等功效[10]。
FAD2(fatty acid desaturase 2)即脂肪酸去饱和酶 2,最初是从拟南芥(Arabidopsis thaliana)[11]中克隆出来,后来也陆续从大豆(Glycine max)[12]、花生(Arachis hypogaea)[13-14]、油桐(Vernicia fordii)[15]等油料植物中克隆到。在油茶果实发育的过程中,FAD2是控制油酸生成亚油酸的关键基因,其主要功能是在油酸的第12 和13 位碳原子之间形成双键,生成亚油酸[16]因此CoFAD2-1 在一定程度上决定了茶油中油酸与亚油酸的比例,从而能够改善茶油的品质油茶闽48 是福建广泛种植的高产品种,其种仁的含油率高达48.70%,远大于一些油料作物的含油率。本论文以该栽培品种为试验材料进行CoFAD2-1 基因的克隆,分析其结构和生物功能,该研究为改善茶油品质奠定理论基础,同时具有较重要的实践意义。
1 材料和方法
1.1 试验材料
本研究选用2015年9 月中旬采自于福建省福州市闽侯县桐口林场的福建油茶优良品种闽48 的发育中期未成熟胚,闽48 当年生嫩叶、根、茎,于2016年4 月中旬采自于福建农林大学南门妙峰山试验田,采集后用锡箔纸包裹分装于-80 ℃冰箱中保存备用。烟草瞬时表达所用烟草为生长健壮无病虫害的6~7 周本氏烟草。
1.2 油茶4种组织中总RNA的提取及cDNA第一链的合成
从4 种组织中运用CTAB 法提取总RNA,利用TIANScript cDNA 第一链合成试剂盒进行第一条链cDNA 的合成,并将浓度一致调为200 ng/μL。
1.3 基因的扩增及实时荧光定量PCR
通过GenBank 数据库中得到的油茶FAD2 基因编码区序列结合GATEWAY 系统运用DNAMAN 6.0 软件设计特异引物及实时荧光定量PCR 引物QFAD2-Fw,QFAD2-Rv,并递交上海生物工程技术有限公司合成,引物设计见表1。PCR 扩增反应条件如下,采用 50 μL 体系:cDNA 1 μL,10×Pfu Buffer 5 μL,引物 pD207 FAD2-1 F(10 μM)1 μL,引物 pD207 FAD2-1 R(10 μM)1 μL,dNTP Mixture(2.5 mM)4 μL,pfu DNA Polymerase(2.5 U/μL)0.2 μL,ddH2O 加至50 μL。94 ℃预变性 3 min,94 ℃变性 30 s,55 ℃退火30 s,72 ℃延伸 2 min30 s,共 30 个循环,之后 72 ℃再延伸5 min,4 ℃保存。扩增后产物经1%的琼脂糖凝胶电泳检测。实时荧光定量PCR 仪器为LightCycler®Nano,扩增试剂为 2×TransStart®Tip Green qPCR SuperMix,采用荧光染料 SYBR Green I,参考油茶EF1α 基因作为内参基因[17]。实时荧光定量PCR 的反应体系见表2。根据目的基因和内参基因PCR 扩增的 Ct值,采用 2-△△Ct法[18]计算目的基因的相对表达量。
1.4 PCR产物测序及序列分析
将PCR 产物进行纯化后送到铂尚生物工程有限公司测序,并运用生物信息学软件进行序列分析。运用软件Protparam 分析CoFAD2-1 蛋白的氨基酸数目、半衰期等理化性质(http://web.expasy.org/protparam/);运用 Psort 进行 CoFAD2-1 蛋白结构的亚细胞定位预测分析(https://psort.hgc.jp/);运用Scratch Protein Predictor 进行 CoFAD2-1 蛋白可溶性和二硫键预测分析(http://scratch.proteomics.ics.uci.edu/);运用MEGA 6.0.5 进行聚类分析及系统进化树构建;运用Vector NTI 11.5 进行序列比对分析。
1.5 CoFAD2-1蛋白的亚细胞定位
将 PCR 产物切胶回收,通过 BP 反应将CoFAD2-1 基因转入 pDNOR207 载体中。BP 产物转DH5α 大肠杆菌感受态细胞,经庆大霉素(50 mg/L)筛选后挑取3 个单克隆摇菌并进行菌落PCR 检验,结果表明1、2、3 均为阳性克隆,且大小合适,提取质粒作为入门载体。通过LR 反应将CoFAD2-1 基因克隆到植物表达载体pGWB505 上,并将LR 产物转化DH5α 大肠杆菌感受态细胞,经壮观霉素筛选单克隆进行菌落PCR 验证,阳性菌落摇菌并提取质粒作为表达载体。将阳性菌落运用冻融法转入农杆菌GV3101 感受态细胞,PCR 鉴定阳性菌落。接菌至含对应抗生素的LB 液体培养基,震荡培养过夜。制备农杆菌悬浮液,调整菌液OD600 至1.0,在温室下放置2 h,用1 mL 注射器在烟草叶片背面将菌液缓慢渗透注射到叶片组织间隙中,25 ℃条件下培养36 h 后在荧光显微镜下观察,使用内质网mcherry marker 标记内质网[19]。

表1 引物设计Table 1 Primer design
2 结果与分析
2.1 CoFAD2-1基因克隆
从油茶胚中提取RNA,通过逆转录试剂盒合成cDNA,进行PCR 扩增后,电泳得到特异性条带(图1),约为1 000 bp,与预期结果相符,随后将PCR 产物送至铂尚生物公司进行测序。
2.2 CoFAD2-1基因序列的生物信息学分析
2.2.1 CoFAD2-1 蛋白基本理化性质分析
运用Protparam 软件推测CoFAD2-1 蛋白的基本理化性质,推测该蛋白相对分子量为44.34 kDa,理论IP 值为8.07。负电荷残基数为30,正电荷残基数32。理论推导半衰期为30 h,不稳定系数为39.28,属于稳定蛋白。理论上脂肪系数为89.27,且总平均亲水性为-0.042。
运用Scratch Protein Predictor 进行 CoFAD2-1蛋白可溶性和二硫键预测分析。预测CoFAD2-1 蛋白不可溶的概率为0.779 307。该蛋白中的半胱氨酸的数量为7,二硫键总的个数为2,第一个二硫键的半胱氨位置可能是在94~106 上,第一个二硫键的半胱氨位置可能在239-252。

图1 PCR 扩增电泳图Figure 1 The agarose gel electrophoresis of PCR product
2.2.2 油茶CoFAD2-1 氨基酸序列同源比对和系统进化树分析
在NCBI 网站上运用BLAST 进行蛋白序列比对,确定克隆到的基因属于FAD2 家族。其编码区DNA 序列长度为 1 149 bp。从 46 bp 到 328 bp 段有3 个峰,代表的是催化油酸向亚油酸转化必不可少的3 个保守性非常高的组氨酸跨膜结构域。该区域包含8 个组氨酸残基,其中携带铁原子配体,是催化油酸向亚油酸转化过程中必不可少的部分。
将CoFAD2-1 核苷酸序列用Vector NTI 软件翻译成氨基酸序列后,在Pfam 上对其结构域进行分析,发现存在CoFAD2-1 基因特有的3 个保守性非常高的组氨酸簇—HECGHHHRRHHHVAHH,在图2 中用阴影表示。
运用 MEGA 6 Neighbor-Joining(NJ)法构建分子进化树(图3),将克隆到的基因翻译成的蛋白序列与其他相似性高的FAD2 进行聚类分析。从CoFAD2-1 基因的系统树可以看出,除去谭晓风等[20]克隆的油茶CoFAD2-1,其中相似性最高的为珙桐(Davidia involucrata Baill.),油茶 CoFAD2-1 基因与油茶、珙桐、大豆、油橄榄等种子特异表达的FAD2基因聚在一类,推测该基因在种子中特异表达。

图2 CoFAD2-1 氨基酸序列Figure 2 Amino acid sequence of CoFAD2-1

图3 CoFAD2-1 系统进化树Figure 3 Phylogenetic tree of CoFAD2-1
2.3 油茶CoFAD2-1基因的表达分析
利用实时荧光定量PCR 技术以油茶EF1α 基因为内参,分析了CoFAD2-1 基因在根、茎、叶、胚中的表达情况。在不同组织中的表达情况分析结果表明(图 4),CoFAD2-1 基因在根、茎、叶、胚 4 种组织中都有表达,但表达量存在明显差异,在胚中表达量最高,叶中表达量其次,在根和茎中几乎不表达,其中,在胚中的相对表达量是根中的46 倍。因此,推测该基因为种子特异性表达基因。
2.4 CoFAD2-1基因在本生烟亚细胞定位分析
采用农杆菌介导法将构建好的载体导入烟草表皮细胞中,荧光显微镜下观察。结果显示:转化了重组载体pGWB-35S-coFAD2-GFP 的烟草表皮细胞在内质网膜中检测到荧光(图5),说明目的CoFAD2-1 基因主要定位在内质网膜上。结果显示,具有GFP 标签的目的基因CoFAD2-1 荧光所示位置,与内质网膜Marker 荧光表达位置重叠,说明CoFAD2 基因定位于内质网膜上。

图4 不同组织中CoFAD2-1 基因相对表达量Figure 4 Relative expression of CoFAD2-1 gene in different tissues
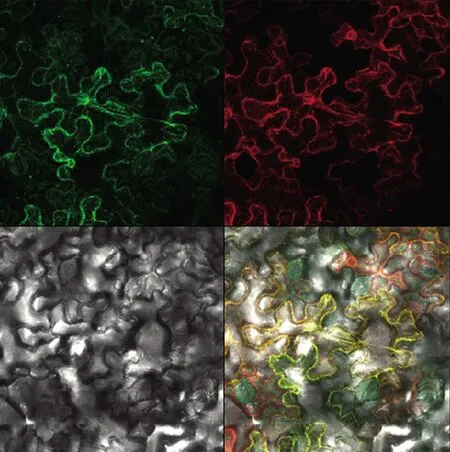
图5 CoFAD2-1 在烟草亚细胞定位Figure 5 The results of subcellular location of CoFAD2-1 in tobacco
3 讨论与结论
FAD2 基因家族广泛存在于植物界,目前已从许多植物中克隆到FAD2 基因,对于其功能的研究相对较明了,但有关油茶中FAD2 基因的研究鲜见报道。FAD2 具有3 个组氨酸跨膜结构域,从植物或微生物中分离或得到其蛋白较为困难[21]。经油茶不同组织中CoFAD2-1 基因的表达量分析及系统树聚类分析得出,该基因为种子中特异性表达的,由于在大多数物种中的种子特异表达的FAD2 都命名为FAD2-1,故将该基因命名为CoFAD2-1。经Vector NTI 软件比对,与谭晓风等[20]从湘林1 号油茶的近成熟果实中克隆的FAD2-1 基因(登录号:KJ995981)氨基酸相似性为99.2%,共有3 个氨基酸位点不同,在湘林1 号中第61、234、235 氨基酸位点分别为缬氨酸、异亮氨酸、缬氨酸,而在闽48 FAD2中分别为异亮氨酸、天冬酰胺和丝氨酸。与王仲伟等[22]克隆到的 CoFAD2-2 基因(登录号:JQ739518)核苷酸相似性为73.5%。CoFAD2-1 蛋白具有6 个跨膜结构,烟草瞬时表达分析显示该蛋白定位在内质网膜上。
本文对油茶内脂肪酸去饱和酶的不同组织的表达量进行了分析,明确了其种子内表达的特异性,并且进行了亚细胞定位,为后期进行油茶品质改良奠定了基础。前人研究表明,环境胁迫能够诱导植物细胞内脂肪酸组成的改变以及细胞膜流动性的变化,脂肪酸去饱和酶能够帮助调节细胞膜的流动性,有助于提高植物细胞对非生物胁迫的耐受性[23]。目前有关FAD2 的应用主要是通过构建种子特异性表达载体,将FAD2 反义基因转入油料作物以提高其油酸含量,培育油酸含量高的品种[24]。

