獭兔Slc7a11基因过表达对黑色素相关基因的影响及SNP 检测
陈秋燃,李佳丽,刘 明,周 娟,陈 阳,吴信生
(扬州大学动物科学技术学院/农业与农产品安全国际合作联合实验室,江苏扬州 225009)
被毛颜色是獭兔重要的经济特征之一,早期的遗传学研究在孟德尔法则的重新发现不久后就已经开始毛色相关研究了[1-3]。分子遗传学研究已经证实酪氨酸酶(TYR)、黑皮质素 1 受体(MC1R)、黑素蛋白(MLPH)基因的突变会导致毛色变化的现象[4-7],它们都通过参与生物合成活性或者调节有关黑色素生成细胞的分布过程等来调控毛色[3-4]。MC1R 是控制毛色的重要候选基因之一,参与毛色的形成,在小鼠上已经发现MC1R 与毛色有一定的联系[8]。MC1R 基因也对黑色素形成的造成影响,连锁控制黑色素形成的主要基因。该基因被发现可以参与调控斑马鱼的金色表型,致使皮肤黑色素细胞和视网膜色素上皮细胞黑色素小体体积与数量发生改变[9]。此外,利用 siRNA 干扰鸡视网膜色素上皮细胞SLC24A5,发现色素细胞合成黑色素的能力受到抑制,影响黑色素的沉积[10]。Slc7a11 基因是新发现的功能新基因位于染色体4q28q32,是溶质转运第7家族的第11 位成员,共12 个外显子[11]。它是毛发中伪黑素和真黑素主要的调控基因,能够直接控制伪黑素的产生。该基因编码的氨基酸负责特异性转运胱氨酸和谷氨酸,当Slc7a11 基因发生大片段缺失后,导致其编码的蛋白改变,使氨基酸失去功能,导致细胞无法还原成半胱氨酸,从而不能满足细胞中合成褐黑素的需要,最终导致毛色表现为真黑色素的黑颜色,从而缺乏由褐黑素产生的黄色[12-14]。我们也尝试在不同毛色的獭兔中寻找该区域的类似缺失,但是并无所获。因此,本研究拟在Slc7a11 的外显子区域扫描SNPs,随后通过构建Slc7a11 基因过表达载体检测其对黑色素生成相关基因的影响,进一步探究Slc7a11 基因对獭兔的毛色形成机制。
1 材料和方法
1.1 试验材料
1.1.1 试验动物
随机选择同批次出生的健康的獭兔163 只(包括白色37 只、青紫蓝色72 只、黑色20 只、黄色34只)均来自浙江省余姚市欣农兔业有限公司。每只獭兔采集耳部组织放入装有2 mL 70%乙醇溶液的离心管中,置于冰盒中保存,用于DNA 提取。同时,采集黑色獭兔背部皮肤组织,置于-80 ℃冻存,用于RNA 提取。
1.1.2 试验材料
限制性内切酶HindⅢ和SacⅡ来自TaKaRa 公司;血液基因组DNA 提取试剂盒、DNA 纯化试剂盒、RNA 提取试剂盒、FastQuant RT Kit、质粒小提质试剂盒均购自天根公司。
1.2 试验方法
1.2.1 引物设计与合成
通过NCBI 获取兔Slc7a11 基因DNA 序列(登录号 NC_013683.1)和 mRNA 序列(登录号 XM_008 267436),运用 Primer5.0、Oligo6.0 软件设计外显子区(表1)和CDS 区的特异性引物(表2),以及MC1R、SLC24A5 荧光定量引物,由北京擎科新业有限公司合成。
1.3 獭兔Slc7a11基因DNA外显子多态性检测
首先利用天根DNA 提取试剂盒提取獭兔耳组织DNA,使用NanoDrop 2000 核酸浓度测定仪检测DNA 浓度和 OD 值,OD 值为 1.8~2.0 的样品可用,后用TE 将样品稀释至相同浓度。反应体系:反应总体系20 μL,其中 2×Taq PCR Master Mix 10 μL、ddH2O 7 μL、上下游引物各 1 μL、DNA 模板 1 μL。反应条件:95 ℃预变性5 min;95 ℃变性30 s;最适退火温度30 s;72 ℃延伸 1 min,35 个循环;72 ℃彻底延伸 10 min。
PCR 产物检测:对扩增后的PCR 原液用浓度为1.5%琼脂糖凝胶电泳检测,并用凝胶成像系统拍照存档。
1.4 Slc7a11蛋白质结构功能分析方法
运用软件SeqMan 和MegAlign 将测序结果进行对比,寻找SNP 位点并利用在线预测网站分析Slc7a11 蛋白质的结构和功能(表3)。
1.5 Slc7a11基因克隆和真核表达载体构建
Slc7a11 基因PCR 产物切胶回收后与pEGFPN1 载体进行连接,经转化、克隆提取后用HindⅢ和SacⅡ双酶切鉴定。pEGFP-N1 载体为本实验室保存。
1.6 转染
所用细胞为实验室保存的RAB-9 细胞(购于ATCC),将细胞从液氮中取出立即放入37 ℃水浴中快速解冻并接种于M254 培养基中加入10%血清。
试验设置空白组、阴性对照组、试验组,将RAB-9 细胞转移到24 孔板的培养板上,每孔至少接种1×105个,在黑色素细胞状态良好覆盖率约80%时进行转染,通过荧光显微镜观察转染情况和RT-PCR 检测mRNA 水平。阴性对照组为转染的空质粒,过表达组为转染的重组质粒pEGFP-N1-Slc7a11。
1.7 数据处理
采用2-△△Ct相对定量法进行统计分析。计算公式:△Ct=Ct目的基因-Ct内参基因;△△Ct=△Ct待测样品中的对照基因-△Ct对照样品中的目的基因;相对样品模板量=2-△△Ct。所有定量数据用GraphPad Prism5.0 进行统计分析,试验数据结果均用平均数±标准差(X±SD)表示。

表1 Slc7a11 外显子和CDS 区引物序列Table 1 Primer sequence of Slc7a11 exons and CDS region
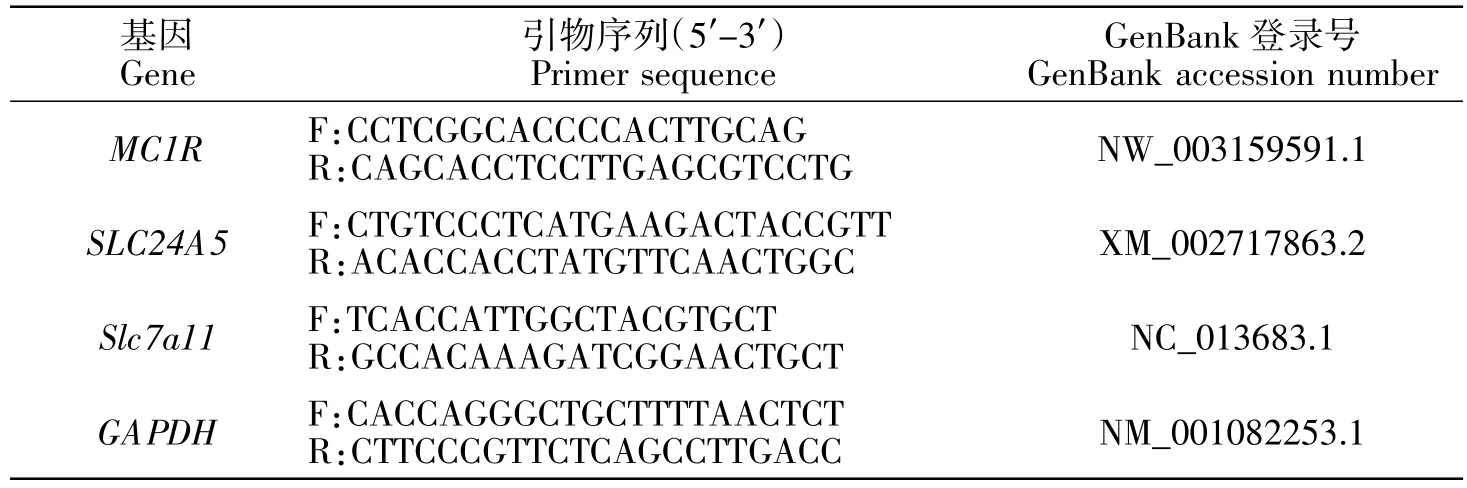
表2 荧光定量引物Table 2 qPCR primer sequence

表3 蛋白质结构功能预测方法及相关网址Table 3 Protein structure function prediction method and related web site
2 结果与分析
2.1 兔Slc7a11基因序列的分析
本研究测定家兔Slc7a11 基因全长序列,包含完整的CDS 区序列1 509 bp,编码502 个氨基酸,12 个外显子,11 个内含子,基因结构如图1 所示。A、T、C、G 的平均含量分别为 23.33%、29.75%、23.92%、22.93%,A+G 含量为 53.08%,G+C 含量为46.85%。利用ProtScale 分析蛋白质疏水性和亲水性,发现等电点为9.5,不稳定系数为117.83,GRAVY 值为0.672,说明Slc7a11 为碱性不稳定疏水性蛋白;蛋白质二级结构有25.10%的阿尔法螺旋;29.08%延伸链;45.82%无规则有卷曲(图2);TMHMM2.0 预测结构域发现有12 个跨膜区,是一个与细胞信号传导无关的膜受体蛋白。

图1 Slc7a11 基因结构图Figure 1 Slc7a11 gene structur diagram

图2 Slc7a11 蛋白质二级结构预测Figure 2 Prediction of secondary structure of Slc7a11 protein
2.2 Slc7a11基因多态性分析
针对獭兔Slc7a11 基因12 个外显子设计特异性引物,在4 种毛色群体中进行PCR 扩增。经PCR-SSCP 方法检测时未发现不同带型(图3),进一步进行测序分析,也未在12 对外显子扩增产物中发现SNP 位点(图4),故认为獭兔Slc7a11 基因没有多态性。

图3 不同毛色獭兔Slc7a11 基因外显子PCR-SSCP产物分析Figure 3 Analysis of PCR-SSCP products of Slc7a11 exon in different color-colored Rex Rabbits
2.3 pEGFP-N1-Slc7a11真核表达载体的构建
用浓度为1.5%琼脂糖凝胶电泳检测是否为目的片段,以DL=2 000 Marker 为参照,目的片段为1 509 bp(图5A),扩增结果条带单一,无杂带,经测序对比确认为目的序列。将Slc7a11 PCR 产物切胶回收后与pEGFP-N1 质粒载体连接,经克隆提取后用HindⅢ和SacⅡ双酶切鉴定(图5B),Slc7a11 基因CDS 区片段与预期大小相同,证明pEGFP-N1-Slc7a11 过表达载体构建成功,可用于后续试验。

图4 Slc7a11 外显子测序结果Figure 4 Sequencing results of Slc7a11 exons
2.4 pEGFP-N1-Slc7a11在RAB-9细胞中的转染
在RAB-9 细胞状态良好汇合度约80%时进行转染,通过荧光显微镜观察转染情况和RT-PCR 检测Slc7a11 mRNA 水平,结果表明过表达载体可以在RAB-9 细胞中正常表达,且过表达后的载体极显著提高了 Slc7a11 基因的表达量(P<0.05)(图 6~7)。
2.5 Slc7a11过表达对黑色素生成相关基因的影响
通过荧光定量q-PCR 方法检测Slc7a11 过表达后对MC1R、SLC24A5 黑色素生成相关基因的表达量的影响,结果发现Slc7a11 的过表达会提高相关基因的表达量(P<0.05),与Slc7a11 基因表达情况一致(图 8)。

图5 Slc7a11 基因PCR 电泳产物Figure 5 Result of Slc7a11 electrophoresis analysis

图6 Slc7a11 转染黑色素细胞Figure 6 Slc7a11 transfection into fibroblasts
3 讨论
在成年动物中,毛色和皮肤的颜色都取决于位于皮肤表皮底层的黑色素细胞产生的色素类型[15]。在哺乳动物和鸟类皮肤中发现的黑色素细胞产生两种黑色素,一是真黑色素产生黑色和棕色,二是褐黑素呈现黄色和红色[16]。毛色是受色素生物合成过程中不同基因控制的,其颜色的不同主要由于褐黑色素和真黑色素的不同比例而产生。黑色素的质量和比例可以改变色素沉着,导致皮肤、羽毛和眼睛虹膜颜色改变[17]。溶质转运家族(solutecarrierfamily,SLC)是存在于哺乳动物细胞中主要的膜转运蛋白成员[18]。Slc7a11 就是SLC 家族的成员之一,涉及褐黑素生成、细胞迁移和增殖的过程[11]。它能控制褪黑色素合成从而影响到褐黑素与真黑素的比例,进而控制动物体内被毛颜色这两种色素[19]。Slc7a11 基因突变的小鼠(sut)毛发中表现为明显的伪黑色素水平降低,而真黑色素水平基本不变,从而使黄色背景的野生型小鼠表现为灰色[20]。李洪涛等[10]通过研究Slc7a11 基因在3 种毛色的哈萨克羊皮肤中的表达水平,发现皮肤中表达水平最高的是棕色被毛,其次是黑色和白色,这说明Slc7a11 基因与哈萨克羊毛色表型有相关性。何新等[18]利用转睾丸注射转基因技术,成功获得选择性过表达sxCT 的转基因绵羊,绵羊的被毛出现棕黄色斑点,增加了伪黑色素的含量,从转基因角度证实了该基因对绵羊毛色的调控作用。

图7 Slc7a11 基因在黑色素细胞中的过表达检测Figule 7 Detected result of Slc7a11 over-express melanocytes
基因组DNA 中任何碱基都有可能发生突变,所以SNP 既可能出现在编码区中也可能出现在非编码区中,SNP 多数存在于内编码区中,如果编码区中发生碱基突变很有可能导致基因功能发生改变,从而影响动物的表型。本试验对獭兔Slc7a11 基因的12 个外显子进行SNP 检测,均未发现突变位点。何军敏等[21]对哈萨克羊的Slc7a11 基因检测也未发现多态性的存在。未能在该基因中检测出SNP,说明该基因编码序列较为保守。
有研究报道,哺乳动物MC1R 基因主要在毛囊和皮肤黑色素细胞中表达[22]。该基因的高表达有利于黑色素细胞中真黑素的形成,动物毛色表现黑或褐毛色类型,说明细胞中真黑素含量较高[23]。

图8 Slc7a11 过表达对毛色生成相关基因的表达影响Figure 8 The effect of Slc7a11 over-expression on the expression of coat color related genes
SLC24A5 基因是溶质载体24 家族的一个成员,依赖于钾离子钠/钙阳离子的交换体。R.L.Lamason等[24]研究证实金色表型的斑马鱼是由SLC24A5 基因变异引起的,CDs 区208 位点半胱氨酸突变为终止密码子导致黑色素体变小、密度降低,从而造成黑色素沉积的延缓。此外,SLC24A5 能改变黑素体的pH 值,从而影响酸酶的活性。亦有研究表明SLC24A5的减少将导致黑素体pH 值降低,变酸的黑素体使酪氨酸酶活性降低,导致真黑素生成量减少[25]。前期本课题组通过试验对该基因在不同毛色獭兔中mRNA 表达量的结果分析发现Slc7a11 基因在蛋白黄獭兔皮肤中的表达量最高,与白色、蛋白青和蛋白黄结果呈差异极显著(P<0.01)[26]。为了进一步研究Slc7a11 基因与毛色生成的相关性,本试验通过构建过表达载体pEGFP-N1-Slc7a11,提高其在黑色素细胞中的表达,然后检测MC1R、SLC24A5 在黑色素细胞中的表达量,发现试验组相对高于阴性对照组,黑色素相关基因的表达量显著提高(P<0.05)。这些基因在Slc7a11 基因过表达后,表达量均显著提高。Slc7a11 基因影响了黑色素生成基因,其与毛色形成密切相关,本试验为进一步研究Slc7a11 基因对毛色生成的影响提供科学依据。

