前房及玻璃体注药、小梁切除术联合全视网膜光凝序贯治疗老年新生血管性青光眼临床观察
新生血管性青光眼(neovascular glaucoma,NVG) 是一种高致盲性眼疾,主要继发于视网膜中央静脉阻塞、糖尿病视网膜病变、眼缺血综合征等疾病,眼部肿瘤和眼外伤亦可引起NVG[1-3]。病人临床表现为难以耐受的眼痛和头痛。NVG的治疗方法视病人视力是否丧失而定,对于视力完全丧失者可采用破坏性手术,如周边视网膜及睫状体冷冻术、睫状体光凝术等解除疼痛;而对于视力尚存病人,其治疗的目的是最大限度保留视功能。传统的NVG治疗方法主要有药物降低眼压和小梁切除术,但2种方法单独应用效果均不理想。近年来,抗血管内皮生长因子药物的应用为NVG的治疗带来了新理念[4]。我院采用先于前房及玻璃体注入抗血管内皮生长因子药物,进行小梁切除术控制眼压后,再行全视网膜光凝术(PRP)治疗,取得了良好的效果,现报道如下。
1 资料与方法
1.1 一般资料 选择我院2017年4月至2018年4月NVG且药物控制眼压不良的老年病人23例,其中男16例,女7例,年龄60~78岁,平均(69.4±8.2)岁。视网膜中央静脉阻塞5例,增生性糖尿病视网膜病变16例,视网膜分支静脉阻塞2例,其中5例病人术前接受过人工晶状体植入术,病人既往均无青光眼手术史。纳入标准:(1)明确诊断的NVG伴视网膜病者,无明显前房积血或玻璃体出血,能耐受小梁切除术和PRP治疗;(2) 病人均服用4~6种药物治疗,但眼压控制不良。排除标准:(1) 眼部有明显炎症或先天性异常者;(2) 视网膜脱落病人;(3)合并严重的全身性疾病病人。
1.2 治疗方法 均采用前房及玻璃体注药、小梁切除术联合PRP序贯治疗。(1)前房及玻璃体注药:病人入院后先采用药物治疗控制眼压,药物控制不良者行前房穿刺放液,待眼压下降后,取平卧位,给予雷珠单抗注射液各0.5 mg分别注射于玻璃体内和前房,注药后询问病人有无眼胀难忍、光感消失,观察针眼无渗液后用抗生素滴眼液滴眼,包扎术眼,2 h后测量眼压,若眼压高于40 mmHg,给予降眼压药物,必要时前房穿刺放液。(2)小粱切除术:病人前房及玻璃体注药后密切观察虹膜新生血管情况,其中4例病人注药后3 d新生血管消退后行小梁切除术,其余病人分别于4~10 d行小梁切除术,术后可根据眼压和滤过泡情况进行调节,常规给予抗炎、抗感染治疗。(3)PRP:小梁切除术后根据病人恢复情况,于5~7 d使用532激光,光斑直径为200~300μm,功率为100~300 mW,曝光时间为0.15~0.25 s,间隔0.5 PD,每次约1000~1200点,总点数2000~2400个,以视网膜出现3级光斑为准。分2次完成,间隔1周。
1.3 观察指标 术后不定期随访,至2019年1月末次随访,检测病人眼压、视力,观察虹膜、角膜、房角新生血管情况,记录治疗前、后病人用药种类变化和并发症。视力包括手动(只能看清眼前有手动,但不能分清有几根手指)、眼前数指(能分清有几根手指)、光感和无光感。
1.4 疗效标准 完全成功:治疗后不使用降眼压药物的情况下眼压<22 mmHg;部分成功:比术前降眼压药物减少≥2种,眼压<22 mmHg;失败:治疗后眼压仍≥22 mmHg,需用治疗前同样种类的药物控制眼压[5]。

2 结果
2.1 疗效观察 随访8~24个月,平均随访(19.8±3.7)个月,完全成功19例,完全成功率为82.61%,部分成功4例,部分成功率为17.39%,失败0例。
2.2 眼压和药物使用情况 治疗后病人平均眼压明显低于治疗前,平均应用药物种类明显少于治疗前,差异有统计学意义(P<0.01)。见表1。
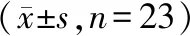
表1 治疗前后眼压、应用药物种类比较
注:与治疗前比较,**P<0.01
2.3 视力和新生血管消退情况 治疗后病人视力较治疗前明显提高,差异有统计学意义(P=0.031)。见表2。治疗后新生血管完全消退18例,完全消退率为78.26%,5例残余少量新生血管。所有病人眼底激光斑形成良好,无1例出现虹膜新生血管。

表2 治疗前后视力变化情况比较(n,%,n=23)
2.4 并发症情况 1例病人术后结膜切口裂开,再次行结膜缝合术后伤口痊愈出院,并发症发生率为4.35%。
3 讨论
NVG的致盲率可达92.4%,其治疗较为棘手,属难治性青光眼之一,发病原因主要为视网膜血流供应减少出现缺氧缺血,导致血管内皮生长因子增加,使虹膜、小梁网及房角生成大量新生血管,引起房角和小梁网阻塞和进行性关闭,房水的正常流出通道被阻塞而出现眼压升高,造成眼部疼痛。随着眼压的不断升高,视网膜缺血缺氧状态不仅未得到改善,而且还加重了视神经的损害[6-7]。NVG病情进展快,根据NVG病情的发展可分为虹膜红变、开角和闭角三期。虹膜红变期为病变初期,这一时期病人眼压尚正常,也无明显的眼胀、眼痛症状,只在原发视网膜缺血基础上从瞳孔缘发生虹膜新生血管,于虹膜基质表面呈放射状分布,随后出现在房角;随着病情进展,病人眼压逐渐升高,房角和虹膜新生血管逐渐增多,但房角仍维持开放进入,此阶段属于开角期;进入闭角期后,房角纤维血管膜收缩,周边虹膜开始出现黏连,并相互连接,房角关闭,导致小梁网受到永久的损害,病人可能伴有虹膜基质变平,而且眼压升高难以控制[8]。
NVG 的治疗方法包括病因治疗和对症治疗,病因即缺血缺氧的治疗,而对症治疗则是采用药物和手术降低眼压。但单一针对病因的治疗和控制眼压的对症治疗效果均不理想,在新生血管未消退前行小梁切除术甚至可能发生术中或术后出血,特别是闭角期病人,由于长期持续的高眼压和角膜水肿,虹膜和房角密布新生血管,以及眼部的炎症充血,大大增加了小梁切除术失败的风险[9],因此在对症治疗的同时联合病因治疗或许可获得较好的疗效。PRP是治疗视网膜缺血缺氧的有效方法,可减少血管内皮生长因子产生,还可治疗视网膜中央静脉阻塞、增生性糖尿病视网膜病变等原发性视网膜疾病[10]。本研究纳入的老年病人均为降眼压药物治疗无效者,先于前房及玻璃体注入雷珠单抗,注药后虹膜新生血管消退,前房炎症反应减轻后,再行小梁切除术。此时由于虹膜新生血管消退,眼压下降,术中无1例病人发生前房出血,为PRP创造有利条件。而且PRP不受手术伤口愈合时间限制,激光可及范围比裂隙灯下更广,透视度也优于裂隙灯,对于瞳孔不能充分散大病人尤其适用。本研究显示,23例病人术后平均随访(19.8±3.7)个月,完全成功率为82.61%,部分成功率为17.39%,失败0例,取得了较好的效果。病人治疗后平均眼压、应用药物种类明显低于治疗前,视力较治疗前有明显提高。而且18例病人治疗后新生血管完全消退,完全消退率为78.26%。所有病人眼底激光斑形成良好,无1例出现虹膜新生血管。
综上所述,前房及玻璃体注药、小梁切除术联合PRP序贯治疗老年NVG方法安全可靠,可在抗血管内皮生长因子及外引流作用的有效期内完成PRP,有效防止虹膜新生血管复发。而且该治疗方法适用范围广,人工晶状体眼和瞳孔散大不理想病人均可采用,在控制高眼压的同时可尽可能地挽救病人视功能,而且手术风险小,安全性好,值得推广。

