剂量-体积联合等效均匀剂量优化在舌癌放疗中的应用研究
贾晓斌,董晓庆,袁峥玺,岳 堃*
(1.上海交通大学医学院附属第九人民医院放疗科,上海 201900;2.同济大学附属第十人民医院放疗科,上海 200072)
0 引言
近年来,随着放疗技术水平的发展,调强放射治疗被广泛应用于各类肿瘤治疗[1-2]。然而受危及器官(organ at risk,OAR)约束条件、解剖结构复杂及处方剂量等因素限制,靶区内受照剂量往往呈现不均匀性。相关研究表明,剂量不均匀性将严重影响实际的有效照射剂量[3]。当前治疗计划系统(treatment planning system,TPS)普遍采用基于剂量-体积的目标函数,然而这些目标函数在临床使用中存在一系列问题[4]:(1)单纯的一个剂量-体积目标函数可以对应多组剂量体积直方图(dose volume histogram,DVH)曲线,但每组受照组织的DVH曲线产生的辐射损伤完全不同。(2)对于同一受照组织,不同DVH曲线表现的剂量分布可以造成相同的辐射损伤,但是对周围的正常组织及肿瘤的影响却完全不同。(3)基于DVH曲线优化的目标函数在达到函数设定时,TPS会停止优化。与传统物理剂量优化准则相比,等效均匀剂量(equivalent uniform dose,EUD)优化方法有以下优点:(1)EUD目标函数考虑受照组织所有体素的影响,可以对DVH曲线中任意局部或整体剂量加以限制。(2)通过改变组织体积特性参数a值大小,EUD计算公式即可适用于靶区和危及器官。
本文以舌癌放疗计划为例,将EUD目标函数作为靶区及正常组织的优化条件,通过比较不同约束条件的优化结果,评价EUD目标函数在不同受照器官中的应用。
1 EUD概念
Niemierko教授[5]于1995年首次提出EUD模型。早期的EUD计算模型过于复杂,1999年Niemierko[6]依据韦伯-费希纳-斯蒂文斯定律,简化了EUD相关计算公式,提出了广义范围的EUD计算公式,该公式适用于肿瘤及正常组织。

其中,Vi为受照组织中的任意体素,n为受照器官内体素的个数,Di为每个体素中的点剂量,a为不同组织的体积特性参数。依据临床经验及受照组织的特性,a<0多用于肿瘤靶区优化;a>1主要用于正常组织保护;a=1时等同于平均剂量。该模型被广泛应用于各大商用TPS中。本文使用VarianEclipse13.6计划系统,该TPS基于广义EUD概念内置3种g-EUD目标函数,即Target g-EUD目标函数、Lower g-EUD目标函数和Upper g-EUD目标函数。其中,Target g-EUD和Lower g-EUD适用于靶区优化,Upper g-EUD适用于正常组织限量。
2 资料与方法
2.1 病例资料
随机选取16例从2016年1月到2017年12月我院放疗科收治的舌癌术后患者,其中男10例、女6例,年龄范围54~79岁(中位年龄59.7岁)。纳入标准:所有患者病理分期均为T2-3N1-2M0,筛选数据经医院伦理委员会审批。
2.2 CT模拟定位
所有患者均采取仰卧位,在正常呼吸状态下,采用全碳纤维头颈肩固定底板和聚酯塑料头枕,头部覆盖热网膜固定。CT扫描范围从颅底骨到第7颈椎下缘,扫描层厚2.5 mm。由本院放疗科同一医师参照ICRU83号报告勾画患者临床靶区(clinical target volume,CTV)、计划靶区(planning target volume,PTV)和OAR。高危亚计划靶区及高危淋巴结区(PTV60)照射剂量60 Gy/30次;侧颈部低危预防区(PTV54)照射剂量54 Gy/30次;靶区内最大剂量(Dmax)不高于处方剂量的110%。
2.3 放疗计划的制订
基于Varian Eclipse 13.6计划系统和Varian EDGE加速器,对同一位患者制定3组逆向调强计划,第一组计划使用传统物理剂量-体积优化(Plan-DV);第二组计划在Plan-DV基础上对PTV60及PTV54增加靶区EUD目标函数(Target g-EUD);第三组计划在Plan-DV基础上对脊髓、脑干、腮腺和喉增加OAR EUD目标函数(Upper g-EUD)。所有计划采用9野均分共面调强技术(剂量率600 MU/min)和Sliding Window技术。射野分布及患者三维模型图如图1所示。
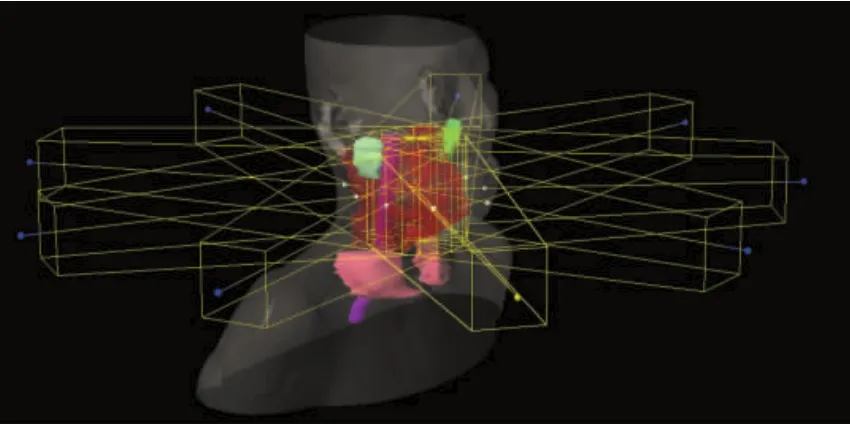
图1 射野分布及患者三维模型图
2.4 计划评估
为方便横向对比各组计划,对所有计划剂量结果进行归一化处理,使高危亚计划靶区及高危淋巴结区处方剂量覆盖95%PTV60体积,得到DVH曲线数据结果并进行分析。靶区剂量学评估参数包括2%体积所受到的照射剂量(D2)、50%体积所受到的照射剂量(D50)、98%体积所受到的照射剂量(D98)、靶区适形度指数(conformity index,CI)和靶区均匀性指数(homogeneity index,HI)。
依据ICRU83报告,PTV CI定义为

其中,VT,ref表示95%处方剂量包含的PTV体积,Vref表示95%处方剂量覆盖的总体积,VT表示PTV体积。CI取值0到1,数值越大表示适形度越好。
PTV HI定义为

HI数值越接近0表明均匀度越好。
OAR依据并发症毒副反应与受照剂量体积的关系分为2组。对于串行组织:脊髓Dmax<40 Gy;脑干Dmax<54 Gy。对于并行组织:腮腺平均剂量(Dmean)<26 Gy,30 Gy 受照体积占比(V30)<50%;喉Dmean<35 Gy,50 Gy受照体积占比(V50)<20%;咽缩肌 PCMDmean<45 Gy;口腔Dmean<35 Gy。
2.5 统计学方法
通过数据统计软件IBM SPSS19对上述剂量学参数采用配对t检验,P<0.05为差异有统计学意义。
3 结果
3.1 Plan-DV与Target g-EUD比较
Plan-DV与Target g-EUD在靶区的剂量分布差异性较小,如图2所示。由表1可以看出,2组计划的PTV60及PTV54的D2均呈现显著性差异(P<0.05);对于D50而言,2组计划的PTV60存在显著性差异(P<0.05),而PTV54则无统计学差异;2组计划的D98无显著性差异(P>0.05);对于 CI而言,2 组计划的PTV60存在显著性差异(P<0.05);对于HI而言,PTV60呈现显著性差异(P<0.05),而 PTV54无显著性差异。2组计划的OAR剂量学比较均无显著性差异,见表2。

图2 Target g-EUD计划和Plan-DV计划剂量分布图
表1 Plan-DV与Target g-EUD靶区剂量学对比(±s)

表1 Plan-DV与Target g-EUD靶区剂量学对比(±s)
P T V 5 4 D 2/c G y D 50/c G y D 98/c G y C I H I D 2/c G y D 50/c G y D 98/c G y H I P l a n-D V 6 2 7 2.7 6±2 9.1 2 6 1 5 4.1 8±1 5.2 7 5 9 3 3.5 7±1 0.5 6 0.9 2 8 4±0.0 2 0.0 5 5±0.0 1 5 6 0 7.6 9 0±1 9.4 1 5 5 3 0.9±2 5.3 9 5 4 8 1.8 1±2 8.6 3 0.0 4 4±0.0 1 T a r g e t g-E U D 6 2 6 2.6 8±3 1.3 2 6 1 4 7.7 9±1 7.5 0 5 9 3 4.3 4±9.9 3 0.9 2 9 9±0.0 2 0.0 5 3±0.0 1 5 5 9 6.0 3±1 8.2 7 5 5 2 5.9 8±2 2.0 4 4 9 0.9 0±2 5.3 3 0.0 4 1±0.0 1 t 2.6 7 6 2.2 8 1 -0.5 9 1 0.8 0 2 -2.3 6 5 2.1 7 2 -0.4 7 0 -0.7 1 1 1.3 2 2 P 0.0 1 7 0.0 1 4 0.5 6 3 0.0 2 8 0.0 3 3 0.0 4 8 0.6 4 6 0.6 4 6 0.2 0 7调强计划 P T V 6 0
表2 Plan-DV与Target g-EUD OAR剂量学对比(±s)

表2 Plan-DV与Target g-EUD OAR剂量学对比(±s)
调强计划 脊髓D max/c G y 脑干D max/c G y 喉 左侧腮腺 右侧腮腺 咽缩肌D mean/c G y D mean/c G y V 50/% D mean/c G y V 30/% D mean/c G y V 30/%P l a n-D V 3 4 5 4.3 5±8 9.0 0 3 1 6 1.9 0±4 0 6.5 6 2 9 6 3.5 3±7 4.7 9 0.5 0±0.6 1 2 2 6 5.3 6±4 0.8 4 2 7.2 8±4.9 2 2 2 8 8.0 0±3 7.4 8 2 4.9 9±4.7 4 3 9 5 6.4 0±2 7 9.6 0 T a r g e t g-E U D 3 4 5 6.9 9±7 8.0 5 3 1 9 7.8 3±3 6 9.8 5 2 9 6 6.2 0±3.2 0 0.6 0±0.6 0 2 2 7 2.8 5±4 2.3 0 2 8.1 2±5.3 7 2 2 7 8.1 5±3 1.3 3 2 5.2 9±4.8 5 3 9 2 7.1 5±3 1 0.1 0 t 2.9 4 2 -1.1 4 2 0.5 5 9 -1.3 7 8 -0.8 2 8 -1.0 9 2 2.0 6 9 0.5 7 3 0.3 7 6 P 0.1 1 0 0.2 7 8 0.5 8 5 0.1 9 0 0.4 2 1 0.2 9 3 0.0 5 8 0.5 7 6 0.7 1 2
3.2 Plan-DV与Upper g-EUD比较
2组计划的靶区剂量分布无明显差异,但Upper g-EUD计划中腮腺中高剂量受照区域显著减少,如图3所示。由表3可以看出,2组计划的PTV60的HI存在显著性差异(P<0.05),其他指标均无显著性差异。由表4可以看出,串行组织脊髓和脑干的Dmax分别降低了52.16和166.02 cGy,两者均呈现显著性差异(P<0.05)。对于并行组织,Upper g-EUD 计划中喉和左侧腮腺的Dmean均小于Plan-DV,两者呈现显著性差异(P<0.05);喉部V50降低了 0.321%且具有统计学差异(P<0.05)。左侧腮腺和右侧腮腺的V30分别降低了3.72%和4.55%,两者具有统计学差异(P<0.05)。

图3 Upper g-EUD计划和Plan-DV计划剂量分布图
4 讨论
4.1 靶区优化
近年来,国内对EUD函数在靶区的应用研究不多。早期友文乐等[7]、廖雄飞等[8]在单用EUD函数优化靶区过程中,发现靶区经常存在高剂量区,剂量分布不均匀。原因主要是a<0的EUD函数虽然可以显著提高靶区低剂量区受照体积,但无法限制靶区内高剂量。因此,对均匀性要求较高的靶区需要将EUD目标函数结合物理约束条件使用。国内相关学者[9]利用这种方法优化靶区取得了良好的效果。依据实际情况,Varian Eclipse计划系统提供2种EUD目标函数:Lower g-EUD函数和Target g-EUD函数。Lower g-EUD函数可以显著提高靶区低剂量区,但是往往导致靶区出现局部高剂量,均匀性变差,适用于诸如立体定向放射治疗(stereotactic body radiation therapy,SBRT)或高剂量不限的靶区。Target g-EUD函数则在显著提高靶区低剂量区受照体积的同时抑制靶区局部高剂量的出现,改善靶区均匀度和适形度,适用于对均匀度要求更高的靶区。本文根据临床病灶类型选取Target g-EUD函数作为优化参数。本研究中发现,相较于传统的物理剂量-体积优化,Target g-EUD函数结合物理剂量-体积优化可以在一定程度上改善靶区的适形度和均匀度。然而笔者在对PTV60和PTV54的低剂量区比较时发现,Target g-EUD计划与Plan-DV计划却无显著性差异。这主要是因为笔者对所有计划做了归一化处理,消除了靶区低剂量区受照体积差异性。
表3 Plan-DV与Upper g-EUD靶区剂量学对比(±s)

表3 Plan-DV与Upper g-EUD靶区剂量学对比(±s)
P T V 5 4 D 2/c G y D 50/c G y D 98/c G y C I H I D 2/c G y D 50/c G y D 98/c G y H I P l a n-D V 6 2 7 2.7 6±2 9.1 2 6 1 5 4.1 8±1 5.2 7 5 9 3 3.5 7±1 0.5 6 0.9 2 8 4±0.0 2 0.0 5 5±0.0 1 5 6 0 7.6 9±1 9.4 1 5 5 3 0.9 0±2 5.3 9 5 4 8 1.8 1±2 8.6 3 0.0 3 4 6±0.0 1 T a r g e t g-E U D 6 2 8 1.8 1±3 2.0 0 6 1 6 0.3 1±1 7.6 7 5 9 3 2.0 7±1 0.8 1 0.9 2 2 9±0.0 2 0.0 5 6±0.0 1 5 6 1 0.0 2±2 0.0 9 5 3 6 6.0 4±4 9.1 2 5 4 7 7.2 3±3 9.1 2 0.0 3 3 4±0.0 1 t-2.2 5 7 -2.1 5 4 1.7 9 4 2.4 4 8 2.8 2 4 -0.4 4 5 0.3 4 4 0.4 5 2 1.0 4 3 P 0.0 6 1 0.0 5 0 0.0 9 4 0.0 5 8 0.0 1 4 0.6 6 3 0.7 3 6 0.2 1 1 0.3 1 5调强计划 P T V 6 0
表4 Plan-DV与Upper g-EUD危及器官剂量学对比(±s)
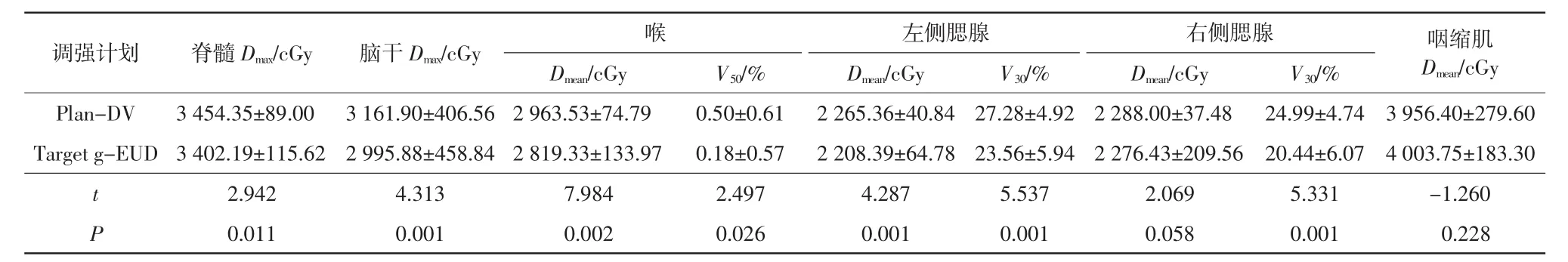
表4 Plan-DV与Upper g-EUD危及器官剂量学对比(±s)
调强计划 脊髓D max/c G y 脑干D max/c G y 喉 左侧腮腺 右侧腮腺 咽缩肌D mean/c G y D mean/c G y V 50/% D mean/c G y V 30/% D mean/c G y V 30/%P l a n-D V 3 4 5 4.3 5±8 9.0 0 3 1 6 1.9 0±4 0 6.5 6 2 9 6 3.5 3±7 4.7 9 0.5 0±0.6 1 2 2 6 5.3 6±4 0.8 4 2 7.2 8±4.9 2 2 2 8 8.0 0±3 7.4 8 2 4.9 9±4.7 4 3 9 5 6.4 0±2 7 9.6 0 T a r g e t g-E U D 3 4 0 2.1 9±1 1 5.6 2 2 9 9 5.8 8±4 5 8.8 4 2 8 1 9.3 3±1 3 3.9 7 0.1 8±0.5 7 2 2 0 8.3 9±6 4.7 8 2 3.5 6±5.9 4 2 2 7 6.4 3±2 0 9.5 6 2 0.4 4±6.0 7 4 0 0 3.7 5±1 8 3.3 0 t 2.9 4 2 4.3 1 3 7.9 8 4 2.4 9 7 4.2 8 7 5.5 3 7 2.0 6 9 5.3 3 1 -1.2 6 0 P 0.0 1 1 0.0 0 1 0.0 0 2 0.0 2 6 0.0 0 1 0.0 0 1 0.0 5 8 0.0 0 1 0.2 2 8
4.2 OAR优化
当前,主流TPS对OAR主要采用最大剂量约束和剂量-体积约束,这类约束条件面对不均匀照射时往往无法反映OAR的真实受照剂量。EUD目标函数则考虑到受照器官所有体素的剂量贡献,可以对DVH曲线中任意局部或全局的剂量-体积加以限制,降低高剂量对该OAR及周围OAR的辐射损伤。鉴于其对正常组织的保护作用,EUD目标函数被广泛应用于不同类型的肿瘤调强计划中[10-15],但部分学者认为在头颈部的表现更好。这主要由于头颈部的靶区位置与OAR重叠区域较小,各类OAR如双侧腮腺和喉体积较小,因而EUD目标函数使用效果明显。胡海芹等[16]将EUD目标函数用于鼻咽癌OAR优化中,发现显著降低了腮腺的Dmean。胡邦等[17]则将EUD目标函数运用在对颞叶的保护中,并取得了良好的效果。上述研究均表明EUD目标函数能显著地降低不同类型OAR的受量。在本研究中,笔者发现无论是串行组织(脑干、脊髓)还是并行组织(腮腺、喉等),EUD目标函数虽然能较好地约束OAR的高剂量区体积,但可能会导致靶区PTV60均匀性降低,这一结果与左宇浩等[18]研究结果基本一致。主要是由于:对正常组织来说,Upper g-EUD会显著地影响与靶区邻近的OAR中高剂量区的剂量分布,造成靶区边缘剂量缺失,影响均匀性。
综上所述,相较于传统的物理剂量-体积优化计划,基于Target g-EUD目标函数优化的计划可以显著地提高靶区的适形度和均匀度,基于Upper g-EUD目标函数优化的计划在不影响靶区受照剂量的同时可以大幅度降低OAR的受量。因此,从剂量学的角度来说g-EUD优化具有一定的临床实践意义。当然,本文并未进一步比较及分析不同a取值对同一受照组织的影响,将在后期进行研究。

