旋毛虫感染早期小鼠肠道病理变化及免疫调节相关细胞因子表达的研究
宋伊宁,徐 静,庞建达,王昕蕊,刘晓雷,刘明远,孙树民,
旋毛虫是一种雌雄异体线虫,可感染包括人类在内的所有哺乳动物、部分食肉鸟类及爬行动物,能够引发严重的人兽共患传染病,对人类和动物健康、社会及经济发展产生极大负面影响[1]。尽管旋毛虫病在欧洲和美国得到良好控制,但在中国、阿根廷和东欧等发展中国家和发达国家仍有流行[2]。研究[3]发现旋毛虫入侵宿主机体不是简单的机械性渗透的结果[4]。尽管旋毛虫的感染可诱导机体产生抗体等获得性免疫效应,但是这些免疫效应并不能完全抑制旋毛虫的生长发育,机体处于一种慢性持续感染的状态,表明旋毛虫能够抑制和逃避宿主免疫反应[5]。旋毛虫可能借助自身的蛋白发挥侵袭和寄生作用,其免疫机制在旋毛虫发育、侵袭和寄生过程中起着重要作用[6]。近年来,旋毛虫诱导宿主产生的免疫抑制作用备受关注,这种由旋毛虫感染诱导宿主产生的免疫抑制作用对过敏性疾病、自身免疫性疾病、肿瘤的发生和发展有着极大的推动作用,并为以上几类疾病的研究和防控提供了新的思路和转机[7-10]。
旋毛虫不同发育时期产生的期特异性抗原可诱导宿主机体产生免疫应答[11-12]。多项研究表明旋毛虫感染早期可诱导宿主产生免疫抑制作用,在这一阶段虫体发育迅速,虫体形态和分泌产物不断变化,经历了感染性幼虫的快速脱囊,侵入肠粘膜上皮细胞,4次蜕皮发育为成虫,雌雄成虫交配,雌虫于感染后第4 d开始产新生幼虫,最后新生幼虫随血液或淋巴液迅速移行并侵入骨骼肌的复杂发育变迁过程。据此推测旋毛虫发育早期约6 d时间内的不同时间点对宿主的免疫调节存在复杂性和波动性。旋毛虫感染抑制Th1 / Th17应答的同时诱导Treg细胞减少炎症反应[13],Th1 / Th2细胞对机体免疫功能的平衡有着至关重要的作用,平衡遭到破坏致使机体处于感染状态[14]。根据这一特性,本研究检测了旋毛虫感染早期的4个关键时间节点小鼠肠系膜淋巴结相关细胞因子的表达情况,并进行了病理切片染色观测,探究旋毛虫感染早期对宿主免疫调节的机制。
1 材料与方法
1.1试验动物及旋毛虫虫种 BALB/c鼠:6~8周,18~25 g,雌性,购自吉林大学医学部动物中心。
旋毛虫虫种:中国河南猪旋毛虫分离株(T1),标准国际虫种编号ISS534,由吉林大学人兽共患病研究所提供。
1.2主要试剂及仪器 无水乙醇、二甲苯、石蜡、液氮、眼科剪、眼科镊、45 mm灌胃针、载玻片、苏木素伊红(HE)染液购自无锡市江原实业技贸总公司、MSD试剂盒(货号:K150691-1)购自上海优宁维生物科技股份有限公司、读板液购自上海优宁维生物科技股份有限公司、倒置显微镜(日本OLYMPUS公司)、KD202A轮转切片机(浙江金华科迪仪器设备有限公司)、MSD(型号:Quick Plex SQ120)。
1.3旋毛虫攻虫感染 本试验共需48只BALB/c鼠,对其中24只健康鼠按照250条/只灌胃处理,并将剩余24只鼠设置为空白组进行对照。分别在感染后6 h、30 h、3 d、6 d,将试验所需数量的感染鼠和空白鼠处理,无菌条件收集试验材料。
1.4肠道苏木素伊红(HE)染色 于上述4个时间,每组处死3只感染组鼠及3只空白组鼠,无菌条件收集肠道组织。将组织进行常规包埋、切片,烘干后脱蜡。随后加入试剂盒中的苏木素染色液, 室温孵育8 min。蒸馏水洗去多余染液, 使用分化液观察分色情况。蒸馏水漂洗2 min,加入试剂盒中的伊红染液, 室温孵育1 min,蒸馏水冲洗20 s。无水乙醇脱水2 min后,浸入二甲苯透明处理10 min,树胶封片,晾干后拍照。
1.5电化学发光免疫分析技术(MSD)检测 于上述4个时间点,每组处死3只感染组鼠和3只空白组鼠,无菌条件收集肠系膜淋巴结,使用液氮速冻后储存于-80 ℃冰箱中,用于IL-2、IL-4、IL-10、IL-17A、IFN-γ、TGF-β等细胞因子的检测。将300 μL Linker与200 μL对应的生物素标记的抗体混合均匀,室温孵育30 min。随后加入200 μL的终止液混合均匀,室温孵育30 min。包被MSD板,每孔加入50 μL抗体,室温孵育1 h。使用1×PBS (0.05% Tween-20)清洗液将MSD板进行3次循环洗涤后加入25 μL的稀释液,再加入25 μL的样本,封口膜封上后室温振荡1 h。再次清洗MSD板3次后,每孔加入50 μL检测抗体室温振荡1 h。再次清洗MSD板3次,加入150 μL读板液,上机检测,读取结果。
1.6数据处理及统计分析 使用SPSS22.0软件对以上细胞因子试验数据采用t检验方法进行分析,检验水准为α=0.05。根据产生情况及其变化规律,并用GraphPad 5.0软件绘图并分析结果。
2 结 果
2.1肠道苏木素伊红(HE)染色结果 感染后不同时间点小肠病理切片观察,与空白对照组相较,感染后6 h小肠组织炎性细胞浸润;感染后30 h粘膜水肿,炎性细胞显著增多;感染后3 d粘膜炎性细胞浸润,粘膜损伤严重;感染后6 d粘膜及粘膜下层炎性细胞浸润明显,粘膜损伤加重,并伴有水肿。

图1 不同时间点(A-E:空白对照、感染后6 h、30 h、3 d、6 d)肠道组织切片Fig.1 Intestinal tissue sections at different time points (A-E: blank control group,6 h, 30 h, 3 d,6 d after infection)
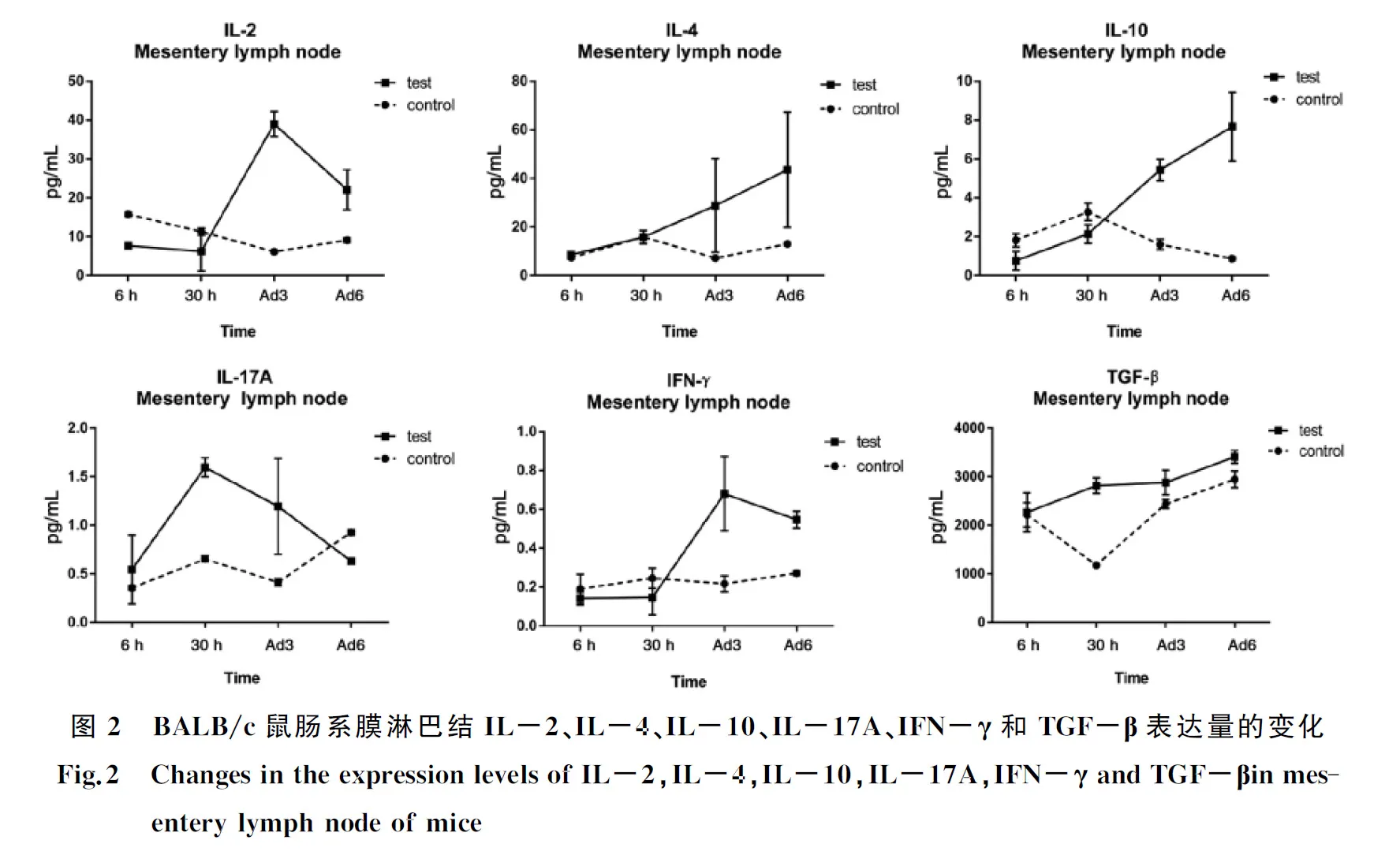
2.2电化学发光免疫分析(MSD)检测结果 与空白对照组相比,感染组肠系膜淋巴结IL-2水平于感染后6 h显著降低,3 d、6 d显著升高,30 h无显著变化;IL-4水平于感染后3 d、6 d显著升高;IL-10水平于感染后6 h、30 h降低,但不显著,3 d、6 d显著升高;IL-17A水平于感染后6 d明显降低,30 h、3 d显著升高;IFN-γ水平于感染后3 d、6 d显著升高;TGF-β水平于感染后30 h显著升高,3 d、6 d升高,但不显著。
3 讨 论
旋毛虫感染的同时对宿主产生强烈免疫调节作用[15-16],大量研究表明在旋毛虫的急性感染期和慢性感染期均可以促进Treg细胞的数量增加,旋毛虫通过一个促使Treg细胞数量增加的网络系统下调宿主的免疫应答情况[17]。此外,旋毛虫对天然免疫系统也存在免疫抑制作用[18]。多数研究检测为1 d以上感染天数的免疫调节情况,本试验对此检测时间提出不同看法,以BALB/c鼠为实验动物,检测旋毛虫感染后肌幼虫L1肠粘膜上皮细胞入侵期(6 h),旋毛虫成虫初形成期(30 h),以及3 d和6 d 4个时期宿主的肠系膜淋巴结免疫应答情况。此外,对4个时间点的感染组及空白组进行了组织切片染色观察。
肠道病理染色结果显示:旋毛虫感染后6 h至6 d肠道的炎症反应随时间延长加重。MSD结果显示免疫抑制存在于6 h时,表现为IL-2作为诱导Th1应答的重要细胞因子水平显著降低,其他细胞因子无显著变化,指示Th1免疫应答受到抑制;感染后30 h,TGF-β和IL-17A水平显著升高,IL-17A作为炎性细胞因子可以强烈招募中性粒细胞,因而提示此时机体处于前炎症反应阶段;感染后3 d和6 d两个时期,Th1型细胞因子(IL-2,IFN-γ)和Th2型细胞因子(IL-4,IL-10)水平均显著升高,提示机体此时处于炎症反应阶段,呈现Th1 / Th2混合型免疫应答,这与Ilic等人[17]的发现近似。本研究发现旋毛虫感染后6 h是旋毛虫(肌幼虫L1)侵入肠系膜上皮细胞的阶段,此时肠道内的Th1型免疫抑制状态有利于旋毛虫(肌幼虫L1)脱囊后至进入肠上皮细胞前免受Th1型免疫的杀伤和清除作用。旋毛虫感染后30 h时已经完成4次蜕皮并发育为成虫,但感染后30 h及更长时间的炎症反应将无法彻底清除全部成虫[19],旋毛虫发育肌幼虫期宿主长期处于Th2型免疫反应,这种免疫反应是虫体不同发育时期长期刺激宿主免疫系统的结果,旋毛虫感染刺激宿主机体导致免疫失衡逐渐趋向Th2型免疫应答[20-21],这种应答为以Th1型免应答失衡而导致的疾病带来了新的治疗方法,其主要原因是旋毛虫感染能够调节免疫失衡宿主(如:炎症性肠病患者)的免疫平衡。
旋毛虫感染后6 h肠道Th1型免疫应答受到抑制,并在感染后3 d和6 d 2个时期呈现Th1 / Th2混合型免疫应答,以及从感染后6 h至6 d肠道的炎症逐渐加重的变化趋势,反映了旋毛虫感染早期对宿主免疫调节的复杂性,旋毛虫通过诱导机体产生的Th2型免疫应答[22],从而实现其在宿主体内长期寄生。本研究有助于阐明旋毛虫感染早期诱导宿主产生的免疫抑制机制,为相关疾病的研究奠定基础。
利益冲突:无

