浙江金线莲组织培养体系的建立
陈常理,骆霞虹,唐楠楠,余杨,安霞,李文略,朱关林,李珊,程舟,金关荣*
(1.浙江省农业科学院 萧山棉麻研究所,浙江 杭州 311202;2.同济大学 生命科学与技术学院,上海 200092;3.浙江省丽水市科技局生产力促进中心,浙江 丽水 323000)
浙江金线莲(Anoectochiluszhejiangensis)为兰科开唇兰属多年生珍稀草本植物,主要分布在浙江、福建等地,作为一种珍贵中草药,具有广阔的开发利用前景[1]。浙江金线莲的生物学特性和药理活性与同属基原植物金线莲相近,对生长条件要求比较严格,自然萌发率不到千分之一,自然繁殖时间长且繁殖率不高,再加上近年来人为大量采挖,导致浙江金线莲野生资源日趋枯竭,因此,保护野生浙江金线莲已经到了刻不容缓的地步[2]。
植物组织培养是保护濒危植物的有效技术手段,可在短时间内繁殖出大量新生植株。在组织培养中,培养基的筛选将直接影响到组织培养的成功与否,植物激素的浓度配比将直接影响到植株快繁的效率。迄今为止,有关金线莲基原植物,如台湾金线莲、金线莲、福建金线莲等快速繁殖体系的研究已有较多报道[3-4],并发现不同基原植物间的快速繁殖体系相差较大,不同阶段最适的激素配比也会有所差异[5]。但是关于浙江金线莲组织培养方面的研究相对有限。为解决资源稀缺问题,有必要建立其快速繁殖的最优体系。因此,本研究在本课题组前期已建立的金线莲、台湾金线莲快速繁殖体系基础上,以浙江金线莲为材料,探讨不同植物激素配比对类原球茎诱导、增殖、分化和生根的影响,建立植株快速繁殖的最优体系,为浙江金线莲的扩大培养打下基础,也为今后对浙江金线莲成分等方面的研究和开发利用提供有力的支撑。
1 材料与方法
1.1 材料
浙江金线莲(ZJJ)组培苗由同济大学丽水中药研究院资源植物实验室提供。
1.2 方法
1.2.1 培养基的配制
类原球茎的诱导、增殖与分化以MS为基本培养基,生根培养以1/2 MS为基本培养基,加入不同浓度的植物生长调节剂,pH值5.8。液体培养基蔗糖浓度为5.0%,固体培养基蔗糖浓度为3.0%,类原球茎分化培养基中附加10%香蕉泥。所有培养基121 ℃高压灭菌20 min,冷却备用。
1.2.2 类原球茎的诱导
液体培养诱导类原球茎。以MS为基本培养基,添加0.2、0.4、0.6 mg·L-1TDZ和0.2、0.4、0.6 mg·L-1NAA[6]。取生长健康的无菌苗,在超净工作台上将其叶片从柄部切除,气生根从基部切除,将茎切成带2~4个节的茎段,随机接种到各组培养基中,每组4瓶,每瓶接种10个。第1次接种3 d后即更换培养基,以后每7 d更换1次培养基,接种31 d后统计诱导出类原球茎的茎段数,取平均值计算其诱导率。诱导率=(诱导出类原球茎茎段数/接种茎段数)×100%。
固体培养诱导类原球茎。以MS为基本培养基,选取0.2、0.3、0.4、0.6 mg·L-1TDZ,0.2、0.4 mg·L-1NAA和2.0 mg·L-16-BA配比组合进行试验[6]。茎段处理与液体培养诱导类原球茎的处理相同,随机接种到各组培养基中,每组3瓶,每瓶7~8个茎段,每7 d更换1次培养基,接种30 d后统计诱导出类原球茎的茎段数,取平均值计算其诱导率和诱导效率。诱导率=(诱导出类原球茎茎段数/接种茎段数)×100%,诱导效率=(诱导出的类原球茎个数/接种茎段数)×100%。
1.2.3 类原球茎的增殖
以MS为基本培养基,采用L9(34)正交试验研究稀效唑、6-BA和NAA对类原球茎增殖的影响。稀效唑的1、2、3水平分别为0.5、1.0、1.5 mg·L-1,6-BA的1、2、3水平分别为1.0、2.0、3.0 mg·L-1,NAA的1、2、3水平分别为0.2、0.4、0.6 mg·L-1。将诱导出的带类原球茎的茎段随机接种到各组培养基中,每组5瓶,每瓶接种10~15个,培养60 d后统计结果,取平均值计算增殖系数。增殖系数=(增殖出的类原球茎个数/总接种茎段数)×100%。
1.2.4 类原球茎的分化
以MS为基本培养基,分别添加0.5、1.0、2.0 mg·L-16-BA和0.1、0.2、0.3 mg·L-1NAA进行试验。将增殖培养后的类原球茎切割成团,随机接种到各组培养基中,每组5瓶,每瓶接种5个类原球茎团,培养60 d统计分化情况,取平均值计算分化率。分化率=(分化的类原球茎数/接种类原球茎数)×100%。
1.2.5 生根培养
以1/2 MS为基本培养基,分别添加0.5、1.0、1.5 mg·L-1IBA和0.5、1.0、1.5 mg·L-1NAA。将分化培养得到的幼嫩小苗(约2.0 cm)随机接入生根培养基中,每组3瓶,每瓶接种7~8个幼嫩小苗,培养60 d时统计生根情况,计算生根率。生根率=(生根幼嫩小苗数/总接种幼嫩小苗数)×100%。
1.2.6 培养条件
类原球茎液体诱导的培养条件为:90 r·min-1振荡培养,光照时间12 h/12 h(L/D)。类原球茎固体诱导、增殖、分化和生根的培养条件为:光照强度3 000 lx,光照时间12 h·d-1,温度为25 ℃。
2 结果与分析
2.1 类原球茎的诱导
2.1.1 液体培养诱导类原球茎
茎段经诱导培养10 d后,节间部位形成2~6个乳白色类原球茎(图1),培养30 d后统计诱导出类原球茎的茎段数。结果(表1)表明:TDZ和NAA配合使用能诱导浙江金线莲茎段长出类原球茎,但不同激素对类原球茎的诱导效果影响不同。当TDZ浓度一定时,随着NAA浓度的增加类原球茎的诱导率没有明显变化,TDZ浓度为0.2 mg·L-1,NAA浓度分别为0.2、0.4、0.6 mg·L-1时,类原球茎的诱导率依次为10.8%、12.5%、9.2%。当NAA浓度一定时,随着TDZ浓度的增加,类原球茎的诱导率有较为显著的提高,当NAA浓度为0.2 mg·L-1,TDZ浓度分别为0.2、0.4、0.6 mg·L-1时,类原球茎的诱导率依次为10.8%、29.2%、50.0%。可见,TDZ对类原球茎诱导效果的影响大于NAA,最佳的诱导条件为TDZ 0.6 mg·L-1、NAA 0.4 mg·L-1。

图1 浙江金线莲类原球茎的诱导
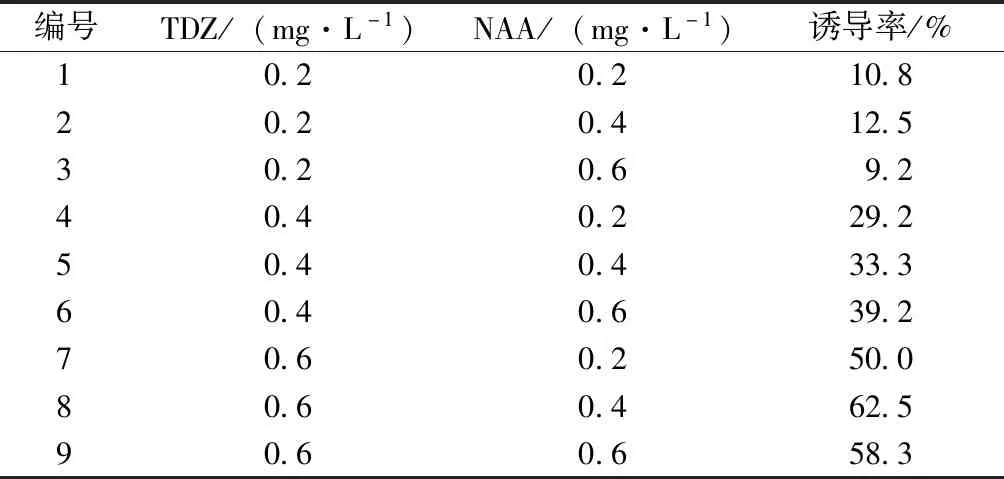
表1 液体培养不同激素浓度对浙江金线莲类原球茎诱导的影响
2.1.2 固体培养诱导类原球茎
与液体培养诱导类原球茎类似,固体诱导培养7 d左右,在茎段节间部位开始出现乳白色类原球茎。培养30 d后统计诱导出类原球茎的茎段数,结果如表2所示。TDZ、NAA和6-BA按不同的配比使用均能诱导浙江金线莲茎段长出类原球茎,但不同激素配比对金线莲类原球茎的诱导效果不同,从诱导率来看,3号、4号、5号培养基的诱导能力均较好,类原球茎诱导率无明显差异。从诱导效率来看,5号培养基的诱导效率最高,为144.6%,显著高于其他4组。综合诱导率与诱导效率,固体培养基中类原球茎诱导最佳条件为TDZ 0.6 mg·L-1+NAA 0.2 mg·L-1+6-BA 2.0 mg·L-1。
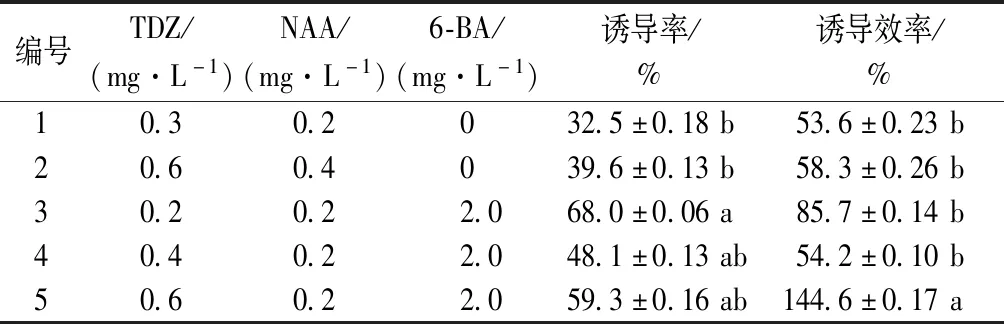
表2 固体培养不同激素浓度对浙江金线莲类原球茎诱导的影响
注:同列数据后无相同小写字母表示在0.05水平上存在显著差异。表6~8同。
2.2 类原球茎的增殖
将诱导出类原球茎的茎段转移至固体增殖培养基上,培养60 d后观察到新增殖的类原球茎数量众多、生长旺盛(图2)。统计类原球茎个数,计算增殖系数,结果见表3。结果表明:稀效唑、6-BA和NAA配合使用能有效促进浙江金线莲类原球茎增殖,且不同的激素配比对类原球茎的增殖效果存在差异,其中第8号培养基的增殖系数最高,为8.4。从极差R值(表4)可知,稀效唑对类原球茎的增殖起主要作用,其次为6-BA,影响最小的是NAA。根据K值大小可以得出,类原球茎增殖的最佳条件为稀效唑1.5 mg·L-1+6-BA 2.0 mg·L-1+NAA 0.2 mg·L-1。

图2 浙江金线莲类原球茎的增殖
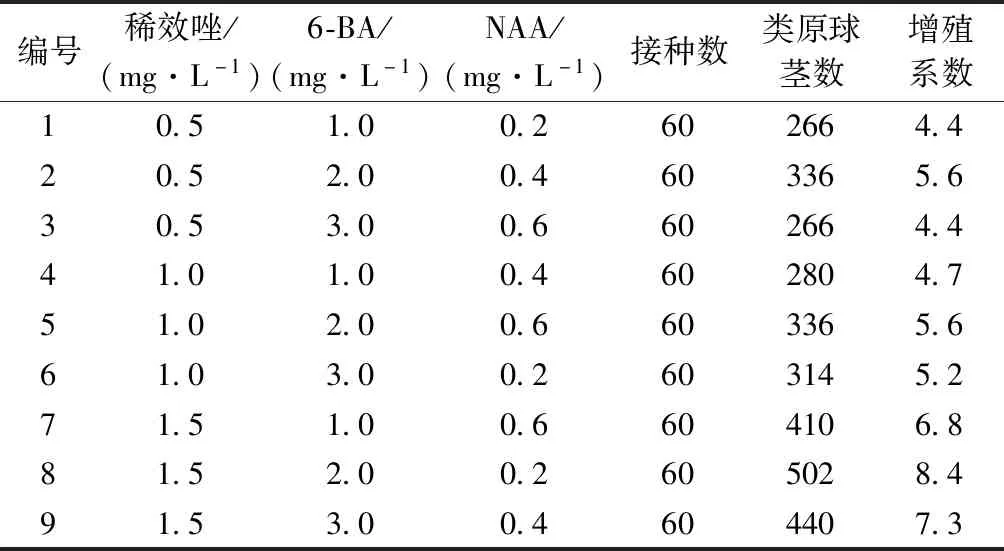
表3 不同激素浓度对浙江金线莲类原球茎增殖的影响
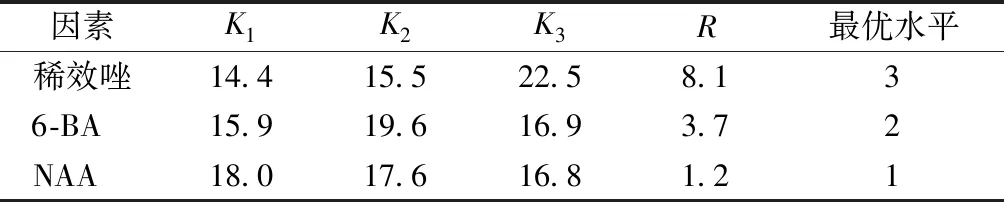
表4 不同因素的极差分析
2.2.1 类原球茎的分化
对类原球茎进行分化培养10 d左右,类原球茎球体顶部开始突起变尖、变绿,然后逐渐伸长,分化出嫩芽,60 d后可分化成带有茎节、叶片和幼小毛状根的小苗(图3)。对分化的类原球茎数进行统计,并计算分化率。结果如表5所示,不同的激素配比对类原球茎的分化效果产生不同影响。当6-BA浓度一定时,随着NAA浓度的增加,分化率逐渐降低,例如,当6-BA浓度为1.0 mg·L-1,NAA浓度为0.1、0.2、0.3 mg·L-1时,分化率分别为73.3%、65.3%、57.3%。当NAA浓度一定时,随着6-BA浓度的增加,分化率逐渐降低,例如,当NAA浓度为0.2 mg·L-1,6-BA浓度为0.5、1.0、1.5 mg·L-1时,分化率分别为81.3%、65.3%、46.7%。因此,1号培养基的分化率最高,分化的最佳条件为6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1。

图3 浙江金线莲类原球茎的分化培养
2.2.2 生根培养
分化的幼苗在生根培养基中培养10 d后开始有根长出,生根培养60 d后统计生根数和植株生长状况,计算生根率,结果如表6所示。7种培养基均能诱导浙江金线莲生根,且不同激素配比对生根效果的影响不同,其中1~6号培养基的生根率都达到了100%,但是从生根数、根长等植株生长整体状况看,4号培养基的生长状况最好,平均根数为1.51条,根长为1.53 cm,株高7.90 cm,茎节数6.50;7号培养基的生长状况最差,生根率仅为70%,株高、茎节数、平均根数等指标均低于其他6组培养基。因此,浙江金线莲生根培养的最佳条件为1/2 MS+NAA 1.0 mg·L-1+IBA 1.0 mg·L-1。
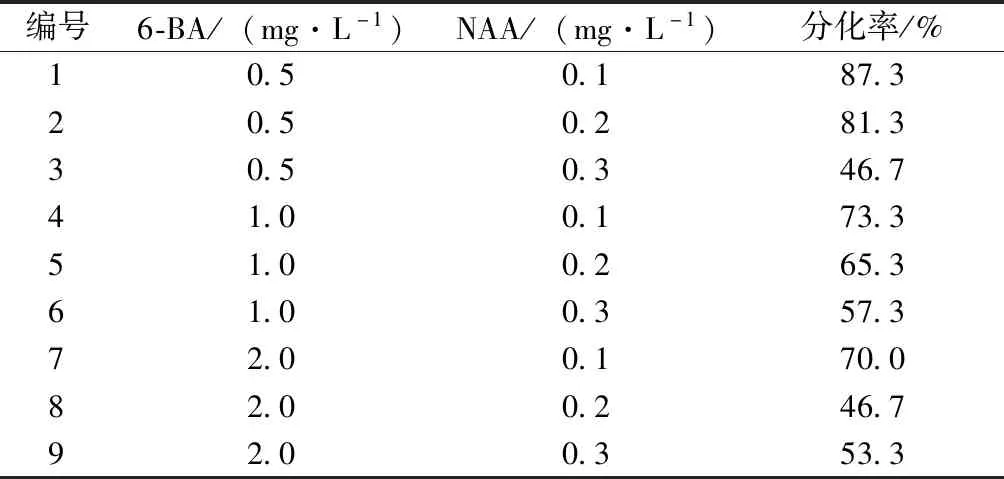
表5 不同激素浓度对浙江金线莲类原球茎分化的影响
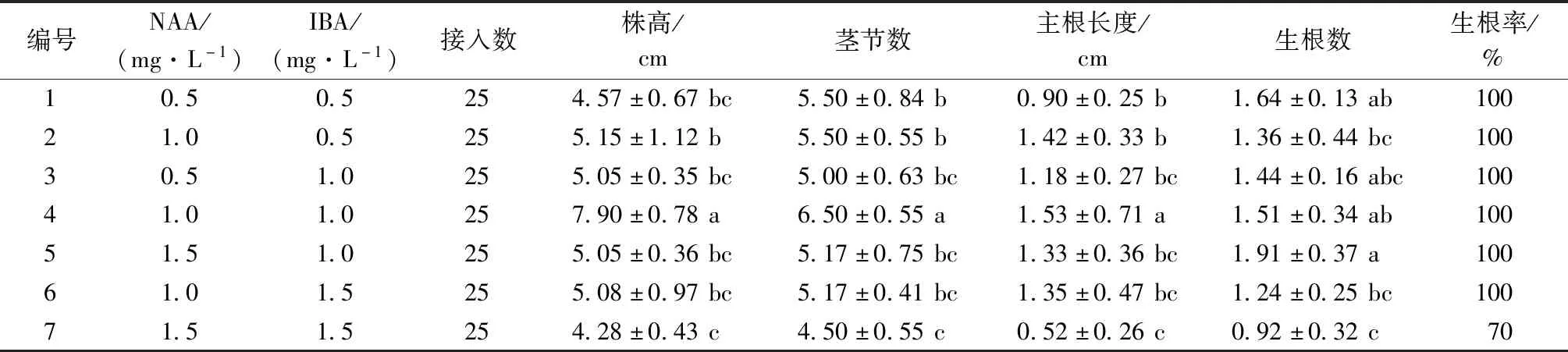
表6 培养60 d不同激素浓度对浙江金线莲生根的影响
累计培养120 d,再次观察和统计植株生根状况,结果如表7所示,随着培养时间的延长,根不断增多变长,植株不断生长。4号培养基和6号培养基中植株生长状况都较好,2组的平均株高、茎节数、根长和根数均无显著差异。7号培养基的平均株高、茎节数、根长、根数和生根率也都有所增加,生根率达到92%,但相比其他几组整体生长状况依然较差。
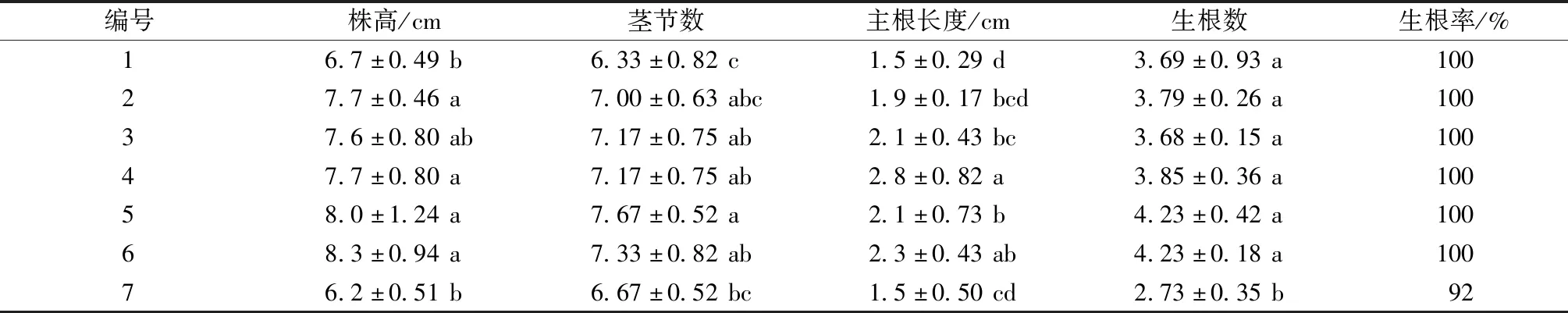
表7 培养120 d不同激素浓度对浙江金线莲生根的影响
累计培养180 d,再次观察植株的生根状况,结果如表8所示。7组植株间生长状况的差距逐渐减小,其中7号培养基中的植株的生根率达到了100%。可见随着培养时间的延长,生根率不断增加,但其生长状况与其他组比依然较差。生长状况较好的为4号培养基和5号培养基。

表8 培养180 d不同激素浓度对浙江金线莲生根的影响
综合3次统计结果发现,随着培养时间的延长,各培养基中金线莲生根数不断增多,根不断变长,平均株高不断增长,诱导率不断升高,4号培养基上浙江金线莲植株生长状况一直较好,7号培养基上的生长状况则始终最差。可见最佳的生根培养条件为1/2 MS+NAA 1.0 mg·L-1+IBA 1.0 mg·L-1,生根率可达100%。
3 小结与讨论
本研究发现,不同浓度的植物激素配比可对浙江金线莲类原球茎的诱导、增殖、分化和生根产生较大的影响。对类原球茎的诱导,在不同的培养基中,最佳激素配比不同。在液体培养和固体培养中最佳类原球茎诱导条件分别为TDZ 0.6 mg·L-1+NAA 0.4 mg·L-1和TDZ 0.6 mg·L-1+NAA 0.2 mg·L-1+6-BA 2.0 mg·L-1,诱导率分别为62.5%和59.3%。类原球茎增殖、分化、生根的最佳激素组合依次为:稀效唑1.5 mg·L-1+6-BA 2.0 mg·L-1+NAA 0.2 mg·L-1、6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1、1/2 MS+NAA 1.0 mg·L-1+IBA 1.0 mg·L-1,增殖系数、分化率、生根率分别为8.4、87.3%、100%,其中稀效唑是促进类原球茎增殖的主要因子。
研究表明,可选用种子、茎段或顶芽作为外植体对金线莲进行快速繁殖,再生植株的途径主要有丛生芽和原球茎(或类原球茎),且类原球茎的增殖效率远高于丛生芽,更有利于金线莲的快速繁殖[7-8]。本试验以浙江金线莲茎段为材料进行类原球茎的诱导,探讨不同浓度激素配比对类原球茎诱导的影响;当培养基为MS+TDZ 0.6 mg·L-1+NAA 0.4 mg·L-1时,类原球茎的诱导率最高,达到62.5%。说明TDZ能促进诱导类原球茎,这可能与TDZ具有很强的细胞分裂素(CTK)活性,可诱导细胞分裂素的合成并抑制内源生长素的降解有关[6]。
外植体茎段的选择与处理对诱导成功率有很大影响[9]。本研究发现,幼嫩茎段的诱导率高于粗壮老茎段。未切除叶片、嫩芽或气生根的茎段材料极难诱导成功,推测原因可能是茎段吸收的营养大部分用于叶片、芽和根的生长,类原球茎诱导产生所需营养不足,而很难发生。因此,建议在做类原球茎诱导时应切除上述器官。另外,对于幼嫩茎段,应适当增加外植体的茎节数,避免因过分切割导致材料的褐化死亡。
金线莲类原球茎增殖培养时,稀效唑是类原球茎增殖的主要因子,其作用超过6-BA和NAA[6]。稀效唑可抑制赤霉素的生物合成,具有促进分化、抑制植物生长的作用,加入烯效唑有利于提高增殖效率[6]。本研究结果也表明,稀效唑对浙江金线莲类原球茎的增殖具有类似的作用。
在类原球茎的分化研究中,6-BA和NAA是常用的植物激素。本研究发现较低浓度的6-BA更有利于类原球茎的分化,且6-BA/NAA激素比值较低有利于分化。前人研究发现,6-BA和NAA浓度过高不利于芽丛发生,本研究结果与此一致[10]。随着激素浓度的升高,激素对植物的促进作用先升高后降低,并非6-BA、NAA激素浓度越低越利于分化,只是在本试验所选取的激素浓度范围内低浓度更利于植株分化,但是否为分化的最佳浓度有必要在今后的研究中进一步验证。有研究表明,在培养基中添加添加物对细胞组织的增殖和分化有明显的促进作用[11-12],香蕉泥中含有大量的糖类,可为植物组织细胞分裂分化提供能源,同时,在香蕉泥中含有天然激素如细胞分裂素、生长素、乙烯和赤霉素等多种活性物质,此外,香蕉泥还具有较好的pH缓冲作用,在兰花(Cymbidiumspp.)离体培养中应用较多[8],常用浓度为100~200 mg·L-1。研究发现,在培养基中添加香蕉泥,瓶苗粗壮,根系发达,更利于分化[8]。本研究在分化培养基添加10%的香蕉泥,能促进植株分化生长。
培养基中大量元素含量较低时更加利于组培苗生根[13],相对于MS培养基而言,1/2 MS培养基中的大量元素减半,更有利于组培苗的生根。因此,本试验选用1/2 MS培养基作为基础培养基,促进浙江金线莲的生根培养。结果表明,IBA和NAA配合使用能有效促进浙江金线莲生根,不同激素配比对浙江金线莲生根效果的影响各不相同,IBA和NAA浓度过高过低都不是最佳诱导生根条件,浙江金线莲根对IBA和NAA的响应符合植物对激素浓度的反应情况,得到了与金线莲生根培养一致的结果[4]。

