左无名静脉-右心耳旁路移植术治疗复杂前上纵隔肿瘤效果分析
鲍 峰,宫为一,蒋家好,丁建勇*
1. 武警安徽省总队医院胸外科,合肥 230000 2.复旦大学附属中山医院胸外科,上海 200032
发生于前上纵隔的肿瘤,特别是恶性侵袭性肿瘤,容易侵犯上腔静脉及左右无名静脉,对静脉回流造成影响,从而引起颈部及上肢肿胀、眼结膜充血血肿等症状,临床称为上腔静脉综合征(superior vena cave syndrome, SVCS)。临床上对这类患者的治疗往往采取放化疗或介入治疗,预后不佳。自2017年3月至2018年12月,复旦大学附属中山医院胸外科对8例骑跨于上腔静脉及左右无名静脉的复杂前上纵隔肿瘤尝试了积极的手术治疗,在认真术前评估的基础上,对原发肿瘤予以根治性切除,并行左无名静脉-右心耳旁路人工血管移植术,取得了满意的近期效果。
1 资料与方法
1.1 一般资料 8例患者均有不同程度上腔静脉综合征症状(表1),1例合并肌无力。其中男性6例,女性2例,年龄27~74岁,平均年龄51岁。肿瘤类型:B2和B3混合型胸腺瘤1例,B2型胸腺瘤2例,纵隔上皮性恶性肿瘤经免疫组化提示神经内分泌癌(类癌)2例,胸腺鳞癌3例。肿瘤最大径3~13 cm,平均7 cm。3例手术1.5~2个月前行新辅助化疗。8例患者术前均行增强CT、MRI、胸主动脉CTA、心脏彩超等检查,提示纵隔肿瘤骑跨于上腔静脉及左右无名静脉,且这些血管均存在不同程度受压,肿瘤包绕压迫上腔静脉致其变形闭塞。8例均行CT引导下穿刺活检,术前明确为B2型胸腺瘤2例,B2和B3混合型胸腺瘤1例,胸腺鳞癌2例。1例男性患者合并右肋膈角占位。
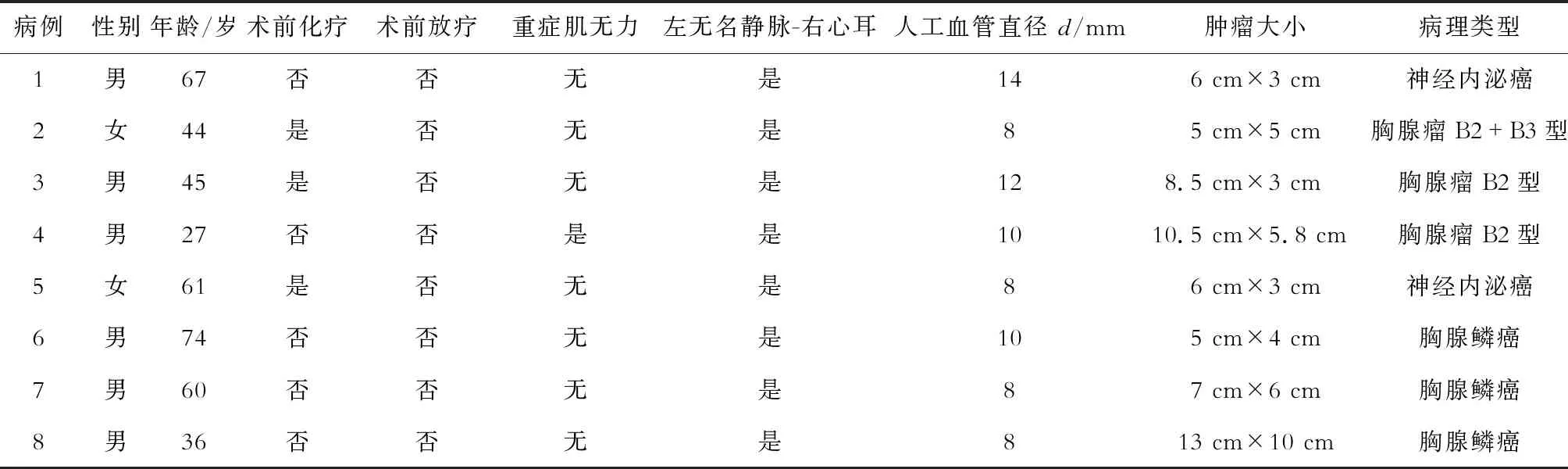
表1 因局部晚期胸腺肿瘤行左无名静脉-右心耳旁路手术患者的病例资料
1.2 手术方法 经气管插管进行全麻,8例均行正中切口。其中合并右肋膈角占位病例因正中切口同期切除膈肌肿块困难,先行右进胸切口,发现系转移病灶,予以切除并行部分心包切除合并补片修补,后改平卧位正中切口。8例患者术中探查肿瘤情况与术前预估大致符合,侵犯上腔静脉均超过1/2周径,无法行血管修补成型术。5例患者肿块不同程度侵犯右肺上叶、中叶,予以肺楔形切除;4例切除部分心包组织;3例侵犯右侧膈神经,行膈神经切除。尽可能游离血管,尤其是游离左右无名静脉至可吻合的足够长度。7例患者先行左无名静脉-右心耳旁路人工血管移植,再行右无名静脉+上腔静脉离断切除(不重建),最后完整切除肿瘤;1例患者预行右无名静脉-上腔静脉人工血管重建术,故先行移除肿瘤,并同时阻断左右无名静脉及上腔静脉(事先未行旁路转流),后发现右无名静脉血管条件一般,吻合空间狭小,遂决定仍行左无名静脉-右心耳人工血管移植术。根据患者血管直径不同,选择8 mm(4例)、10 mm(2例)、12 mm(1例)、14 mm(1例)直径的PTFE带螺纹人工血管,术中予1 mg/kg肝素化,吻合结束后予鱼精蛋白中和。1例同时阻断上腔静脉和左右无名静脉者予冰帽,并术中观察瞳孔。
1.3 术后措施 术后患者均带气管插管入监护室,呼吸机辅助呼吸,待肌力恢复后脱机拔管。合并肌无力患者予适当延长机械通气时间,并在术后3~5 d注意观察有无肌无力危象发生。所有患者术后早期(12 h内)均予低分子肝素钠皮下注射,剂量6 250 U/次,每次间隔12 h,逐渐过渡至口服华法林,维持国际标准化比值为(international normalized ratio,INR)1.7~2.2,终身服药。
2 结 果
所有患者均无围手术期严重并发症,无肌无力危象;合并肌无力的1例患者围手术期服用溴吡斯的明控制症状。术后均顺利脱机。术后根据病理类型选择相应放化疗方案,术后复查CTA,人工血管均通畅,无血栓形成。8例患者术后均无胸闷、气喘、呼吸困难症状。合并肌无力患者症状有部分缓解,3例切除右侧膈神经患者术后观察到右侧膈肌稍上抬,但无明显呼吸困难。所有患者术后头面部肿胀及上肢肿胀(右侧更甚)在1周后逐渐减轻、消退。术后随访3.4~27.4个月(图1),女性的大细胞神经内分泌癌患者(病例5)术后9个月因骨转移死亡;余7例患者恢复良好,无明显复发。术后(CTA)随访示人工血管通畅率100%。典型病例(病例4)的术前、术中和术后病理情况见图2。
3 讨 论
前纵隔肿瘤组织来源复杂,包括胸腺瘤(最为常见)、胸腺囊肿、畸胎瘤、胸内异位组织肿瘤(胸骨后甲状腺肿、甲状旁腺瘤)和淋巴源性肿瘤(淋巴肉瘤、霍奇金病等)。其中,巨大侵袭性纵隔肿瘤以恶性多见,此类肿瘤早期常无临床症状,晚期累及邻近重要结构造成上腔静脉综合征时常伴随相应的临床表现而被发现。根据日本Chiba经验,局部晚期的胸腺肿瘤血管置换后,5年生存率为62.5%,肺癌只有18.8%,外科手术指征明确。本研究对左无名静脉-右心耳旁路移植术进行了总结归纳。
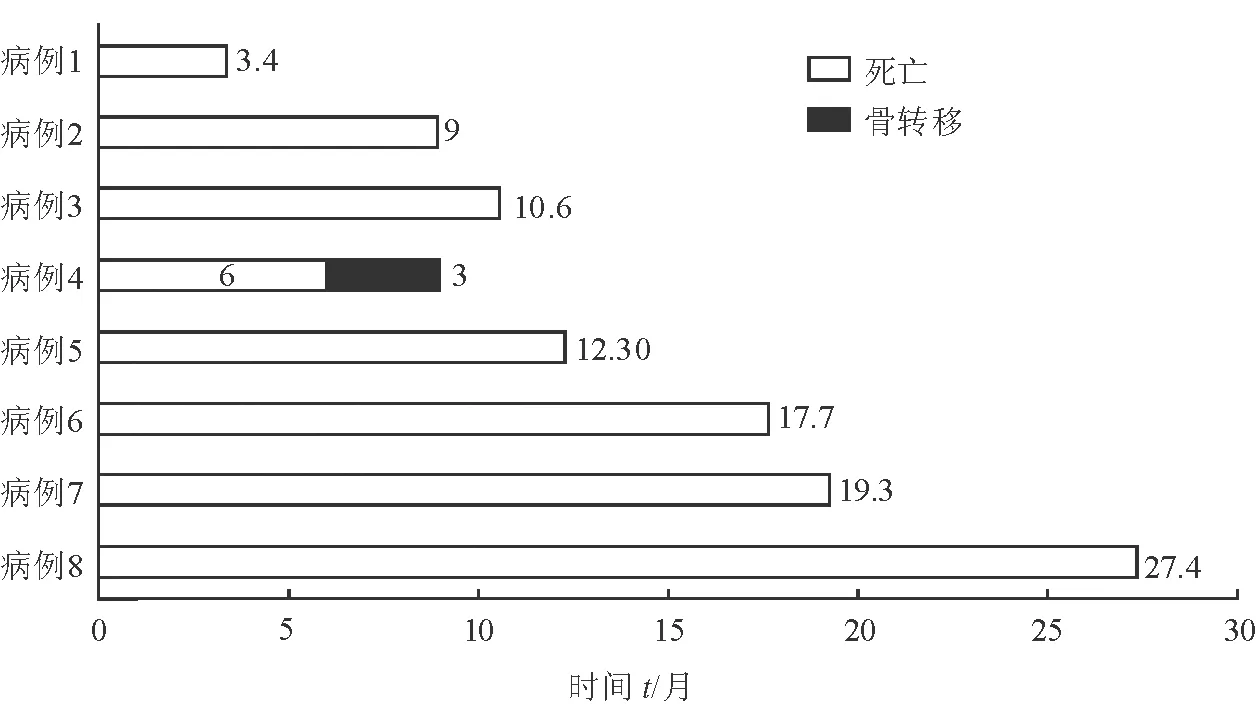
图1 术后随访情况

图2 典型病例(病例4)手术前后情况
A: 术前CT,肿瘤骑跨于上腔静脉及左右无名静脉,侵犯上腔静脉超过1/2周径 ;B:术中CT,移除肿瘤,行左无名静脉-右心耳人工血管移植术;C:术后CT,人工血管通畅,肿瘤完整切除
3.1 术前评估 该类患者就诊时病程不短,大多已形成了良好的侧支循环,术前除常规检查化验外,都应行胸部增强CT及血管三维重建(CTA),必要时行纵隔MRI,了解上腔静脉通畅程度,以及对周围血管的侵犯程度。8例患者术前检查均见上腔静脉有不同程度的阻塞,可提示手术过程中阻断上腔静脉较为安全。术前心脏彩超的意义在于了解上腔静脉系统的血栓、瘤栓的部位和范围,右心耳内是否有血栓形成,以免术中栓子脱落造成肺栓塞甚至心跳骤停。关于是否应于手术前获得明确的病理诊断目前仍存在一定争议。对于胸腺上皮性肿瘤,国家综合癌症网络指南建议,在可切除的情况下,完全切除肿瘤时不需术前活检[1]。原因是术前穿刺活检有可能破坏肿瘤包膜引起肿瘤种植,同时因SVCS患者头颈部肿胀、静脉压高,活检有出血风险[2]且有病理不确定性。本研究8例患者的术前检查过程中,均进行了CT引导下的FNA,其中5例获得倾向性病理诊断。虽然FNA获得组织较少,常不能很好地区分淋巴瘤和胸腺瘤[3],但本研究仍认为,对于此类涉及重要脏器需进行联合切除的复杂手术,更应强调术前活检的重要性,甚至可考虑数次进行活检,以提高诊断率。不可单纯依据是否合并肌无力症状而作出胸腺瘤的诊断。对确实在术前无法获得病理诊断的巨大肿瘤患者,术中应行快速冰冻病理检查以避免不必要的扩大切除。
3.2 手术技巧
3.2.1 强调肿瘤完整切除的重要性 本研究之所以采用正中切口,是因为其可较好暴露前上纵隔邻近重要器官结构,游离肿瘤更方便,更容易控制术中大出血,并可以探查胸腔,进行肺的楔形切除或肺叶切除。文献报道,手术治疗的Ⅲ期胸腺瘤10年生存率为45%~60%,其中能够完整切除者10年生存率为75%~94%,而不能完整切除者5年生存率仅为31%~35%[4]。只要治疗措施得当,前纵隔肿瘤的手术效果就较理想。1例患者先经右胸切口切除肋膈角占位,发现肿块侵犯膈肌遂行心包补片膈肌修补,再行改变体位切除主要病变。采取这种积极的术式正是基于以上观点的考量。
3.2.2 左无名静脉-右心耳旁路移植术的优势 通过术前检查可以了解患者病变的大致范围,血管受侵犯的部位、受压程度和梗阻部位。该8例患者术前肿瘤均骑跨于上腔静脉和左右无名静脉上方,位于前上纵隔偏右,肿瘤上缘未达锁骨下静脉和右颈总静脉汇入右无名静脉的交界处,下缘未及上腔静脉汇入右心房处,左缘距左颈总静脉和左锁骨下静脉汇合处仍有一段距离。左无名静脉可游离足够长度供血管吻合,而上腔静脉受压严重甚至基本闭塞,因此左无名静脉-右心耳的人工血管移植是可行的。
以往对于上腔静脉系统血管重建置换有多种手术方式[5]。(1)“Y”型人工血管置换:以双分支人工血管作材料,其中一分支与右无名静脉吻合,另一分支与左无名静脉吻合,两支另一端与上腔静脉近心端吻合;(2)双静脉血管置换:用一根单根人工血管将右无名静脉与近心端上腔静脉连接,另一根单根血管将左无名静脉与右心耳连接;(3)单静脉血管置换:将左无名静脉结扎,用单根人工血管将右无名静脉与近心端上腔静脉连接。文献[6]报道,从右无名静脉搭建血管桥至上腔静脉较左无名静脉角度更直,故右无名静脉人工血管桥通畅率更高。Hamanaka等[7]回顾性研究了10例Masaoka Ⅲ~Ⅳ期胸腺上皮肿瘤手术切除后的结果,3例胸腺瘤患者和7例胸腺癌患者进行了头臂静脉或上腔静脉的联合切除和重建:在所有患者中,左头臂静脉移植的通畅率较低,右头臂静脉移植的通畅率保持良好。
本研究选择左无名静脉-右心耳人工血管置换术式而非双静脉血管置换或右无名静脉搭桥基于以下几点考虑。(1)8例患者肿瘤位置均在前上纵隔偏右,右心耳未累及,左无名静脉血管条件优于右无名静脉,而此类肿瘤累及上腔静脉往往偏向右边。该术式不干扰后续切除,更可以使手术步骤便于标准化,简化手术流程,程序化手术。(2)右无名静脉和上腔静脉受阻明显,侧支循环已形成。以往报道这类手术中阻断上腔静脉前,建立左无名静脉-右心耳的旁路转流可有效减少脑水肿的发生[8]。但即使同时阻断左右无名静脉和上腔静脉,只要手术在30 min内完成吻合和血管重建都是安全的。本研究1例先行移除肿瘤,同时阻断左右无名静脉和上腔静脉而事先未行旁路转流的患者,予冰帽等措施,术后未发现脑水肿等并发症。(3)行单静脉血管置换较双静脉的优势在于保证足够的血流量和血流速度,避免了双根血管置换,口径不匹配发生术后“窃血”现象,导致术后口径细的血管血流减少,诱发血栓形成,血管闭塞[9]。
3.2.3 手术细节 (1)术者需具备娴熟的血管吻合技术,尽量缩短手术时间,并选择合适管径的人工血管。8例患者均选择带螺纹环的PTFE人工血管。人工合成材料有下述优点:呈环状,负压状态下不易坍塌;有一定硬度,能耐受关胸后压迫,纵隔纤维化(手术本身或术后化疗所致);相比Dacron,PTFE再上皮化、感染率低、血小板沉积和血栓形成机会小。应用PTEE主要存在的问题是需要长期抗凝,有血栓形成可能。张振龙等[10]主张右侧无名静脉及上腔静脉选择直径1.2~1.4 cm的人工血管,左侧无名静脉选择0.8~1.2 cm的人工血管。应根据术中具体情况选择。Maurizi[11]报道13例胸腺肿瘤浸润上腔静脉病例,12例患者接受了用牛心包导管替代上腔静脉修复体的根治性切除术,1例采用猪心包导管,中位随访58个月(4~134个月),心包导管的长期通畅率为100%。是否异种心包导管优于人工血管还待长期随访对比验证。(2)本研究将左无名静脉血管置换的近心端吻合于右心耳而不是上腔静脉,很好地克服了角度问题。另外,心耳-人工血管的吻合要斜口。人工血管不宜过长和过短,长度应适宜,过短吻合口张力大,过长应考虑到关闭胸骨后其是否会对人工血管桥造成挤压致扭曲闭塞。(3)游离肿瘤时精细操作,注意保护窦房结和膈神经,如果肿瘤侵犯一侧膈神经而无法保留,尤其应注意保护对侧膈神经。切除一侧膈神经患者术后应适当延长呼吸机辅助呼吸时间[12]。Aprile等[13]报道了采用神经保留技术对侵袭性胸腺瘤患者进行手术的结果。在140例进行Ⅲ期和Ⅳa期手术的患者中,19例女性和18例男性(中位52岁)接受了神经保留切除术。术后观察到膈性麻痹12例,其中4例痊愈。10例需额外治疗(7例Ⅳa期,3例Ⅲ期)复发。浸润性胸腺瘤患者保留膈神经是否可行值得商榷。(4)尽可能在奇静脉水平以上阻断上腔静脉,可保留一侧侧支循环。一般认为,阻断平面在奇静脉平面以上可不用旁路转流术,如在奇静脉水平以下阻断且超时90 min时需行转流术[14]。(5)术中肝素化,人工血管置换结束后用鱼精蛋白中和,术后需抗凝。关于术后抗凝目前尚无标准,本团队也在探索,如口服何种药物(华法林)、是否终生抗凝。目前是术后长期抗凝,尚无远期随访结果。
综上所述,在以往右上纵隔肿瘤合并SVCS患者的手术治疗中,左无名静脉-右心耳旁路转流常被作为上腔静脉阻断前的减压分流手段,在上腔静脉血管重建后撤除,但本研究通过临床实践发现左无名静脉-右心耳的旁路人工血管移植手术,操作简便安全,手术时间短,疗效确实、可靠,可作为一种成熟的血管重建方法在临床推广。

