一个植物原纤维蛋白基因的克隆及其表达特性分析
姜瑶瑶,李 静,蔡年俊,陈剑平,张恒木,*
(1.浙江农林大学 林业与生物技术学院,浙江 杭州 311300; 2.浙江省农业科学院 病毒学与生物技术研究所,浙江 杭州310021; 3.宁波大学 植物病毒学研究所,浙江 宁波 315211)
植物原纤维蛋白(FBN)又称为脂类相关质体蛋白,广泛存在于低等植物蓝藻到高等植物的光合器官中[1]。20世纪中叶,科学家们在玫瑰和辣椒等植物细胞的有色体中观察到不同厚度的线状或管状的原纤维[2],该结构含有丰富的类胡萝卜素、蛋白质、糖脂和磷脂组分,是有色体中细胞色素积累的主要场所[3]。直到20世纪90年代,科学家们首次从辣椒中分离并克隆出第1个植物FBN基因,研究发现该基因编码的蛋白参与植物有色体原纤维结构的组装[4]。近期的研究显示,植物FBN基因除了参与有色体原纤维的形成,还与质体色素的积累、各类胁迫的应答反应有关[5-7]。Rey等[8]在烟草中过量表达辣椒FBN基因后,对其进行干旱和强光处理,发现其长势强于对照,且花期提前,表明辣椒FBN基因在胁迫条件下能够促进植物的生长发育。但数十年来,有关本氏烟(Nicotianabenthamiana)FBN基因的研究鲜有报道。为了分析其功能特性,本研究从本氏烟中克隆了一个NbFBN基因,并对其特性进行了初步的分析。
1 材料与方法
1.1 材料
大肠埃希菌(Escherichiacoli)DH5α感受态细胞、反转录试剂盒First Strand cDNA Synthesis Kit均购自北京全式金生物技术有限公司;限制性内切酶NdeⅠ和BamHⅠ购自美国Fermantas MBI公司;高纯度质粒小提试剂盒购自北京康为世纪生物科技有限公司;荧光定量PCR所用的SYBR Green Real-time PCR Master Mix购自上海翊圣生物科技有限公司;Trizol试剂购自美国Invitrogen公司;引物合成与测序由上海铂尚生物技术有限公司完成。
1.2 RNA提取和cDNA合成
本氏烟在25 ℃、14 h∶10 h(光/暗)条件下培养,取其根、茎、叶和花器官用于组织特异性分析。干旱处理:向营养液中加入适量的PEG 6000固体使其终浓度为5%,同时用ddH2O作为对照;脱落酸(ABA)处理:调节ABA浓度为100 μmol·L-1,采用喷施处理,然后分别在处理0、12和24 h后采取叶片用于定量分析。取适量植物材料用Trizol试剂(Invitrogen)参照商家说明提取植物材料总RNA。取1 μg总RNA作模板,应用Oligo(dT)18引物,参照First Strand cDNA Synthesis Kit试剂盒说明书合成cDNA。
1.3 NbFBN基因扩增和克隆
根据NCBI数据库中本氏烟FBN序列(登录号:XP_016504394.1),使用DNAMAN软件设计了引物NbFBN-F(5’-GGAATTCCATATGGCTACCATCTCTTCTCTA-3’)和NbFBN-R(5’-GCGGATCCTTAAGGCTTCAAGAGGGGAC-3’),以叶片cDNA为模板进行扩增,反应程序为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。扩增产物经2%琼脂糖凝胶电泳分离后,参照商家说明利用PCR产物切胶纯化试剂盒(Promega公司)切胶回收扩增产物。纯化的产物连接至pGEM-T-Easy载体,然后转化大肠埃希菌DH5α,并涂于氨苄抗性的LB培养基,在37 ℃培养箱中培养18 h,挑取单克隆进行PCR鉴定,将含预期大小插入片段的克隆送至杭州博尚公司进行测序。
1.4 NbFBN同源性与进化分析
为分析NbFBN蛋白和其他植物FBN的同源性,从NCBI网站数据库(http://www.ncbi.nlm.nih.gov/)和拟南芥数据库(http://www.arabidopsis.org)中下载了植物FBN基因序列。利用DNAMAN软件进行多重序列比对,并利用MEGA6.0软件构建系统进化树,采用Neighbor-Joining法,bootstrap值设置为1 000。
1.5 定量PCR
利用NbFBN基因的引物对(5’-CTGCTGACAACATACCTGGATGA-3’;5’-TCAACACAAATACACTGCCTCCAT-3’)和本氏烟内参基因UBCE2(登录号:AB026056.1)引物对(5’-TGGAGGTACATTTAAGCTGACAC-3’;5’-TCACAGAGCAAAGACTGGATTG-3’),使用上海翊圣生物科技有限公司的SYBR Green Real-time PCR Master Mix在ABI公司(Applied Biosystems)的仪器7900 Real-Time PCR System,按照如下条件:95 ℃预变性5 min;95 ℃ 15 s,56 ℃ 30 s,72 ℃ 30 s,40个循环,进行定量PCR(qPCR)反应。
2 结果与分析
2.1 本氏烟NbFBN基因的克隆
以提取的本氏烟叶片总RNA反转录得到的cDNA为模板,根据NCBI数据库中本氏烟FBN基因序列(基因登录号:XP_016504394.1)设计引物,RT-PCR扩增产物经1.2%琼脂糖凝胶电泳,得到一条约1 kb的条带,与预计大小相符(图1)。经切胶回收纯化后,连接到T5-Bzero载体上,然后转入大肠埃希菌DH5α,测序结果表明,该基因编码区长966 bp,可编码一个分子量大小约为35 ku的蛋白。

1,8 000 bp DNA ladder;2,NbFBN.图1 NbFBN基因的RT-PCR扩增Fig.1 RT-PCR result of NbFBN gene
2.2 本氏烟NbFBN基因同源性分析
目前,拟南芥FBN基因研究的较多,分类比较明确[9]。为了确定NbFBN的进化地位及其与拟南芥FBN的亲缘关系,我们从数据库(http://www.arabidopsis.org)中下载了已知的拟南芥FBN基因序列[9],并采用MEGA6.0软件构建系统进化树(图2),结果表明,NbFBN与拟南芥FBN1a、FBN1b聚在一起(图2),表明本研究克隆的NbFBN与拟南芥FBN1a、FBN1b亲缘关系最近,应同属于FBN类型I的成员。同源性比对发现,NbFBN还与番茄(Solanumlycopersicum)、枸杞(Lyciumruthenicum)、甜椒(Capsicumannuum)等植物的FBN基因存在较高的同源性(62.54%~87.20%),相比之下,该基因的C-端部分(112-321位氨基酸)尤为保守(图3)。
2.3 NbFBN组织特异性表达分析
为了研究NbFBN基因在不同组织器官中的表达水平,利用定量PCR测定了NbFBN基因在本氏烟的根、茎、叶和花中的表达水平。结果如图4所示,发现NbFBN基因在本氏烟叶片、花中的表达量相对较高,而在根、茎中的表达量较低。

AtFBN4、AtFBN8、AtFBN9、AtFBN5、AtFBN10、AtFBN6、AtFBN3a、AtFBN3b、AtFBN7a、AtFBN7b、AtFBN11、AtFBN2、AtFBN1b、AtFBN1a均来自拟南芥。NbFBN来自本氏烟。AtFBN4, AtFBN8, AtFBN9, AtFBN5, AtFBN10, AtFBN6, AtFBN3a, AtFBN3b, AtFBN7a, AtFBN7b, AtFBN11, AtFBN2, AtFBN1b and AtFBN1a from Arabidopsis thaliana; NbFBN from Nicotiana benthamiana.图2 NbFBN与拟南芥FBN基因的系统发育分析Fig.2 Phylogenetic relationship of NbFBN and FBNs from Arabidopsis thaliana

SlFBN(NP_001234183.1,番茄);LrFBN(AIX87535.1,枸杞);CaFBN(AIX02791.1,甜椒);AtFBN1a(AT4G04020,拟南芥)和AtFBN1b(AT4G22240,拟南芥)。SlFBN(NP_001234183.1, Solanum lycopersicum), LrFBN(AIX87535.1, Lycium ruthenicum), CaFBN(AIX02791.1, Capsicum annuum), AtFBN1a(AT4G04020, Arabidopsis thaliana) and AtFBN1b(AT4G22240, Arabidopsis thaliana).图3 NbFBN与其他植物FBN基因的多重序列比对Fig.3 Multiple alignment of NbFBN and other FBN genes from different plants

*表示与叶片相比在P<0.05水平差异显著;ns表示与叶片相比差异不显著。* meant significant difference at the level of P<0.05 compared with leaf. ns meant no significant difference compared with leaf.图4 本氏烟不同部位NbFBN表达分析Fig.4 Relative expression level of NbFBN in different tissues of Nicotiana benthamiana
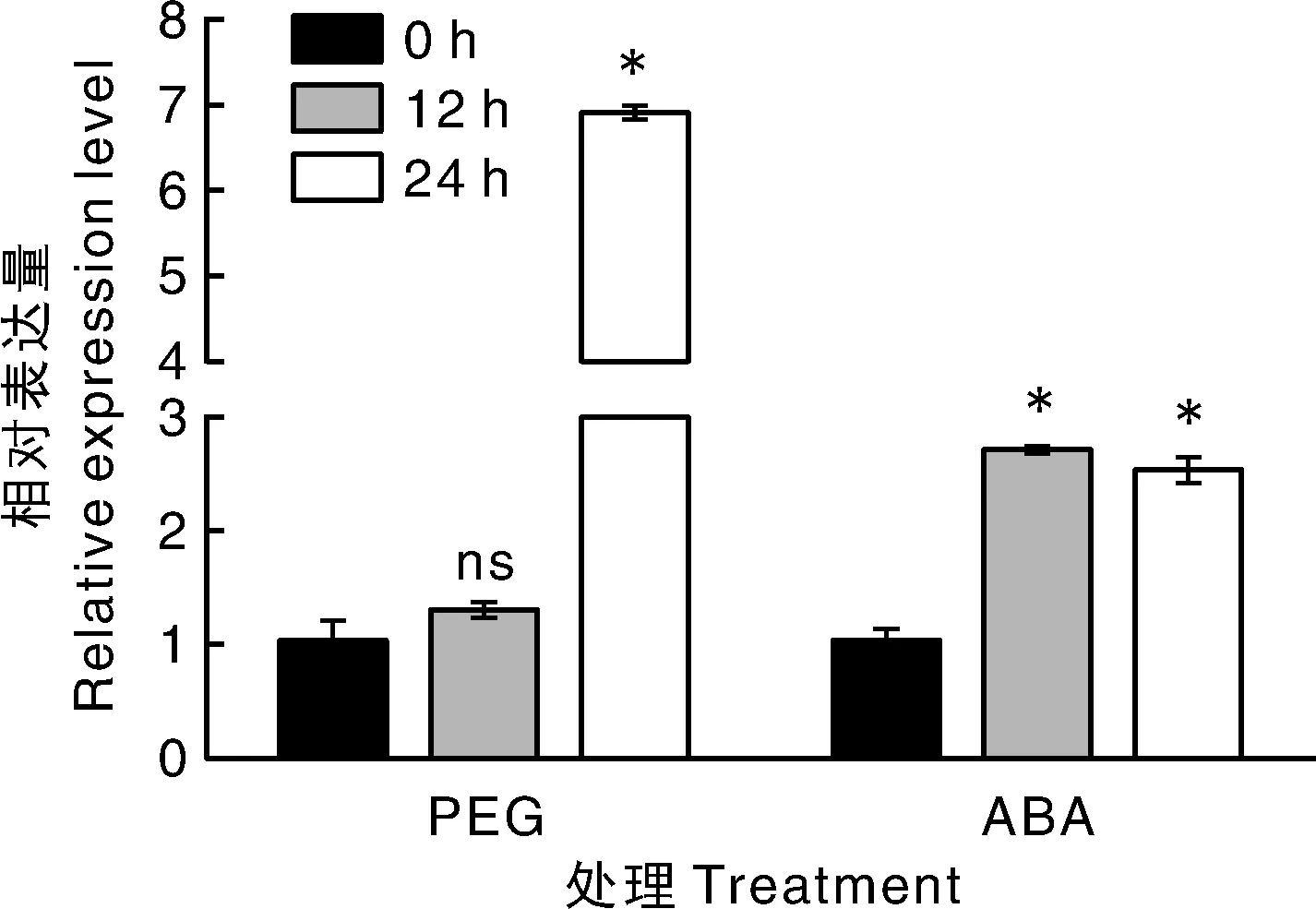
*表示与0 h相比在P<0.05水平差异显著;ns表示与0 h相比差异不显著。* meant significant difference at the level of P<0.05 compared with 0 h. ns meant no significant difference compared with 0 h.图5 PEG与ABA处理下NbFBN的表达特性Fig.5 Expression of NbFBN in response to PEG and ABA stresses
2.4 逆境下NbFBN基因的表达模式
为分析逆境条件下NbFBN基因的表达特性,我们分别对本氏烟进行PEG、激素ABA喷施处理,然后采用定量PCR分析了NbFBN基因的表达水平。结果如图5所示,PEG处理12 h时,NbFBN的表达量未见明显上升;处理24 h后,表达量显著上升,约是处理前的7倍;ABA处理12 h后,NbFBN表达量达到最高,处理24 h后NbFBN表达量继续维持在较高水平,表明NbFBN受到PEG、ABA的诱导表达,可能参与植物的逆境响应过程,NbFBN的表达水平可能与抗(耐)旱性密切相关。
3 讨论
植物原纤维蛋白(FBN)是由核基因组编码的质体蛋白,与质体原纤维、叶绿体类囊体、光合天线复合物相关。因此,对植物FBN蛋白的研究有助于更好地理解质体结构和功能的机制[10-12]。本氏烟作为一种模式植物,是研究植物与生物、非生物逆境互作的优良材料,但我们对其FBN的生物学功能和作用机制知之甚少。不同植物的原纤维蛋白呈现出不同的组织特异性,如在马铃薯根、茎、叶中检测到C40.4(FBN1)转录物[13],其在叶片中最丰富[14];拟南芥FBN1a主要在叶的叶肉和保卫细胞中表达[5]。本研究表明,NbFBN基因与番茄、枸杞、辣椒FBN高度同源,且在本氏烟根、茎、叶、花中均有表达(图4);相比之下,NbFBN基因在叶、花中的表达量较高,而在根、茎中的表达量最低,这与拟南芥FBN1a、马铃薯C40.4(FBN1)的表达特点相似,支持其同属于FBN类型Ⅰ的推论,也暗示NbFBN可能与拟南芥FBN1a在质体原纤维形成过程中具有相似的功能。近期的研究还显示,FBN参与了植物抗逆反应[15-22],例如,生长素(IAA)延迟了辣椒果实中原纤维蛋白(FBN1)积累,而脱落酸(ABA)则促进其FBN1的积累[22];在拟南芥中,ABA处理可诱导FBN1a蛋白的积累,从而保护光系统Ⅱ(PSⅡ)免受光抑制[23]。在本研究中,NbFBN在干旱和ABA处理时表达水平均升高,这与拟南芥FBN1a、FBN1b表达特点相似[23],表明该基因可能参与逆境响应过程。然而,干旱、ABA等逆境条件诱导植物FBN基因表达的机制还有待于进一步研究,本文有关NbFBN基因表达特点的结果有助于深入研究其生物学功能及其表达调控机制。

