紫茎泽兰甲醇提取物对石膏样小孢子菌的抑制作用及其机制
胡力文,张 勇,石 真,符 杰,孙 伟,邓俊良,任志华,左之才,曹随忠,胡延春
(四川农业大学 动物医学院,四川 成都 611130)
真菌性皮肤病主要是指由浅表、嗜角质真菌侵犯光滑表皮、指甲和毛发所引起的一类疾病,可造成皮肤及其附属结构损伤,能感染多种动物[1]。植物是人类最大的药物来源,从植物中提取的不少活性成分已大规模应用于人类疾病治疗、新药开发和筛选中。研究表明,多种植物提取物均表现出一定的抗真菌活性[2]。Chavan等[3]研究表明:经256 μg·mL-1香荆芥酚和百里香酚处理后,酵母细胞膜损伤严重,通透性显著增加,细胞膜中的麦角固醇含量显著降低,细胞也因胞内物质大量泄漏而死亡。槲皮苷[4]、大蒜精油[5]、肉桂油[6]等多种植物提取物均能够通过作用于真菌细胞膜、改变真菌细胞膜的通透性而表现出抗真菌活性。目前已知的抗真菌药物及其作用机制主要包括:(1)通过影响细胞膜重要物质的合成或与细胞膜关键物质结合影响细胞膜的完整性,改变膜通透性,致使细胞内物质外泄,最终细胞因代谢紊乱而死亡[7],按作用靶点可细分为3大类——作用于麦角固醇的药物、作用于鞘脂的药物和其他损坏膜脂质结构的药物[8-10];(2)通过抑制细胞壁中重要成分葡聚糖的合成而表现出抗真菌活性,按作用靶点不同可分为葡聚糖合成酶抑制剂、几丁质合成酶抑制剂和甘露聚糖-蛋白质复合物抑制剂;(3)通过作用于其他靶点而具有抗真菌活性,其中比较重要的是能够抑制真菌蛋白质合成或能量代谢的物质[11-12]。
紫茎泽兰是我国最严重的外来入侵植物之一。研究表明,紫茎泽兰有机溶剂提取物对动物真菌有抑制作用。本试验通过探索紫茎泽兰提取物对动物皮肤致病真菌石膏样小孢子菌的作用及其机理,旨在为动物真菌性皮肤病的新药开发和紫茎泽兰的资源化利用提供新的方向和理论支持。
1 材料与方法
1.1 试验材料与仪器
真菌:实验室保存的石膏样小孢子菌。
紫茎泽兰:样品于2016年5月在四川省西昌市自然生长环境下采集,阴干后研磨成粉,密封保存。
试剂:二甲基亚砜(DMSO)、甲醇、石油醚、三氯甲烷、无水乙醇、乙酸乙酯、正己烷、二氯甲烷、碘单质、酒石酸锑钾、磷酸二氢钾、硫酸、硫酸铜、钼酸铵、维生素C,均为分析纯,购于西陇科学股份有限公司;沙堡培养基(SDA)、改良沙堡培养基(DTM),购于青岛海博生物技术有限公司;硅胶(200~300目)、硅胶薄层层析板,购于安徽良臣硅源材料有限公司;盐酸特比萘芬溶液,购于保定步长天浩制药有限公司;碘化丙啶(PI)染料,购于美国BD Pharmingen公司。
仪器:恒温水浴锅,邢台润联机械设备有限公司;真空泵,巩义市予华仪器有限责任公司;旋转蒸发仪,巩义市英峪高科仪器厂;真菌培养箱,上海市一恒科技有限公司;紫外分光光度计,上海美谱达仪器有限公司;离心机,上海重逢科学仪器有限公司;倒置荧光显微镜,上海光学仪器一厂;低速离心机,安徽中科中佳科学仪器有限公司。
1.2 紫茎泽兰甲醇提取物的分离鉴定
1.2.1 紫茎泽兰甲醇提取物的成分分离
样品制备:使用甲醇浸泡紫茎泽兰(体积质量比2∶1)24 h,重复3次,合并浸泡液,在旋转蒸发仪上于45 ℃浓缩,收获甲醇提取物。用1 000 mL萃取液(甲醇、乙酸乙酯、水体积比2∶5∶8)溶解20 g甲醇提取物,萃取,收集乙酸乙酯部分,50 ℃条件下旋转蒸发得乙酸乙酯浸膏。利用30 mL乙酸乙酯溶解浸膏后备用。
硅胶柱层析:上样量为30 mL,洗脱液分别为乙酸乙酯-二氯甲烷溶液(体积比1∶99)、乙酸乙酯-二氯甲烷溶液(体积比2∶98),洗脱体积分别为2倍、10倍柱体。
样品收集:收集洗脱液,低温干燥,用少量乙酸乙酯溶解干燥后物质,进行薄层层析。展开剂为三氯甲烷-甲醇溶液(体积比99∶1),显色剂为碘单质。将相似物质合并后进行二次过柱,重复操作多次。
1.2.2 紫茎泽兰甲醇提取物的成分鉴定
检测:使用甲醇溶解分离的单体物质,与9-羰基-10,11-去氢泽兰酮(euptox A)标准品一起使用气相色谱-质谱联用仪(GC/MS)进行检测,将所得图谱与数据库中的数据进行比对,测定物质种类和纯度。
气相色谱(GC)检测条件:色谱柱为HP-5MS(30 mm×0.25 mm×0.25 μm);载气为He,流速1.0 mL·min-1;进样口温度220 ℃。升温程序:初始温度10 ℃,保持15 min,以5 ℃·min-1升至150 ℃,保持5 min。进样量为1 μL。
质谱(MS)条件:电子轰击离子源(EI),电子能量70 eV,离子源温度230 ℃,接口温度280 ℃,扫描范围40~400。
1.3 紫茎泽兰甲醇提取物中活性成分的抗真菌活性测定
将从紫茎泽兰甲醇提取物中分离鉴定出的活性成分加入培养基中,配制成0.98,1.95,3.9,7.8,15.6,31.25,62.5,125 μg·mL-1的含药培养基,相应记作处理A~H,以DMSO和盐酸特比奈芬分别作为阴性对照(CK-)和阳性对照(CK+)。每个质量浓度的含药培养基做3个重复,待平板凝固后将真菌菌饼(直径5 mm,菌龄6 d)接种到上述平板,28 ℃恒温培养观察10 d,以十字交叉法测定真菌菌丝生长量,计算抑菌率。将抑制率≥80%时的最低质量浓度记为MIC,抑制率等于50%时的药物质量浓度记为IC50,抑制率等于100%时的药物质量浓度记为MFC。
如图2及表2所示,增加电磁场以后激光焊接接头拉伸强度与未加磁场接头变化不大,均高于标准拉伸强度要求;增加电磁场焊接接头熔深明显增加,熔宽明显减小,表明增加电磁场后焊缝热影响区更小,具有更好的接头形状,并有较小的变形趋势。
1.4 euptox A抗真菌作用机制研究
euptox A处理真菌:精确称取真菌菌丝0.1 g于10 mL EP管中,使用含有2%葡萄糖的PBS缓冲液溶液(PBS-2%G)悬浮、洗涤3次,离心除去上清,加入1.5 mL用PBS-2%G稀释的euptox A溶液,使各处理组中euptox A的质量浓度分别等于0.5×MIC、1.0×MIC、1.5×MIC、2.0×MIC,混匀,每个浓度做3个重复,以不加任何药物的处理作为阴性对照(CK),28 ℃静止培养12 h。
PI染色试验:将培养后的菌悬液以4 000 r·min-1离心10 min,分离菌丝和上清培养液,回收菌丝备用。PI染液和处理后的菌丝避光反应5 min,加入400 μL结合缓冲液(binding buffer),尽快使用荧光显微镜观察真菌菌丝形态。
细胞外液中总蛋白质含量测定:分别吸取0、0.4、0.8、1.0、1.2、1.6、2.0 mL的30 mg·mL-1标准蛋白质溶液,分别加入4 mL双缩脲试剂,用蒸馏水定容至6 mL,配置质量浓度为0~10.0 mg·mL-1的蛋白质溶液,于540 nm处测定吸光度值,拟合回归曲线。取保存的上清液1 mL,加入4 mL双缩脲试剂,同样用蒸馏水定容至6 mL,于540 nm处测定吸光度值,计算细胞外液中的总蛋白质含量。
细胞外液中总磷含量测定:精密量取回收保存的上清液5.00 mL,置凯氏烧瓶中加硫酸溶液5 mL,用直火缓缓加热,待沸腾后加大火力至溶液呈淡黄色,冷却至室温,滴加数滴过氧化氢溶液,继续加热至几乎无色,再加热15 min,冷却至室温,转移至100 mL容量瓶中,用水稀释至刻度,混匀,待测。参照《中华人民共和国药典:第二部》(2000年版)中附录ⅣB,用分光光度法测定总磷含量。
麦角固醇含量测定:使用PBS缓冲液洗涤回收保存的菌丝3次。精密称取湿菌0.5 g于50 mL试管中,加入2.5 mL PBS缓冲液和新鲜配制的皂化剂(含15% NaOH的90%乙醇溶液)6 mL,混匀,80 ℃水浴皂化60 min,冷却至室温。加入6 mL石油醚(沸程30~60 ℃)萃取,连续萃取3次,合并萃取液,加蒸馏水6 mL洗涤,将石油醚溶液于60 ℃水浴干燥,得到未皂化脂,加入环己烷,使湿菌溶液的质量密度为1 g·mL-1,使用GC/MS测定麦角固醇含量,计算麦角固醇合成抑制率。
2 结果与分析
2.1 紫茎泽兰甲醇提取物的分离鉴定
试验结果显示,经过一次硅胶柱层析之后,溶液中的物质并没有被完全分离开,但是可以利用制备硅胶柱层析提纯后再用硅胶薄层层析将其分为几类(图1)。共获得3种物质:两次重结晶后的白色针状晶体、金黄色液体(完全干燥后为红棕色油状物)和淡黄色油状物。白色晶体经GC/MS检测和与euptox A标准品对比,鉴定其为euptox A,纯度达95%以上(图2-a),分子碎片分布于41~234(m/z):233.2[M+H]+,217.2[232.2-CH3]+,189.2[217.2-CO]+,175.1[189.2-CH2]+,161.1 [189.2-CO]+;淡黄色油状物经GC/MS检测对比,其主要成分为3-烯-2,7-二酮-杜松萜烯(CED)(图2-b),分子碎片分布于41-234(m/z):234.2 [M]+,216.2[234.2-O]+,205.1[234.2-COH]+,192.1[234.2-CH(CH3)2]+;金黄色液体的GC/MS检测结果显示,其主要成分为倍半水芹烯、法呢烯、石竹烯、古巴烯等多种烯烃类化合物(图2-d、e),分子量均为204。本研究中共检出2种结构相似的CED,出峰时间分别为41.88、42.25 min,其根本差异是分子碎片从192.1进一步碎裂时,一个脱下的是-CO,另外一个脱下的是-COH。除此之外,提取物中还含有少量分子量为236的CED衍生物(图2-c),分子式为C15H24O2。
2.2 euptox A、CED的抗真菌活性
前期研究表明,紫茎泽兰中的烃类提取物对石膏样小孢子菌的菌丝生长无明显抑制作用;因此,本试验只探究euptox A和CED对石膏样小孢子菌的抑菌效果。
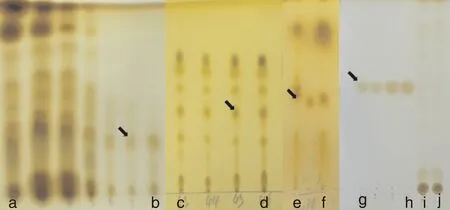
a、b,乙酸乙酯萃取物经一次硅胶柱层析后的洗脱液;c、d,在硅胶薄层板上连续,且点几乎完全相同的洗脱液;e、f,第二次经过硅胶柱层析后的洗脱液;g、h,经重结晶后提取的物质;i、j,重结晶时的洗涤液。图中箭头标记的是euptox A。a, b, Eluate of ethyl acetate extract after one silica gel column chromatography; c, d, Continuous and identical eluate on silica gel thin plate; e, f, Eluate after a second time silica gel column chromatography; g, h, The material extracted after recrystallization; i, j, Washing liquid at recrystallization. The arrow indicated euptox A.图1 紫茎泽兰提取物的硅胶薄层层析检测结果Fig.1 Detection results of Ageratina adenophorais extract by silica-gel thin-layer chromatography
如图3所示:当euptox A的质量浓度为125 μg·mL-1时可达到阳性对照组的抑菌效果。相同质量浓度(0.98~62.5 μg·mL-1)的euptox A,随着时间延长,其抑菌效果降低,但当其质量浓度为125 μg·mL-1时,随着时间延长,其抑菌效果并未下降。相同处理时间下,随着euptox A浓度增高,其对石膏样小孢子菌的抑制效果增强。CED对石膏样小孢子菌的抑制效果及其趋势与euptox A相似,但是在相同浓度或相同时间下的抑菌率均不如euptox A。
分析抑制率(y)与药物质量浓度(x)的关系,建立线性方程(表1),计算MIC、MFC、IC50(表2)。结果显示,euptox A的MIC在48 h和144 h时分别为45.20、50.50 μg·mL-1,CED的MIC在48 h和144 h时分别为65.02、112.23 μg·mL-1。结果表明,紫茎泽兰甲醇提取物具有一定的抗真菌活性,且以euptox A的效果更好。
2.3 euptox A抗真菌的作用机制
2.3.1 对真菌细胞膜的影响
用不同质量浓度的euptox A处理石膏样小孢子菌菌丝悬液,经PI染色后发现,对照组几乎没有明显的荧光,但处理组的石膏样小孢子菌菌丝荧光强度却明显升高(图4),并且随着euptox A质量浓度增加,荧光强度增强。结果表明,经euptox A处理后真菌细胞膜的完整性受到损害,PI染液大量进入细胞膜内,致使euptox A处理后的石膏样小孢子菌菌丝中散发出强烈的荧光。
2.3.2 对真菌总蛋白质、总磷含量的影响
如图5所示,石膏样小孢子菌细胞外液中的总蛋白质、总磷含量均随着euptox A质量浓度的增高而升高,但当euptox A质量浓度达到67.8 μg·mL-1之后,石膏样小孢子菌细胞外液中的总蛋白质含量不再明显上升,而总磷含量却上升得更加明显。与CK相比,经euptox A处理后细胞外液中的总蛋白质和总磷浓度都显著(P<0.05)上升。结果表明:石膏样小孢子菌经euptox A处理后,细胞膜完整性受到破环,细胞内外物质交换紊乱,主要分布于细胞膜内的总蛋白质和总磷经细胞膜孔隙大量泄漏到细胞外,导致细胞外液中蛋白质和磷含量显著上升。
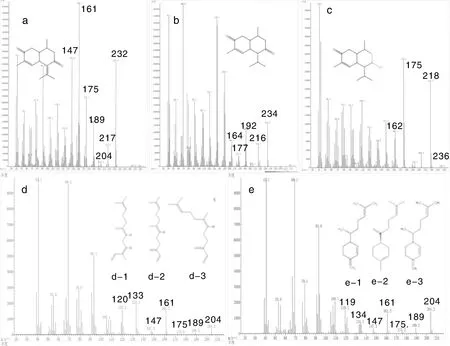
a,Euptox A;b,CED;c,7-羟基杜松烷-3-烯-2-酮;d,β-法呢烯(d-1,α-法呢烯;d-2,β-法呢烯;d-3,cis-β-法呢烯);e,β-红没药烯(e-1,β-倍半水芹烯;e-2:β-红没药烯;e-3:β-倍半水芹烯)。a, Euptox A; b, CED; c, 7-Hydroxycadinan-3-ene-2-one; d, β-Farnenee(d-1, α-Farnenee; d-2, β-Farnenee; d-3, cis-β-Farnenee); e, β-Sesquiphellandrene(e-1, β-Sesquiphellandrene; e-2, β-Bisabolene; e-3, β-Sesquiphellandrene).图2 紫茎泽兰提取物的质谱图和结构式Fig.2 Mass spectrum and structure formula of Ageratina adenophora extract
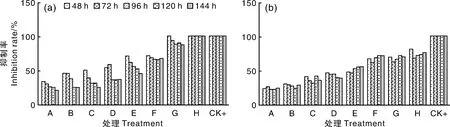
图3 紫茎泽兰提取物中euptox A(a)和CED(b)对石膏样小孢子菌菌丝生长的抑制率Fig.3 Inhibition rate of mycelium growth of Microsporum gypseum by euptox A (a) and CED (b)
表1 不同时间药物质量浓度与抑制率的线性关系
Table1Relationship between inhibition rate with concentrations of euptox A and CED at different time

t/hEuptox ACED48 y=0.188 6×log2(x/3.9)-0.140 9y=0.089 7×log2(x/0.79)+0.286 772 y=0.156 7×log2(x/3.9)+0.225 4y=0.081 0×log2(x/0.79)+0.195 696 y=0.177 8×log2(x/3.9)-0.059 3y=0.089 6×log2(x/0.79)+0.174 0120 y=0.156 4×log2(x/3.9)+0.206 4y=0.092 5×log2(x/0.79)+0.180 0144 y=0.141 2×log2(x/3.9)-0.029 4y=0.091 7×log2(x/0.79)+0.184 2
表2euptoxA和CED对石膏样小孢子菌的IC50、MIC、MFC值
Table2IC50, MIC, MFC of euptox A and CED againstMicrosporumgypseum
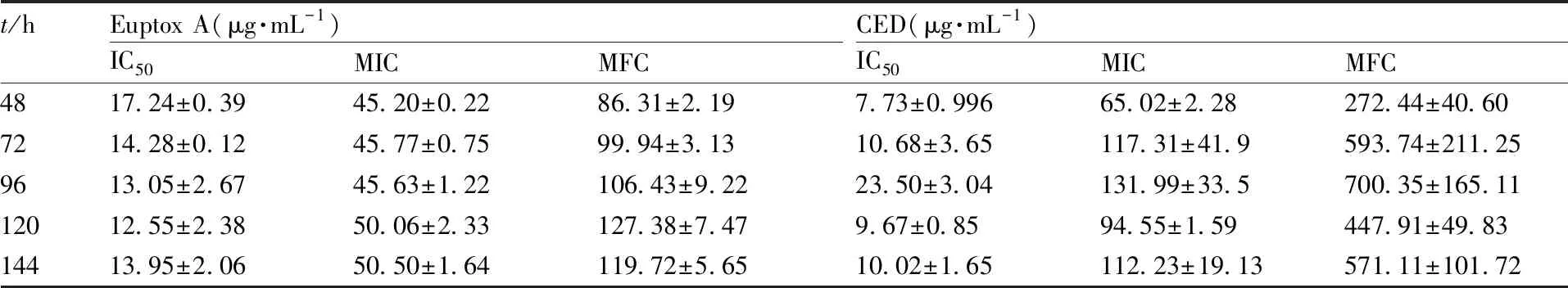
t/hEuptox A(μg·mL-1)IC50MICMFCCED(μg·mL-1)IC50MICMFC4817.24±0.3945.20±0.2286.31±2.197.73±0.99665.02±2.28272.44±40.607214.28±0.1245.77±0.7599.94±3.1310.68±3.65117.31±41.9593.74±211.259613.05±2.6745.63±1.22106.43±9.2223.50±3.04131.99±33.5700.35±165.1112012.55±2.3850.06±2.33127.38±7.479.67±0.8594.55±1.59447.91±49.8314413.95±2.0650.50±1.64119.72±5.6510.02±1.65112.23±19.13571.11±101.72

a,CK;b~e中euptox A的质量浓度依次为22.6、45.2、67.8、90.4 μg·mL-1。a,CK. Concentrations of euptox A in b~e were 22.6, 45.2, 67.8, 90.4 μg·mL-1, respectively.图4 euptox A对石膏样小孢子菌菌丝细胞膜完整性的影响Fig.4 Effect of euptox A on membrane permeabilization of Microsporum gypseum
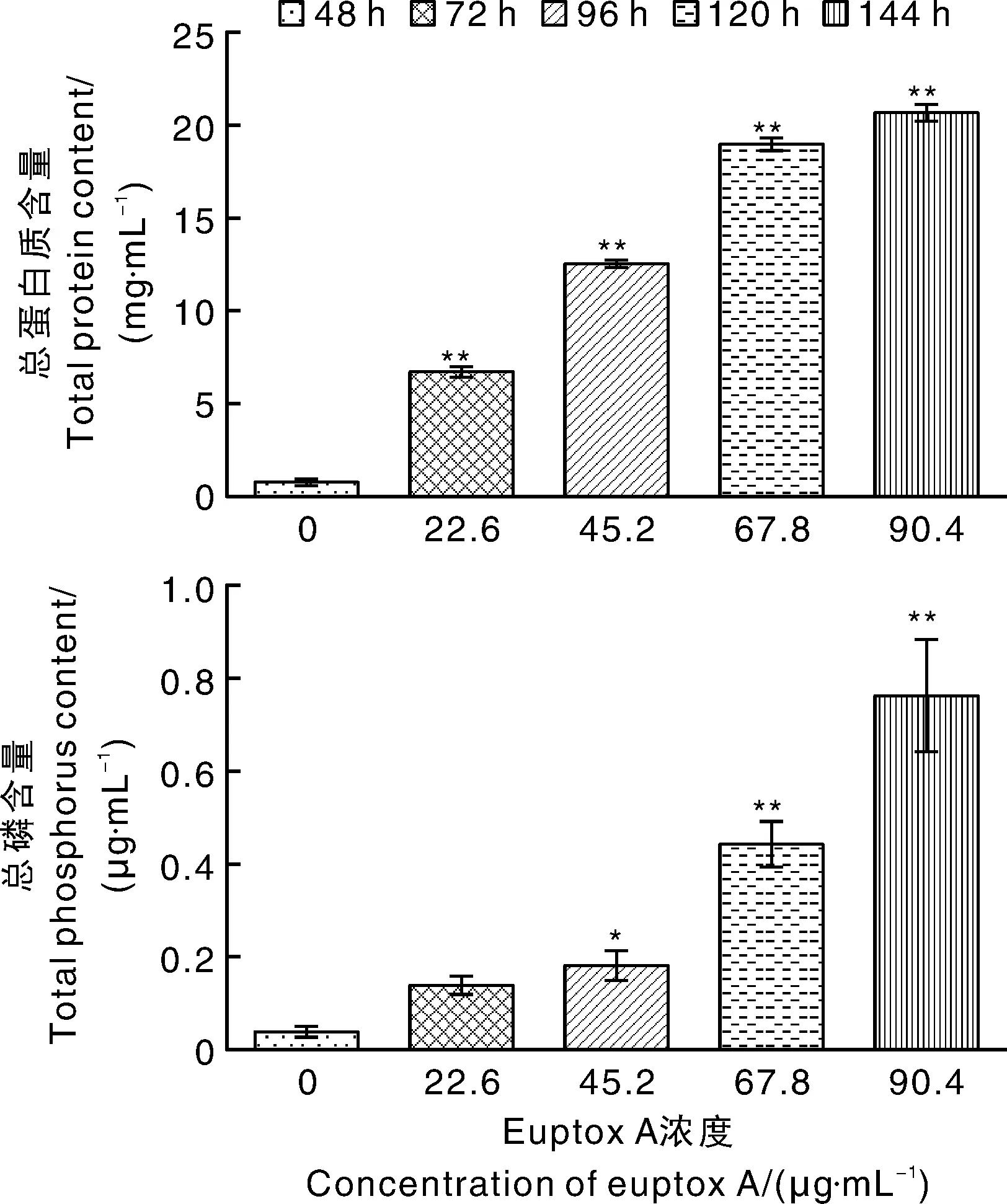
标*和**的表示与CK差异显著(P<0.05)或极显著(P<0.01)。* and ** indicated significant difference with CK at P<0.05 and P<0.01, respectively.图5 euptox A对石膏样小孢子菌细胞外液总蛋白质和总磷含量的影响Fig.5 Effects of euptox A on extracellular protein and phosphorus content of Microsporum gypseum
2.3.3 对真菌麦角固醇合成的影响
经不同浓度euptox A作用12 h后,石膏样小孢子菌细胞膜中的麦角固醇含量较CK均极显著(P<0.01)降低,且随着euptox A质量浓度上升,菌丝中的麦角固醇含量降低。结果表明:euptox A可抑制石膏样小孢子菌细胞膜中的麦角固醇合成,且浓度越高抑制效果越好。
表3euptoxA对石膏样小孢子菌细胞膜麦角固醇含量的影响
Table3Effect of euptox A on ergo-sterol content ofMicrosporumgypseum
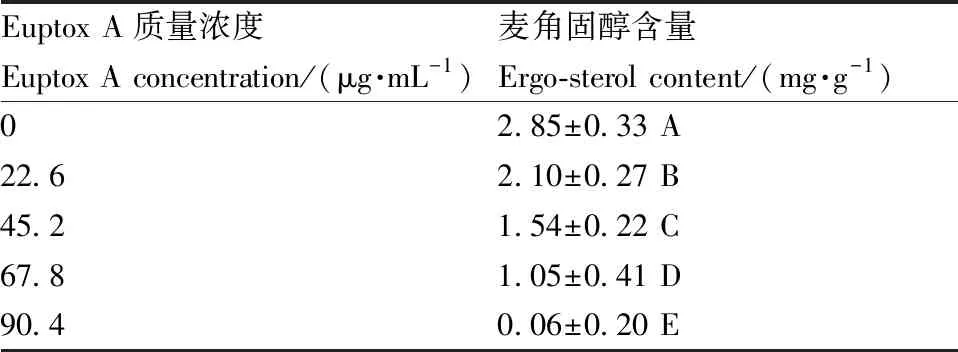
Euptox A质量浓度Euptox A concentration/(μg·mL-1)麦角固醇含量Ergo-sterol content/(mg·g-1)02.85±0.33 A22.62.10±0.27 B45.21.54±0.22 C67.81.05±0.41 D90.40.06±0.20 E
同列数据后无相同大写字母的表示差异极显著(P<0.01)。
Data within the same column marked without the same letters indicated significant difference atP<0.01.
3 讨论
以往的研究表明,euptox A为无色或淡黄色油状物[13-14]。本试验分离得到的euptox A为白色晶体,可在乙酸乙酯、二氯甲烷等多种有机溶剂中反复结晶,在硅胶柱层析中发现,28 ℃时可得到白色晶体状euptox A,推断euptox A对温度较敏感,可根据温度改变自身状态。
以往的研究从紫茎泽兰提取物中主要发现有苯丙素类、黄酮类、甾体类、醇类、萜类、烃类等化合物[15-17]。萜类化合物多具有良好的抗真菌活性,euptox A是紫茎泽兰中最常见的倍半萜类物质。生物学活性研究表明,经硅胶柱层析分离的euptox A及其4种衍生物对立枯丝核菌、齐整小核菌、尖孢镰刀菌等植物病原真菌具有较强的生长抑制作用[13,18]。本试验结果表明,euptox A对皮肤真菌同样具有较强的抑制作用,有望开发为新型抗真菌药物。
在正常细胞悬液中,PI染液难以进入细胞内,主要分布在细胞外液中,只有当细胞膜受到损伤后,PI才能通过细胞膜上的孔隙进入细胞内;因此,PI染色后若细胞内出现强荧光则表明细胞膜完整性受到破坏[19]。蛋白质和磷在正常细胞中主要分布于细胞内,当细胞膜的完整性受到破坏时,细胞内的蛋白质和磷会经细胞膜上的孔隙向细胞外泄露[3],导致细胞外液中蛋白质和磷含量上升。麦角固醇是细胞膜的重要组成成分,参与调节细胞膜通透性,对细胞膜完整性具有重要意义,是临床治疗中多烯类抗真菌药物和唑类抗真菌药物的作用靶点。最新筛选的抗真菌物质,大多通过作用于麦角固醇导致真菌细胞膜穿孔,细胞因代谢紊乱而死亡[20-21]。夏忠弟等[22]证明,单萜类化合物α-蒎烯可通过抑制细胞壁多糖成分、胞膜麦角固醇的合成导致菌细胞破裂而起到杀菌作用;刘丽英[23]的研究也表明,二萜类化合物土槿乙酸可通过抑制白色念珠菌细胞壁几丁质合成酶活性和细胞膜中麦角固醇的合成而发挥抗真菌作用。本试验结果显示,不同浓度的euptox A作用于石膏样小孢子菌后,可通过抑制其麦角固醇合成,致使细胞膜完整性受到破坏,导致细胞内外物质交换紊乱,最终引起真菌细胞死亡。

