滇牡丹中3个类查尔酮合成酶基因的克隆与表达
原晓龙,李云琴,王 毅
(云南省林业科学院 云南省森林植物培育与开发利用重点实验室,国家林业和草原局云南珍稀濒特森林植物保护和繁育重点实验室,云南 昆明 650201)
滇牡丹(Paeoniadelavayi)属芍药科(Paeoniaceae)芍药属(Paeonia)牡丹组(Sect.Moutan)落叶小灌木,是中国西南地区特有的牡丹种[1]。黄色花滇牡丹在牡丹花色改良过程中是一种珍稀的育种资源[2]。目前,已从滇牡丹黄色花瓣中分离得到查尔酮、黄酮和黄酮醇等黄酮类色素[3],其中,查尔酮是使花朵呈现黄色的主要黄酮类物质之一[4-5]。利用植物基因工程技术在花卉原有性状不丧失的前提下对其花色性状进行定向修饰,可获得特定色彩的花卉[6-7]。从滇牡丹中分离其特有的黄色花系基因,可为培育具黄色性状的牡丹观赏新品种提供重要的基因资源。
查尔酮合成酶(chalcone synthase, CHS, EC2.3.1.47)属于植物Ⅲ型聚酮合酶家族的一员,该酶家族包括芪合成酶(stilbene synthase, STS)、吖啶酮合成酶(acridone synthase)、吡喃酮合成酶(pyrone synthase)等[8-9]。CHS是类黄酮类化合物生物合成过程的关键酶和限速酶[10],催化1分子的p-香豆酰CoA或p-二氢香豆酰CoA与3个源于丙二酰CoA的二碳单位形成黄色柚皮素查尔酮(naringenin chalcone)、根皮素(phloretin)或芪类化合物,这些化合物是类黄酮生物合成过程中的重要中间产物,为其提供了基本的碳骨架[9,11]。CHS在植物中的表达量及其存在与否可影响植物中类黄酮类物质的含量,可能改变花色的深浅程度[6]。已从多种植物中分离出CHS基因,如松叶蕨(Psilotumnudum)[12]、苹果属(Malus)[13]植物等。研究表明,CHS在调控合成速率方面扮演重要角色[8],CHS基因表达受紫外线、机械创伤或病原体侵害影响[9]。为了解滇牡丹(Paeoniadelavayi)中CHS基因在类黄酮生物合成中的作用,本研究从滇牡丹中克隆了3条CHS基因,利用生物信息学手段研究其理化性质、序列差异和功能分歧等,并检测这3条CHS基因在不同花发育时期的表达量,以期阐明CHS基因在花色形成和表达中的作用、调控方式,旨在为利用CHS基因培育黄色观赏牡丹新品种提供理论依据。
1 材料与方法
1.1 材料
样品采自云南省迪庆州香格里拉市高山植物园(99°21.5″E,27.5′6.9″N)。按株采集不同时期的黄花样品并按株区分保存,3次重复,用于基因表达分析;用于转录组分析的黄花样品在花开时采集。采集后样品迅速置于液氮,带回实验室储存在-80 ℃冰箱。
1.2 器材与试剂
PCR仪(Biorad, USA),NanoDropTM 2000 (Thermo,USA)。EasyPfu DNA聚合酶、反转录试剂盒(北京全式金生物技术有限公司),植物总RNA提取试剂盒(Qiagen),琼脂糖凝胶DNA回收试剂盒(Thermo,USA)。
1.3 总RNA提取和cDNA合成
用植物总RNA提取试剂盒提取各样品的总RNA,分别用1%的琼脂糖凝胶电泳和NanoDropTM 2000超微量分光光度计检测所提取RNA的质量与浓度。选取各样品中质量、浓度合适的总RNA用于合成cDNA的第一条链,具体操作步骤按照反转录试剂盒的说明书进行,cDNA置于-20 ℃冰箱保存。
1.4 CHS基因的克隆
以拟南芥(Arabidopsisthaliana)的CHS基因为模板,对滇牡丹花瓣转录组数据进行本地BLAST以搜索可能的CHS基因,获得3条可能的CHS基因。根据这3条基因序列,用Primer premier 5.0设计特异克隆引物,PdCHS1F: 5’-ATGGTGACAGTGGAGGAGAT-3’,PdCHS1R: 5’-ATAGTGCGGCTACTAATTAG-3’;PdCHS2F: 5’-ATGGCTTCAGTTGAAGAAAT-3’,PdCHS2R: 5’-CAATTACAATCAGTGAGTGA-3’;PdCHS3F: 5’-ATGTCGCGCATTCCCACAGC-3’,PdCHS3R: 5’-TCCTTATCCGTAGCCTCTAA-3’。引物由上海铂尚生物科技有限公司合成。
以滇牡丹花瓣的cDNA为模板进行CHS基因的扩增,用1%琼脂糖凝胶电泳检测PCR产物,回收纯化目的片段后,将其连接到pMD18-T克隆载体上,经菌落PCR检测后,选择阳性克隆送生工生物工程(上海)股份有限公司进行测序。
1.5 滇牡丹CHS基因的生物信息学分析
获得滇牡丹的CHS基因序列后,利用NCBI (http://www.ncbi.nlm.nih.gov/)上的ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)分析获得其氨基酸序列,借助于在线工具ProParam (http: / /web. expasy.org /protparam/)预测CHS蛋白的理化性质;用SignalP 4.1 server (http://www.cbs.dtu.dk/services/SignalP/)预测该蛋白信号肽;用NCBI中的CDD数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/)搜索CHS蛋白结构功能域。参考经过功能鉴定的CHS蛋白[14],与本研究获得的3条CHS蛋白进行聚类分析,用MEGA 6.0中的Clustal W进行多序列比对后,采用邻位相接法,自检举值1 000,其余参数选用默认参数,构建系统进化树。
1.6 滇牡丹CHS基因的转录水平分析
根据3条已获得的CHS基因,用Primer premier 5.0设计特异检测引物TPdCHS1F: 5’-AACAGTGAGGACAAGGTC-3’,TPdCHS1R: 5’-TTATTTTGGACCAAATGA-3’;TPdCHS2F: 5’-ATAAACAAACGCTATATG-3’,TPdCHS2F: 5’-ATTTATATTAGATGAGAC-3’;TPdCHS3F: 5’-AGACAAGTTATTCCTCAA-3’,TPdCHS3R: 5’-ACTATGGAAATGTGAGTA-3’。以表达量一致的内参基因actin为对照,对PdCHS1、PdCHS2、PdCHS3基因在黄色滇牡丹盛花期的雄蕊和不同发育时期花中的具体表达情况进行检测。
PCR产物在1%的琼脂糖凝胶上进行电泳检测,再利用凝胶电泳图像分析软件GENE-SNAPS分析其积分光密度,用目的基因/内参基因的积分光密度比值在Excel上绘制柱状图,对PdCHS基因的不同表达量进行相对定量分析。
2 结果与分析
2.1 滇牡丹的CHS基因序列
测序结果表明,滇牡丹中3条CHS基因的cDNA全长分别为1 173、1 185、1 128 bp,分别命名为PdCHS1(GenBank登录号MK516264)、PdCHS2(GenBank登录号MK516265)和PdCHS3(GenBank登录号MK516266);它们均编码完整的开放阅读框,长度分别为390、394、375 aa,其转录产物均为CHS;在蛋白序列一致性方面,PdCHS1和PdCHS2的一致性为84.52%,PdCHS1和PdCHS3的一致性为39.34%,PdCHS2和PdCHS3的一致性为39.09%。滇牡丹的这3个查尔酮合成酶蛋白保守性较高(图1),均含有查尔酮合成酶的高度保守序列VGQALFGDGAAAI(PdCHS3仅有1个氨基酸不同,为VGAALFGDGAAAV)和HPGGPAIL,以及Cys-His-Asn(C-H-N)3个氨基酸组成的三联体活性中心,2个极度保守的苯丙氨酸残基F215和F265,这些部位与查尔酮合成酶的底物特异性有关[15]。此外,PdCHS还含有查尔酮合成酶催化活性部位,PdCHS1和PdCHS2含有查尔酮合成酶活性位点基序(GFGPG),PdCHS3的活性位点基序为AFGPG,3个蛋白序列的催化活性基序仅有1个氨基酸差异(图1),已通过氨基酸定点突变确定[16]。
2.2 滇牡丹CHS蛋白的生物信息学分析
生物信息学分析结果(表1)显示:3个CHS蛋白的氨基酸残基数量为375~394 aa,相对分子质量为41.2~43.3 ku;PdCHS1为稳定蛋白,PdCHS2和PdCHS3为不稳定蛋白,这3个蛋白均为疏水性蛋白,不存在信号肽。分子系统进化分析(图2)显示:这3个蛋白属于不同的分支,其中,PdCHS1与木薯(Manihotesculenta, XP_021608720)、橡胶(Heveabrasiliensis, XP_021648729)、小桐子(Jatrophacurcas, NP_001295723)一起聚在Ⅰa分支,编码柚皮素查尔酮合成酶,可能参与柚皮素(Naringenin)的生物合成;PdCHS2与拟南芥(Arabidopsisthaliana, NP_196897)、琴叶拟南芥(Arabidopsislyrata, XP_002871591)、芸香(Rutagraveolens, CAC14059)和柑橘(Citrussinensis, NP_001306986)聚在分支Ⅲ,编码芪合成酶,可能参与白藜芦醇(resveratrol)的生物合成;PdCHS3与欧洲栓皮栎(Quercussuber, XP_023913768)、小桐子(J.curcas, XP_020538589)和橡胶(H.brasiliensis, XP_021683368)聚在分支Ⅳ,编码Ⅲ型聚酮合酶,可能参与三角状五肽类化合物的生物合成。

●,Cys-His-Asn 三联活性中心;◆,苯丙氨酸残基Phe (F215和F265);ELKLGL,丙二酰辅酶A结合域;GFGPG,催化活性基序。□圈出的为CHS高度保守序列。●, Cys-His-Asn triple active center; ◆, Phenylaanine residues Phe (F215 and F265); ELKLGL, Malonyl-CoA binding region; GFGPG, Catalytic activities motif. □ indicated highly conserved sequence in CHS.图1 PdCHS氨基酸序列比对分析Fig.1 Alignment of PdCHS amino acids sequences
表1 滇牡丹3个查尔酮合成酶的生物信息学分析
Table1Bioinformatics analysis of three chalcone synthases fromPaeoniadelavayi
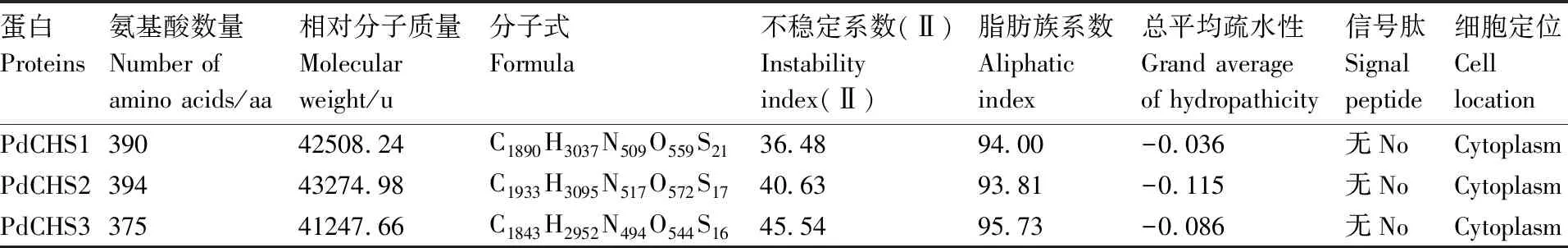
蛋白Proteins氨基酸数量Number ofamino acids/aa相对分子质量Molecularweight/u分子式Formula不稳定系数(Ⅱ)Instabilityindex(Ⅱ)脂肪族系数Aliphaticindex总平均疏水性Grand averageof hydropathicity信号肽Signalpeptide细胞定位CelllocationPdCHS139042508.24C1890H3037N509O559S2136.4894.00-0.036无NoCytoplasmPdCHS239443274.98C1933H3095N517O572S1740.6393.81-0.115无NoCytoplasmPdCHS337541247.66C1843H2952N494O544S1645.5495.73-0.086无NoCytoplasm
2.3 滇牡丹CHS基因的表达模式
滇牡丹中3条CHS基因表达结果(表2)显示:除初花期外,末花期、盛花期、花蕾期、雄蕊3条CHS基因表达量差异均达极显著水平。在不同发育时期,3条基因的表达差异显著性不同。其中,PdCHS1基因在各发育时期表达量差异极显著;除初花期和末花期差异不显著外,其他发育时期PdCHS2基因表达差异达极显著水平;PdCHS3基因在初花期、盛花期和雄蕊中表达无显著差异,其他发育时期表达差异均极显著。具体表现为:在不同花发育时期,PdCHS1基因在花花蕾期最高,随着花的发育其表达量迅速降低,初花期、盛花期、末花期逐渐降低,但盛花期雄蕊中该基因表达量高于其他时期的花;随着花的发育,PdCHS2基因表达量呈现升高、降低再升高的趋势,具体表达量为末花期>初花期>盛花期>雄蕊>花蕾期;PdCHS3基因则出现先降低再升高的趋势,其具体表达量为末花期>花蕾期>盛花期>雄蕊>初花期。

图2 滇牡丹CHS蛋白与其他植物CHS蛋白的系统进化分析Fig.2 Dendrogram of CHS protein in Paeonia delavayi and other CHSs from higher plants
表2 不同花发育时期PdCHS基因的表达量
Table2PdCHSgene expression difference between multi-developmental periods of flowers
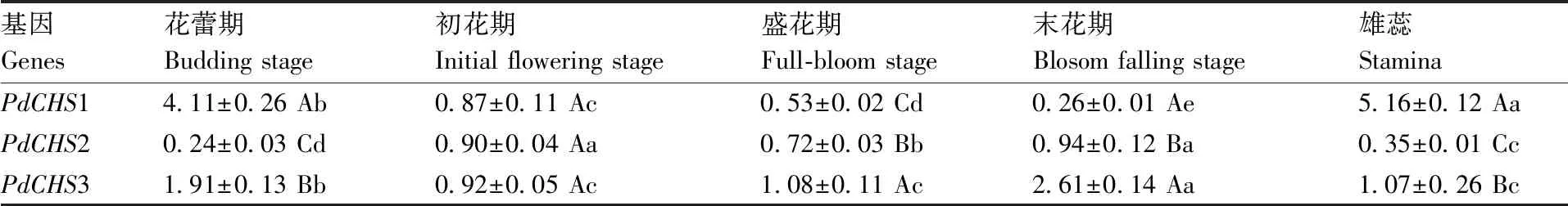
基因Genes花蕾期Budding stage初花期Initial flowering stage盛花期Full-bloom stage末花期Blosom falling stage雄蕊StaminaPdCHS14.11±0.26 Ab0.87±0.11 Ac0.53±0.02 Cd0.26±0.01 Ae5.16±0.12 AaPdCHS20.24±0.03 Cd0.90±0.04 Aa0.72±0.03 Bb0.94±0.12 Ba0.35±0.01 CcPdCHS31.91±0.13 Bb0.92±0.05 Ac1.08±0.11 Ac2.61±0.14 Aa1.07±0.26 Bc
同列数据后无相同大写字母代表基因在相同发育时期表达水平差异极显著(P<0.01),同行数据后无相同小写字母代表同一基因在不同花发育时期的表达水平差异极显著(P<0.01)。
Data marked without the same uppercase letter in each column indicated expression differences of genes in the same developmental period were significant atP<0.01. Data marked without the same lowercase letter in each row indicated expression differences of the same gene in the different developmental periods were significant atP<0.01.
3 结论与讨论
CHS在不同物种间的基因序列长度差异较小,同源性较高,蛋白序列高度保守[7,17]。各物种中均可分离出数个CHS基因[18-19]。迄今为止,在NCBI上已注册超过5 000条与CHS有关的基因序列,从不同植物中分离鉴定出超过650个CHS家族基因[20],这些基因所编码的蛋白质基本为稳定的单链疏水性蛋白,定位于细胞质基质中[17,21]。本研究从滇牡丹中分离纯化的3个CHS基因(PdCHS1、PdCHS2、PdCHS3)与前述的研究结果一致,但在稳定性方面,仅有PdCHS1为稳定蛋白,PdCHS2和PdCHS3均为不稳定蛋白。在同一物种中,分离得到的CHS基因的功能相似,如苹果中的MdCHS1、MdCHS2、MdCHS3均行使CHS功能[11],而本研究从滇牡丹中分离的3个CHS基因功能却存在一定的差异。
CHS参与植物类黄酮的生物合成[22],能限制类黄酮后续生物合成的通量[11];类黄酮的生物合成受多重因素影响,其累积程度可影响花色深浅[23-24],具明显的种群、种属特性[25]。本研究以开黄花的滇牡丹为研究对象发现,CHS基因在花发育不同时期表达量有差异,同一时期不同CHS基因的表达量也存在较大差异,推测CHS基因表达量的变化可导致植物体内类黄酮累积程度不同,进一步影响植物花色[10,26];同一植物中不同CHS基因在不同环境、组织的表达量均存在显著差异[6,11,27],如角堇(Violacornuta)CHS基因在光照条件下的表达量远高于暗环境[6],苹果的CHS基因在不同组织中表达量不同[11]。本研究中滇牡丹的3个CHS基因表达量存在显著差异,可能与各基因参与不同的次生代谢产物生物合成相关。其中,PdCHS1基因在花发育初期表达量最高,可能与其负责查尔酮合成相关,与苹果中的3个CHS基因在幼嫩组织中表达量较高一致[11];PdCHS2基因在花发育前期表达量较低、后期升高,可能与其参与芪类化合物生物合成、形成植物抗毒素抵御病虫害侵袭有关[16];PdCHS3基因在花蕾期和末花期表达量较高,推测其参与聚酮类化合物的生物合成,可能与提高植物抗性、抵御胁迫和病虫害侵袭有关。本研究从滇牡丹中克隆得到3条功能不同、表达差异显著的CHS基因,为牡丹花色育种提供了基础的基因材料,但仍需进一步探明这3个基因在花色形成过程中的具体功能和作用部位。

