HN-AD菌强化3D-RBC处理养猪废水及微生物特性研究
刘向阳,张 千*,吴 恒,陈 旺,盛小红,念海明,肖芃颖,赵天涛
HN-AD菌强化3D-RBC处理养猪废水及微生物特性研究
刘向阳1,张 千1*,吴 恒1,陈 旺1,盛小红1,念海明2,肖芃颖1,赵天涛1
(1.重庆理工大学化学化工学院,重庆 400054;2.重庆川仪环境科技有限公司,重庆 401121)
针对现有养猪废水处理工艺中普遍存在的高氨氮(NH4+-N)生物毒性大、工艺流程长、运行成本高和脱氮效果差等问题,采用耐受性强的异养硝化-好氧反硝化(HN-AD)菌挂膜启动三维结构生物转盘(3D-RBC)预处理养猪废水,仅需15d就完成了3D-RBC反应器的快速挂膜.采用调节盘片线速度和C/N的方式,仅65d实现了HN-AD菌在反应器中的富集及养猪废水预处理工艺的启动.采用该工艺对实际养猪废水进行处理,结果表明,HN-AD菌剂挂膜的3D-RBC工艺耐受高氨氮性能强,原水中COD、NH4+-N、TN的去除率高达69.8%、87.9%和79.5%,污染物削减效果明显优于传统工艺.采用高通量测序技术研究了功能菌优势化构建过程中微生物群落结构的变化规律,结果表明,生物膜内具有HN-AD功能的优势菌由盐单胞菌属()、不动杆菌属()逐渐变为丛毛单胞菌属()、嗜氢菌属()等,且后者的相对丰度逐渐上升.扫描电子显微镜结果显示,生物膜以丝状菌为骨架,紧密附着在盘片上的生物膜层表面聚集了以杆状和球状为主的微生物,这与生物多样性分析得出的结论较一致.
养猪废水;3D-RBC预处理工艺;HN-AD菌;微生物群落结构
当前,畜禽养殖污染已经成为农业面源污染的主要来源[1].其中,养猪废水属于悬浮物、有机污染物和氨氮“三高”的有机废水[2],由于其处理成本高,处理难度大,大量未经处理的养猪废水直接排放,对农村生态和环境造成严重破坏[3-4].如何高效处理该类废水,已成为制约畜禽养殖产业发展的瓶颈.对于规模化养猪废水,目前国内外采用的主要处理工艺主要是厌氧-自然处理联合或厌氧-好氧联合工艺[5-7],养殖废水经过厌氧发酵处理后,虽然大部分COD被去除,但氨氮只是形态发生变化,浓度仍然很高,造成了低碳、高氨氮沼液的产生,导致C/N严重失调,脱氮效果差[8-9].传统脱氮工艺处理沼液时,由于高氨氮对微生物的毒害作用,使得传统脱氮微生物生长及活性受到抑制.同时,沼液碳源不足,造成反硝化过程受阻,最终导致工艺流程复杂、处理成本高和脱氮效果差等系列问题.鉴于此,本研究基于异养硝化-好氧反硝化(HN-AD)脱氮原理提出了一种新型的养猪废水预处理工艺.
该新型工艺以具有高效HN-AD性能的功能菌为接种菌剂,借助生物膜反应器内载体的吸附实现菌剂的固定,借助自然接触复氧的方式获得好氧环境,通过反应器结构和运行条件优化,最终以生物膜的形式实现HN-AD菌的富集,形成好氧生物膜脱氮工艺.和传统组合工艺相比[9],该工艺具有耐高COD (>10000mg/L)、耐高NH4+-N(>800mg/L)以及NH4+- N和TN去除效率高等优势,直接在好氧条件下就能实现畜禽养殖废水原水中有机物和NH4+-N浓度的大幅削减,同时原水中残留有机物的可生化性能也未发生改变,缩短工艺流程的同时为后续工艺的稳定高效运行创造了有利条件.采用菌剂挂膜的方式结合三维结构生物转盘(3D-RBC)的巨大比表面积可显著缩短启动时间,并且有利于HN-AD菌的优势化构建.此外,生物转盘在低功率电机带动下就可以实现反应器内的好氧环境,显著降低了工艺的运行成本.
近年来,国内外对畜禽养殖废水厌氧预处理的研究较多,而采用好氧生物膜反应器预处理养殖废水的研究则鲜有报道.因此,本研究以课题组前期获得的HN-AD菌接种并挂膜启动3D-RBC反应器,重点考察了3D-RBC预处理工艺的启动运行情况及其对养猪废水原水的预处理效果.在上述研究基础上,采用扫描电镜(SEM)观察分析了生物膜表面的微观形态,并结合Illumina MiSeq测序技术,分析预处理工艺启动阶段生物膜中微生物多样性的变化规律,以期为畜禽养殖废水处理提供新的工艺解决策略和微生物理论基础.
1 材料与方法
1.1 预处理工艺实验装置
预处理工艺的实验装置及系统流程如图1所示.生物转盘反应器所用盘片[10-11]由重庆川仪环境科技有限公司提供,材质为改性PP,盘片设计为三维结构可提高生物膜附着力且有利于气水流通.池体由厚度为5mm的有机玻璃制成五边形凹槽,有效容积为2.4L,启动前直接向反应器中接种HN-AD菌,同时添加营养物质以供菌剂生长.转轴串联带动4级表面凸起的三维结构盘片,其中,第一级、第二级和第三极、第四级盘片分别定义为生物转盘的前端、中端、后端.盘片浸没率为40%,每级盘片厚度为7cm,各级盘片间相距2cm,盘片直径为14cm,盘片用低速电机驱动.
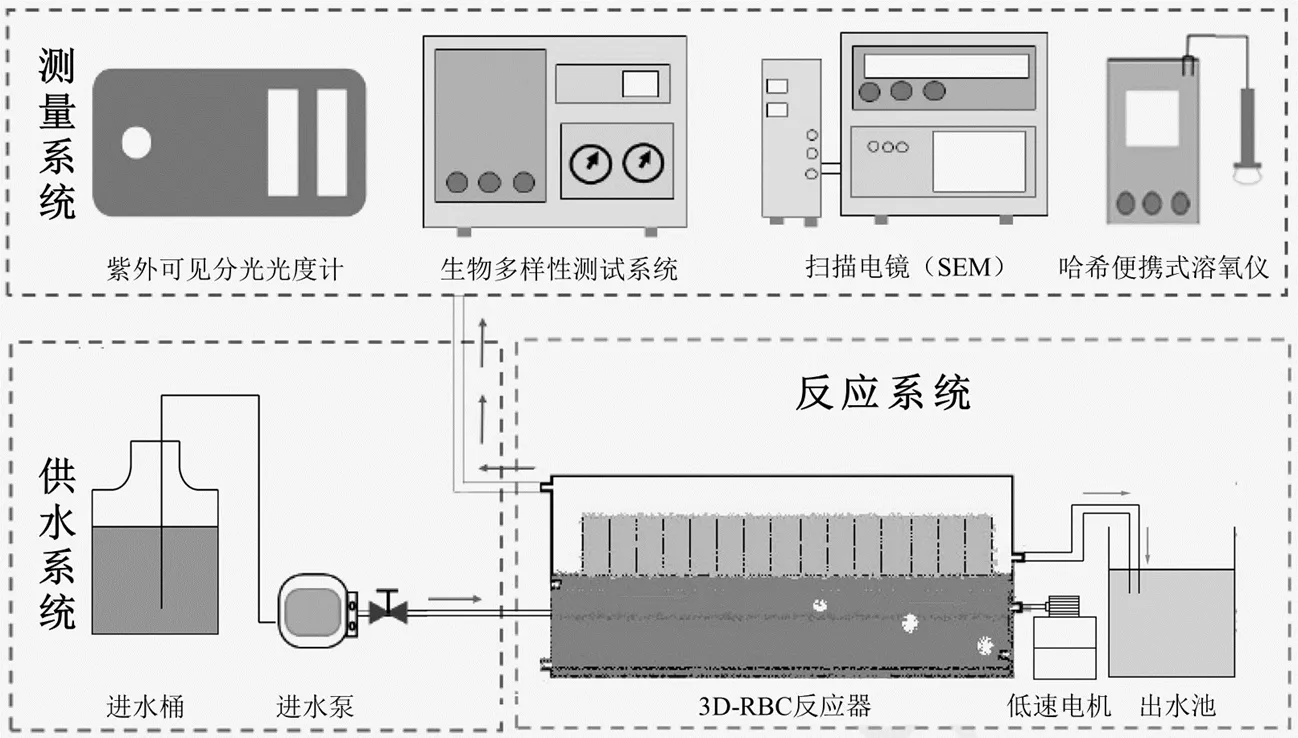
图1 HN-AD菌强化3D-RBC预处理高氨氮养猪废水系统图
1.2 HN-AD菌
HN-AD菌由课题组前期从养猪废水环境样品中活化传代培养、分离、筛选得到.所述菌剂由贪铜菌SWA1(sp.SWA1)、粪产碱杆菌()、不动杆菌(和苍白杆菌TAC-2(sp.TAC-2)等复配而成.该菌剂具有耐高NH4+-N、耐高COD、生长周期短和易于培养等性能,并在性能验证实验中证实了NH4+-N和TN的去除分别由异养硝化和好氧反硝化完成,表明该菌剂具有异养硝化-好氧反硝化功能.
1.3 实验用水
实验用水为人工配水和真实养猪废水原水.序批式挂膜启动阶段,为人工配制的模拟养猪废水,COD浓度为2500~8000mg/L,NH4+-N浓度为500(±50)mg/L.其COD:TN=(5~15):1,以无水乙酸钠为碳源,以硫酸铵为氮源,以磷酸氢二钾为磷源,同时添加微量元素以保证菌液的正常生长,其中微量元素成分为MgSO4·7H2O 2g/L,MnSO4·H2O 0.1g/L, CaCl21.5g/L,FeSO4·7H2O 0.1g/L;系统稳定运行后,连续流处理真实养猪废水原水(取自重庆市巴南区某生猪养殖场固液分离后废水,对其进行过滤预处理后进反应器系统).其原水中COD、NH4+-N和TN的平均浓度分别为7773.1,687.9和790.3mg/L.
1.4 研究方法
生物转盘反应器启动分为2个阶段.序批式挂膜启动阶段,在温度为25~30℃,盘片线速度为1m/min,HRT=24h条件下,通过向生物转盘反应器中接种培养至对数期的高活性HN-AD菌,并采用间歇补加营养液的运行方式实现菌液挂膜,检测NH4+-N及表征菌液浓度吸光度值(OD600nm)的变化;连续流启动阶段,采用连续方式运行反应器,主要分为6阶段进行,每个阶段均运行2个周期(4d/周期).第1,2,3阶段保持C/N=5不变,调节盘片线速度分别为1, 7.5,15m/min.第4,5,6阶段保持盘片线速度为15m/ min不变,调节C/N分别为8,10,15;分别选择反应器序批式挂膜启动完成,连续流启动初期,后期不同盘片的生物膜混合样及连续流启动中期盘片沿程(前端,中端,后端)生物膜样品于-4℃低温保存,样品脱水预处理后进行SEM镜检及提取DAN进行微生物多样性分析.成功启动生物转盘反应器后,保持盘片线速度为15m/min,考察预处理工艺对真实养猪废水的前处理效果.
1.5 分析方法
本实验的水质指标均采用国家规定的标准方法,样品均采用平行测定[12],DO使用HQ-30d便携式溶解氧测定仪直接检测,COD指标使用LH-16K型标准化学需氧量消解仪,采用重铬酸钾法测定, NH4+-N采用纳氏试剂分光光度法,TN采用碱性过硫酸钾消解紫外分光光度法测定,OD600nm采用紫外分光光度法测定.
反应器启动阶段中的生物样品先采用冷冻干燥做脱水预处理[13],然后采用TESCAN MIRA3热场发射扫描电镜观察生物膜表面微观形态结构.DNA提取和高通量测序采用MobioPowerSoil® DNA Isolation Kit提取固定化菌液总基因组DNA[14]. MiSeq平台对16S rRNA基因高变区序列进行测序,测序区域选择V3+V4区,测序片段为468bp,测序引物为338F-806R,使用Trimmomatic、FLASH软件对MiSeq测序数据进行处理获得干净数据(如表1).在Usearch软件平台中使用uparse方法将序列按照彼此相似性为97%分归为许多小组,一个小组为一个OTU,从而得到OTU的代表序列.然后,使用uchime检测PCR扩增中产生的嵌合体序列并从OTU中去除,再用usearch_global方法将优化序列map比对回OTU代表序列,最终得到OTU各样品序列丰度统计表[15-16].

表1 样本数据统计表
2 结果与分析
2.1 序批式挂膜启动阶段NH4+-N、COD、TN及OD600nm的去除
如图2所示,菌液接种挂膜期间预处理工艺经历了3个阶段:第Ⅰ阶段(1~5d)为菌液吸附阶段.序批式菌液接种挂膜第3d,菌液OD600nm值急剧减小,NH4+-N、COD和TN平均去除率分别达98.3%, 83.8%和81.4%.菌液快速吸附在盘片上,盘片上可逐渐观察到一层微黄色的生物膜形成.第Ⅱ阶段(6~ 10d)为菌液富集阶段.待菌液NH4+-N、COD、TN浓度及OD600nm稳定至一定值时,添加营养液以供菌液生长富集.仅经过3d,菌液NH4+-N、COD、TN浓度分别降至30,250.8,108.3mg/L,去除率可分别达到94.3%,90.7%,81.4%;OD600nm升高至1.33,说明菌液已完成生长,盘片上的生物膜厚度逐渐增加,颜色由微黄色变为淡黄色.第Ⅲ阶段(11~15d)为生物膜富集阶段.当菌液生长到一定浓度时,继续添加营养液后菌液不生长,其OD600nm呈先升高再降低至稳定值,其NH4+-N、COD、TN浓度仍然可分别降解至6.6, 258.9,73.1mg/L并保持稳定,各污染物的去除率较高,菌液快速富集并挂膜成功,可明显观察到盘片上富集一层黄褐色生物膜,同时镜检发现生物膜表面存在很多杆状和球形状原生动物.
为了比较传统活性污泥挂膜启动运行情况,本研究同时建立了相同参数的3D-RBC反应系统,以生活污水厂活性污泥为接种污泥,研究结果表明,经活性污泥挂膜的3D-RBC需要经过33d盘片表面才能形成生物膜层.活性污泥挂膜的3D-RBC的NH4+-N浓度耐受极限值为400mg/L,当NH4+-N浓度大于400mg/L时,严重抑制系统内微生物的生长,导致污染物去除率迅速降低.采用HN-AD菌对生物转盘反应器接种挂膜启动,历时15d,盘片上成功富集一层黄褐色生物膜,相比于传统活性污泥挂膜法[17]{孙艺齐, 2017 #163;李卫平, 2015 #164},其挂膜启动时间明显缩短.且菌剂挂膜完成后,向系统内添加一定量的营养基质,菌液的OD600nm保持稳定不再生长且对NH4+-N具有较好的去除效果,表明菌液接种挂膜成功.
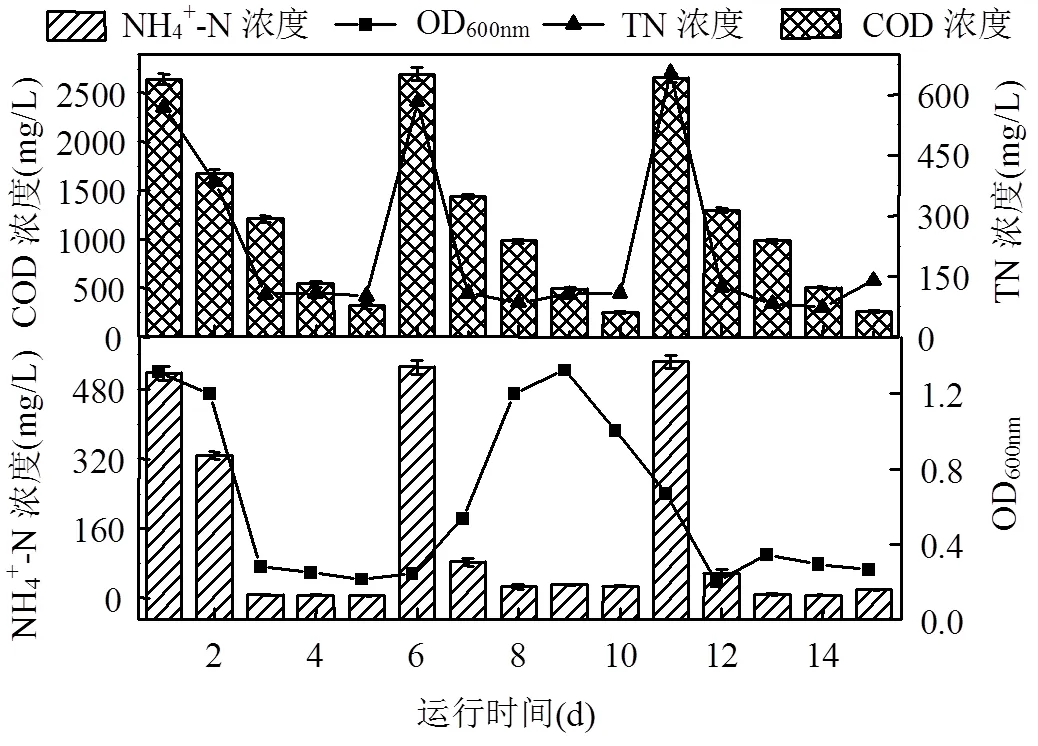
图2 菌液序批式挂膜启动过程中各水质指标的变化情况
2.2 连续流启动阶段NH4+-N、COD和TN的去除
如图3和表2所示,根据盘片线速度及C/N的变化将启动过程分为6阶段.
第1阶段(1~18d),容积负荷(以COD计)设定为2.51kg/(m3·d),进水COD为2510.9mg/L,NH4+-N浓度为535.3mg/L,第1阶段后期,可观察到盘片表面丝状菌的产生.由于处于连续流启动初期,盘片上固定的脱氮菌剂主要对污染物进行生物吸附及降解,工艺出水中COD、NH4+-N和TN去除率均在70%左右.第2阶段(19~34d),盘片线速度由1m/min升高到7.5m/min,系统DO升高,观察到盘片表面丝状菌逐渐脱落,有利于有机物及NH4+-N的去除.线速度为1m/min时,丝状菌快速生长,与HN-AD菌及其他脱氮菌呈竞争优势;线速度提高至7.5m/min后,系统内DO浓度提高,丝状菌明显减少,可能是丝状菌竞争处于劣势,系统内HN-AD菌及其他脱氮菌获得了更多的有机物和DO导致出水中COD和NH4+-N去除率均呈升高趋势.而丝状菌减少,导致TN去除率略有降低,推测是由于盘片生物膜层变薄,DO浓度提高,生物膜层内缺氧区变小,异养反硝化菌的反硝化能力降低所致.第3阶段(35~41d),将盘片线速度调至15m/min后,受线速度的抑制,盘片表面丝状菌进一步减少,且系统DO浓度增大,有利于有机污染的去除,COD去除率增加到86.3%.而线速度进一步增大,使NH4+-N和TN去除率均下降至70%以下.导致这一现象发生有2种可能,一种可能是线速度过大,液相中的污染物还未进入生物膜层内部,就随着盘片转动而进入废水中,纵向进入生物膜中的停留时间变短;另外一种可能是由于盘片剪切力增大,导致附着在盘片上部分生物膜脱落,使脱氮速率有所降低.
第4阶段(42~49d),C/N由5调整至8,COD去处率降低至71.2%,NH4+-N去除率升高至96.1%,TN去除率出现回升趋势.第5阶段(50~57d),调整C/N为10,COD和NH4+-N去除率均升高,TN去除率几乎不变.C/N提高后,可为微生物提供足够的碳源以降解污染物且DO浓度升高有利于碳源的消耗及NH4+-N的降解[18].第6阶段(58~65d),调整C/N为15,COD去除率升至89.3%,NH4+-N和TN去除率几乎保持不变.C/N过高,降解有机物所需氧含量增多,导致DO浓度降低.
由图3和表2可知,随着连续流启动阶段的进行,C/N低时(5),COD去除率随DO增加而增加,在DO浓度为2.3~4.7mg/L时,COD去除率可达71.3%~86.3%,当DO为4.7mg/L时,TN去除率降低. C/N过低,抑制反硝化过程,影响TN去除;C/N过高,去除效果变化不明显且增加了碳源补加的成本[19].另外盘片线速度可有效控制丝状菌的产生,当盘片线速度为15m/min时丝状菌明显减少且去除效果均有所上升.因此,为获得理想的硝化和脱氮效果,同时降低能耗,节约成本,预处理工艺连续流启动阶段应控制C/N为8~10,DO浓度为1.7~3.1mg/L,调整盘片线速度为15m/min.

a. COD去除效果; b. NH4+-N去除效果; c. TN去除效果; d. 原水去除效果
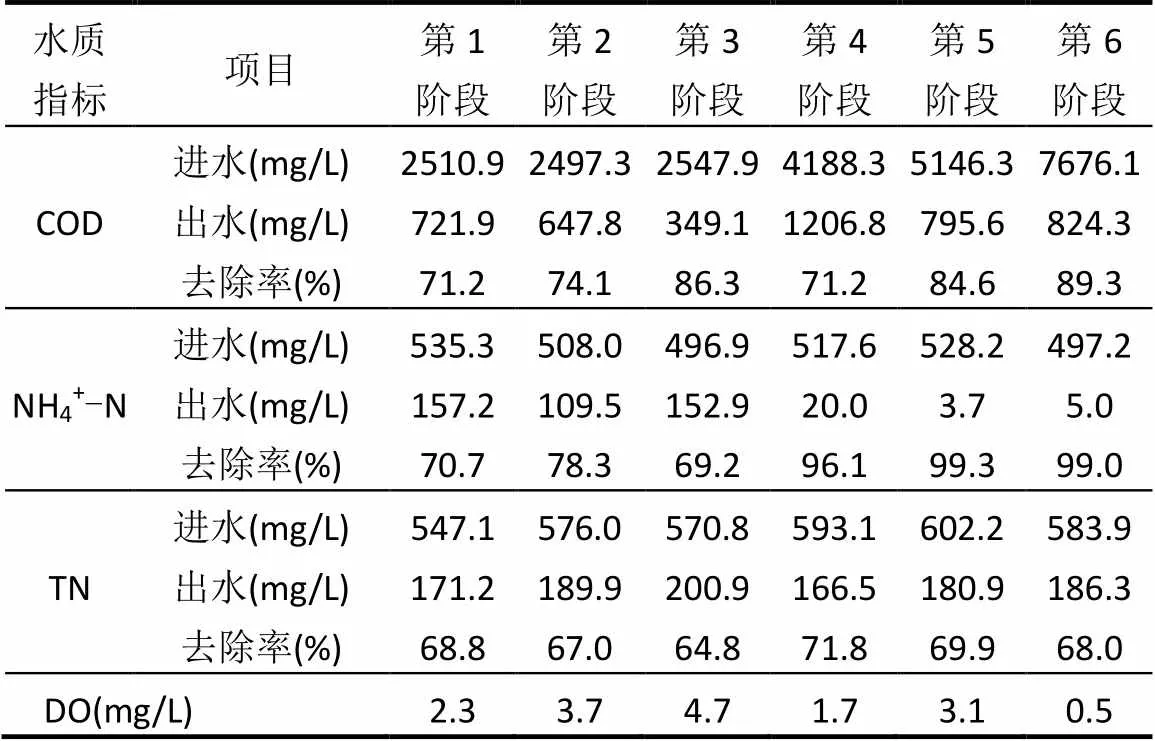
表2 预处理工艺在连续流启动过程中各阶段进出水水质指标
2.3 预处理工艺对养猪废水原水的前处理效果
工艺稳定运行5个周期后,原水中各指标均能实现较好的处理效果.具体运行情况如表3所示:其原水中COD、NH4+-N和TN的平均浓度分别从7773.1,687.9和790.3mg/L降低至2346.4,82.6和162.4mg/L,其平均去除率可分别达到69.8%,87.9%和79.5%,可在很大程度上实现污染物浓度的削减.采用该预处理工艺处理年出栏量5000头生猪的养猪废水原水,工程投资42万元,按照废水处理量45m3/d计算,折合药剂费(含菌剂)0.70元/m3、电费0.20元/m3和人工成本0.35元/m3,预处理综合成本为1.25元/m3,低于现有物化+厌氧预处理综合成本的2.43元/m3,降低了工艺运行和处理成本.

表3 预处理工艺对养猪废水原水的前处理效果
2.4 预处理工艺序批式挂膜启动阶段微生物群落结构变化分析
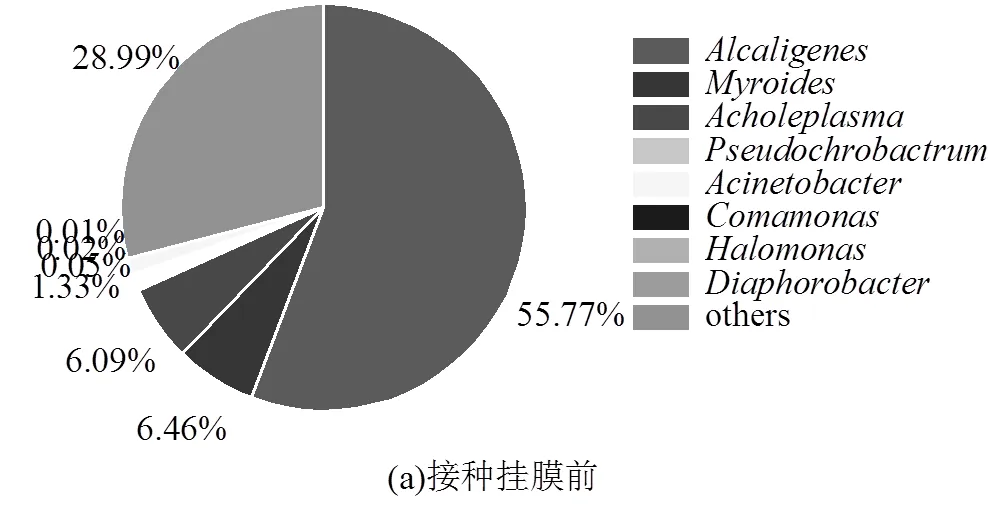
菌液接种挂膜前后优势菌属的相对丰度如图4所示.接种菌液时主要菌群为:产碱杆菌属() (55.69%)[20]、假苍白杆菌属()(1.36%)[21]、不动杆菌属() (1.33%)[22-23]等具有异养硝化-好氧反硝化功能的菌属;与接种菌液挂膜前相比,经过15d菌液挂膜后的主要的优势菌属为:黄杆菌属()[24](19.15%)、不动杆菌属()(11.39%)、盐单胞菌属() (16.39%)[25-26]、根瘤菌属()(15.53%)[27]、丛毛单胞菌属()(0.3%)[28].可见,在生物转盘反应器中接种菌液挂膜前后,系统内优势菌属的相对丰度存在一定的差异,不仅不动杆菌属的相对丰度显著增加,而且还出现了新的HN-AD功能优势菌属.
从图4可以看出,生物转盘反应器接种挂膜完成后的生物样中,具有HN-AD功能的菌属种类丰富且相对丰度明显高于接种菌液前,主要是由于随着接种挂膜过程的进行,系统内的AOB菌逐渐成为系统内的优势菌,有利于亚硝酸盐的积累.在硝化反应阶段,异养硝化细菌在反应器中快速生长;同时在盘片线速度过低的条件下,DO浓度下降.好氧反硝化菌在低DO浓度的情况下,以硝酸盐、亚硝酸盐为电子受体,反硝化能力增强,其含量增加,因此导致HN-AD菌属的种类及相对丰度均增加.如、、、等菌属的相对丰度均在菌剂挂膜后增加.结果表明,生物转盘反应器有利于功能微生物的富集,可保持菌液浓度的连续增长.生物盘片挂膜完成后,系统内起主要HN-AD作用的优势菌属分别为、、和菌,有助于实现NH4+-N的高效降解.
2.5 预处理工艺连续流启动阶段微生物群落结构时空变化
连续流启动阶段系统微生物群落结构时空变化如图5所示.从时间层面对比分析连续流启动前期、后期生物膜混合样品的群落结构发现,系统内具有HN-AD功能的脱氮优势菌属的种类及相对丰度发生变化.菌[29]、嗜氢菌属()[30]、的相对丰度分别从0.01%,0.005%,0.21%升高至2.18%,1.53%,3.41%,、、和菌的相对丰度分别从4.92%,2.15%, 1.78%,1.48%降低至0.27%,0.14%,0.044%,0.07%.结合图3可推测,连续流启动初期盘片线速度较小,丝状菌富集,和菌为主的HN-AD菌属相对丰度较小,因而去除效果不理想;连续流启动后期将盘片线速度提高至15m/ min后,生物膜表面丝状菌减少,且属于HN-AD功能的优势菌属的相对丰度明显增多,污染物去除率也随之上升.
同时从空间层面上对连续流启动中期盘片沿程的生物膜样品进行微生物群落结构分析,结果表明,盘片前端和中端的HN-AD功能优势菌属的相对丰度及种类相似,而盘片后端某些种类的HN-AD功能优势菌属并不存在或相对丰度明显劣于盘片前端和中端,但菌仅在盘片后端出现.综合对比连续流启动阶段群落变化可见,在连续流启动过程中,生物群落结构及生物多样性呈现启动时间及盘片沿程空间变化,并在生物转盘反应器中实现了HN-AD功能菌属的优势化构建,这同时也验证了在连续流启动过程中的不同阶段,其污染物去除效果均呈现不同程度的改善.

图5 连续流启动阶段系统微生物群落结构时空变化
2.6 HN-AD菌挂膜启动完成前后的SEM表征

(a)原始盘片 (b)HN-AD菌剂挂膜启动完成后
如图6所示,在盘片接种HN-AD菌前(图6a),可观察到生物盘片表面呈规则排列的凸起状条纹,这种特殊的盘片材质及结构有利于生物膜的稳定附着;由HN-AD菌挂膜启动完成后的SEM照片可见,在HN-AD菌接种挂膜完成后,可形成比表面积较大的生物膜层,其生物膜以丝状菌为骨架,具有异养硝化-好氧反硝化功能的菌属以杆状和球状为主固定在盘片的表面.结合图5可推断,盘片表面的杆状菌和球状菌为序批式挂膜启动成功后的优势菌,分别为丛毛单胞菌属()、嗜氢菌属()和菌属.
3 结论
3.1 采用HN-AD菌对生物转盘反应器进行序批式挂膜启动,启动周期(15d)明显低于活性污泥挂膜法(33d).
3.2 盘片线速度是控制丝状菌产生的关键因素.为了保证处理效果同时能有效抑制丝状菌的生长,线速度应保持在7.5~15m/min范围内.
3.3 高通量测序结果表明,生物转盘反应器有利于功能微生物的富集与优势化构建.SEM观察结果也进一步证实,反应器启动完成后,盘片上的优势菌主要以杆状和球状的HN-AD菌为主.
3.4 真实养猪废水原水经预处理工艺后,污染物浓度削减效果明显.原水中COD、NH4+-N和TN的平均浓度从7773.1,687.9和790.3mg/L分别降低至2346.4,82.6和162.4mg/L,出水水质完全满足后续处理工艺的设计要求.
[1] 王 亮,陈重军,陈英旭,等.规模化猪场养殖废水UASB-SFSBR- MAP处理工艺中试研究[J]. 环境科学, 2013,34(3):979-985. Wang L, Chen C J, Chen Y X, et al. Effect of pilot UASB-SFSBR- MAP process for the large scale swine wastewater treatment [J]. Environmental Science, 2013,34(3):979-985.
[2] 赵 丽,王毅力.AMBR-MABR耦合工艺处理模拟畜禽养殖废水的启动和运行[J]. 环境工程学报, 2017,11(11):5799-5809. Zhao L, Wang Y L. Start-up and operation of anaerobic migrating blanket reactor-membrane biofilm bioreactor (AMBR-MABR) coupling process treating synthetic livestock wastewater [J]. Chinese Journal of Environmental Engineering, 2017,11(11):5799-5809.
[3] Meng J, Li J, Li J, et al. Enhanced nitrogen removal from piggery wastewater with high NH4+and low COD/TN ratio in a novel upflow microaerobic biofilm reactor [J]. Bioresource Technology, 2018,249: 935-942.
[4] Zhao B W, Li J Z, Leu S Y. An innovative wood-chip-framework soil infiltrator for treating anaerobic digested swine wastewater and analysis of the microbial community [J]. Bioresource Technology, 2014,173:384-391.
[5] 聂丽君,李德豪,何京东,等.ABR-MAP-MBR组合工艺处理高浓度养殖废水研究[J]. 化工学报, 2018,69(6):2722-2729. Nie L J, Li D H, He J D, et al. Treatment of high concentration piggery wastewater by ABR-MAP-MBR process [J]. CIESC Journal, 2018, 69(6):2722-2729.
[6] 魏启航,王小龙,李龙伟,等.电絮凝-半短程硝化-厌氧氨氧化组合工艺处理裂化催化剂废水[J]. 化工学报, 2015,66(11):4669-4675. Wei Q H, Wang X L, Li L W, et al. Treatment of cracking catalyst wastewater with electrocoagulation-partial nitritation-Anammox process [J]. CIESC Journal, 2015,66(11):4669-4675.
[7] Wang J L, Chen G F, Liu F X, et al. Combined ozonation and aquatic macrophyte (Vallisnerianatans) treatment of piggery effluent: Water matrix and antioxidant responses [J]. Ecological Engineering, 2017, 102:39-45.
[8] Meng J, Li J L, Li J Z, et al. Efficiency and bacterial populations related to pollutant removal in an upflow microaerobic sludge reactor treating manure-free piggery wastewater with low COD/TN ratio [J]. Bioresource Technology, 2016,201:166.
[9] 万金保,付 煜,余郭龙.改良UASB—两级A/O—混凝工艺处理猪场沼液[J]. 工业水处理, 2017,37(12):94-97. Wan J B, Fu Y, Yu G L. Improved UASB-two stage A/O-coagulation process for the treatment of hogpen biogas slurry [J]. Industrial Water Treatment, 2017,37(12):94-97.
[10] 林 丽,念海明,杨建华,等.TDS三维结构生物转盘技术在乡镇生活污水处理中的调试运行优势[J]. 自动化与仪器仪表, 2016,(5): 221-222+225. Lin L, Nian H M, Yang J H, et al. Advantages of TDS three- dimensional structure of rotating biological contactor technology in debugging operation in township sewage treatment [J]. Automation and Instrumentation, 2016,(5):221-222+225.
[11] 徐官安.三维结构生物转盘处理生活污水的试验研究[D]. 重庆:重庆大学, 2015. Xu G A. Treatment of domestic wastewater by ESROTAE [D]. Chong Qing: ChongQing University, 2015.
[12] 《水和废水监测分析方法》编委会.水和废水监测分析方法[M]. 北京:中国环境科学出版社, 1989. Editorial Board of Water and Wastewater Monitoring and Analysis Methods. Water and wastewater monitoring and analysis methods [M]. Beijing: China Environmental Science Press, 1989.
[13] 符 波,廖潇逸,丁丽丽,等.环境扫描电镜对废水生物样品形态结构的表征研究[J]. 中国环境科学, 2010,30(1):93-98. Fu B, Liao X Y, Ding L L, et al. Application of ESEM in the visualization of microbial community of granule sludge and suspended carrier biofilm [J]. China Environmental Science, 2010,30(1):93-98.
[14] 芮俊鹏,李吉进,李家宝,等.猪粪原料沼气工程系统中的原核微生物群落结构[J]. 化工学报, 2014,65(5):1868-1875. Rui J P, Li J J, Li J B, et al. Prokaryotic community structures in biogas plants with swine manure [J]. CIESC Journal, 2014,65(5): 1868-1875.
[15] 艾 铄,赵天涛,张丽杰,等.双塞头固定化细胞反应器降解TCE [J]. 应用与环境生物学报, 2017,23(5):900-906. Ai S, Zhao T T, Zhang L J, et al. TCE biodegradation in reactor with two openings with immobilized cells [J]. Chinese Journal of Applied and Environmental Biology, 2017,23(5):900-906.
[16] 赵天涛,邢志林,张丽杰,等.氯代烯烃胁迫下菌群SWA1的降解活性及群落结构[J]. 中国环境科学, 2017,37(12):4637-4648. Zhao T T, Xing Z L, Zhang L J, et al. Biodegrading activity and community structure of microbial consortium SWA1 acclimatized on chloroalkene [J]. China Environmental Science, 2017,37(12):4637- 4648.
[17] 孙艺齐,卞 伟,王 盟,等.活性污泥法和生物膜法SBR工艺亚硝化启动和稳定运行性能对比[J]. 环境科学, 2017,38(12):5222-5228. Sun Y Q, Bian W, Wang M, et al. Comparison of start-up and stable performance of nitritation in activated sludge and biofilm processes in a SBR [J]. Environmental Science, 2017,38(12):5222-5228.
[18] 赵海燕.序批式反应器同步硝化反硝化处理生活污水试验研究[D]. 西安:长安大学, 2009. Zhao H Y. Study on Domestic wastewater treatment by simultaneous nitrification-denitrification in SBR reactors [D]. Xi An:Chang’An University, 2009.
[19] 李治阳.畜禽废水生物除碳脱氮耦合新工艺及机理研究[D]. 重庆:重庆大学, 2012. Li Z Y. Study on new coupling technology in biological removal of nitrogen and carbon from livestock wastewater and its mechanism [D]. Chong Qing:ChongQing University, 2012.
[20] 王顺成,刘幽燕,李青云,等.产碱杆菌DN25的氰降解代谢途径分析与产酶条件优化[J]. 化工学报, 2011,62(2):482-489. Wang S C, Liu Y Y, Li Q Y, et al. Analysis of cyanide-degrading metabolism and optimization of culture condition for cyanide- degrading enzyme production fromsp. DN25 [J]. CIESC Journal, 2011,62(2):482-489.
[21] 李 冬,何永平,张肖静,等.MBR系统CANON工艺的快速启动及微生物种群特征[J]. 中国环境科学, 2014,34(11):2788-2795. Li D, He Y P, Zhang X J, et al. The fast start-up of CANON process in MBR system and the characterization of microbes [J]. China Environmental Science, 2014,34(11):2788-2795.
[22] Huang X F, Li W G, Zhang D Y, et al. Ammonium removal by a novel oligotrophicsp. Y16 capable of heterotrophic nitrification-aerobic denitrification at low temperature [J]. Bioresource Technology, 2013,146(10):44-50.
[23] 辛玉峰,曲晓华,袁梦冬,等.一株异养硝化-反硝化不动杆菌的分离鉴定及脱氮活性[J]. 微生物学报, 2011,51(12):1646-1654. Xin Y F, Qu X H, Yuan M D, et al. Isolation and identification of a heterotrophic nitrifying and aerobic denitrifyingsp. YF14 and its denitrification activity [J]. Acta Microbiologica Sinica, 2011,51(12):1646-1654.
[24] 王书永,钱飞跃,王建芳,等.有机物对亚硝化颗粒污泥中功能菌活性的影响[J]. 环境科学, 2017,38(1):269-275. Wang S Y, Qian F Y, Wang J F, et al. Impact of biodegradable organic matter on the functional microbe activities in partial nitrification granules [J]. Environmental Science, 2017,38(1):269-275.
[25] Cai H, He W, Yanan W, et al.sp. nov., an orange-pigmented bacterium isolated from cyanobacterial aggregates in a eutrophic lake [J]. International Journal of Systematic and Evolutionary Microbiology, 2018,68(10):1839–1844.
[26] Guo Y, Zhou X, Li Y, et al. Heterotrophic nitrification and aerobic denitrification by a novel[J]. Biotechnology Letters, 2013,35(12):2045-2049.
[27] 孙雪梅,李秋芬,张 艳,等.一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性[J]. 微生物学报, 2012,52(6):687-695. Sun X M, Li Q F, Zhang Y, et al. Phylogenetic analysis and nitrogen removal characteristics of a heterotrophic nitrifying-aerobic denitrifying bacteria strain from marine environment [J]. Acta Microbiologica Sinica, 2012,52(6):687-695.
[28] 肖继波,江惠霞,褚淑祎.不同氮源下好氧反硝化菌str.DN7的脱氮特性[J]. 生态学报, 2012,32(20):6463-6470. Xiao J B, Jiang H X, Chu S W. Denitrification characteristics of an aerobic denitrifying bacteriumstr. DN7 using different sources of nitrogen [J]. Acta Ecologica Sinica, 2012,32(20): 6463-6470.
[29] 许 涛,王国英,岳秀萍sp.PDB3菌好氧反硝化脱氮特性 [J]. 中国环境科学, 2018,38(6):2321-2328. Xu T, Wang G Y, Yue X P, et al. The nitrogen removal characteristics of aerobic denitrification bysp. PDB3. [J]. China Environmental Science, 2018,38(6):2321-2328.
[30] 王国英,崔 杰,岳秀萍,等.异养硝化-好氧反硝化菌脱氮同时降解苯酚特性[J]. 中国环境科学, 2015,35(9):2644-2649. Wang G Y, Cui J, Yue X P, et al. Simultaneous removal of phenol and ammonium by a heterotrophic nitrifiying-aerobic denitrifying bacterium [J]. China Environmental Science, 2015,35(9):2644-2649.
Study on treatment of raw swine wastewater by enhanced 3D-RBC with HN-AD bacteria and its microbial characteristics.
LIU Xiang-yang1, ZHANG Qian1*, WU Heng1, CHEN Wang1, SHENG Xiao-hong1, NIAN Hai-ming2, XIAO Peng-ying1, ZHAO Tian-tao1
(1.Chongqing University of Technology School of Chemistry and Chemical Engineering, Chongqing 40054, China;2.Chongqing Chuanyi Environmental Technology Co., Ltd, Chongqing 401121, China)., 2019,39(9):3848~3856
Aiming at the problems of high ammonia nitrogen bio-toxicity, complex process, high cost and poor nitrogen removal in the currently available process for the treatment of raw swine wastewater from intensive livestock farms, a three-dimensional structure rotating biological contactor (3D-RBC) using heterotrophic nitrification-aerobic denitrification (HN-AD) functional bacteria as the microbial inoculants, was proposed for the treatment of raw swine wastewater. The rapid biofilm culturing in the 3D-RBC reactor was achieved in only 15days by using HN-AD bacteria agent as the microbial inoculants. By controlling linear velocity of the rotating disc and changing the influent C/N, the enrichment of the dominant HN-AD bacteria in the reactor and the start-up of the pretreatment process were completed in 65days. The raw swine wastewater was then treated by this process. Due to the strong tolerance of high ammonia nitrogen of the HN-AD bacteria, the removal efficiency of COD, NH4+-N and TN was 69.8%, 87.9% and 79.5%, respectively, indicating significant reduction of the pollutants in the raw wastewater. The high-throughput sequencing technology was used to study the changes of microbial community structure during the superiority construction process of the functional bacteria. The results showed that, the dominant HN-AD bacteria within the biofilm gradually changed fromandtoand, and the relative abundance of which increases obviously. The SEM results further confirmed the enrichment of functional microorganisms, the biofilm uses Filamentous bacteria as the skeleton and the surface of the biofilm layer tightly attached to the filler was enriched in rod-like and globular bacteria, which was in consistent with the results of the biodiversity analysis.
raw swine wastewater;3D-RBC pretreatment process; HN-AD agent;microbial community structure
X703.1
A
1000-6923(2019)09-3848-09
刘向阳(1994-),男,重庆丰都人,重庆理工大学硕士研究生,主要从事生物膜反应器脱氮工艺研究.发表论文3篇.
2019-02-10
国家自然科学基金项目(51708077);重庆市社会事业与民生保障科技创新专项(cstc2018jscx-msybX0134);重庆市技术创新与应用示范(资助项目)(cstc2018jscx-mszd0600)
* 责任作者, 博士, zhangqianswu2005@163.com

