环境中全氟辛基磺酸前体物好氧生物降解进展
周绍宏,王淦淦,张利兰
环境中全氟辛基磺酸前体物好氧生物降解进展
周绍宏,王淦淦,张利兰*
(重庆大学煤矿灾害动力学与控制国家重点实验室,重庆 400044)
目前,在土壤、大气、水体等各种环境介质中均检测到了全氟辛基磺酸(PFOS)及其前体物(PrePFOS)的存在.自然条件下,PrePFOS的非生物降解量可以忽略不计,其生物降解的途径和降解量是预测未来PFOS环境行为的基础.本文对PrePFOS在环境介质中的分布以及生物降解进行了综述.在所有的PrePFOS中,关于N-乙基全氟辛基磺酰胺乙醇(EtFOSE)的研究较深入,其在土壤、活性污泥、沉积物中的降解途径及PFOS产量均有报道,EtFOSE的降解速度及其PFOS产量与介质的理化性质、微生物群落结构密切相关,N-乙基全氟辛基磺酰胺乙酸(EtFOSAA)脱羧转化为N-乙基全氟辛基磺酰胺(EtFOSA)是EtFOSE转化为PFOS的主要限速步骤.最新关于EtFOSE在土壤中的好氧生物降解的研究首次提出全氟辛基磺酰胺乙酸(FOSAA)脱羧形成全氟辛基磺酰胺(FOSA)是EtFOSE转化成PFOS的另外一个可能的限速步骤.全氟辛基磷酸酯(DiSAmPAP)在沉积物中的半衰期>380d,其可能的降解途径是先降解为EtFOSE,之后降解为PFOS.最后,在已有研究基础上,提出目前PrePFOS研究存在的问题及今后的研究方向.
全氟辛烷磺酸前体物;分布特征;好氧生物降解;土壤;活性污泥;沉积物
PFOS是一种由疏水性全氟烷基链和亲水的尾部官能团构成的表面活性剂,广泛应用于地毯、鞋材、纸张、消防泡沫、影印涂料、地板打磨等工业和民用领域[1].由于氟是电负性最强的元素(-4.0), PFOS具有很强的稳定性,在环境中持久存在,沿食物链累积放大.毒理学研究证实PFOS对人和动物具有肝脏、胚胎发育、生殖和神经等多种毒性[1-2].2009年5月,PFOS及其盐类作为新的持久性有机污染物被列入《关于持久性有机污染物的斯德哥尔摩公约》,除镀铬等特殊行业,大部分国家开始限制此类物质生产使用.然而,环境中PFOS的污染状况并未因此得到显著改善,尤其是在中国、古巴等发展中国家[3],环境中PFOS依然维持较高的浓度水平.环境中的PFOS除了直接生产来源外,PFOS前体物(PrePFOS)的降解转化是其主要来源[3-5],其降解产生PFOS需引起重视.
目前,国内外制定的相关法律政策主要用于规范有机氟化物的使用,未发现专门针对PrePFOS的规范要求.自美国颁布毒性物质控制法案(Toxic Substances Control Act)规定183项PFOS及相关化学物质的使用规则后,加拿大和欧洲分别修订/发布了《加拿大环境保护法案,1999》和《关于限制全氟辛烷磺酸销售及使用的指令》(2006/122/EC)规定PFOS或含PFOS的产品的生产、使用、销售和进口.2000年起3M公司逐渐停止生产PFOS.2017年,我国发布了《中国严格限制的有毒化学品名录》,将PFOS及其盐类和全氟辛基磺酰氟列为管控化学品,全面限制此类物质的生产使用.
本文结合国内外文献,结合典型PrePFOS理化性质及其污染现状,对其在不同环境介质中的污染特征以及好氧生物转化为PFOS的机制进行综述,并提出PrePFOS的研究需求.
1 典型PrePFOS
PrePFOS是指一类在环境或生物体内能转化成PFOS、氮烷基取代的全氟辛基磺酸胺类物质(化学通式为C8F17SO2NRR¢),是以辛基磺酰氟为原料,利用电化学氟化法合成,如以辛基磺酰氟为原料合成支链和直链全氟辛基磺酰氟(POSF).POSF水解可直接产生PFOS和及其盐类物质,而与甲基胺或乙基胺反应可产生烃基磺胺类物质如N-甲基全氟辛基磺酰胺(MeFOSA)和EtFOSA.这些磺酰胺类物质可与碳酸亚乙酯合成磺酰胺醇类物质如N-甲基全氟辛基磺酰胺乙醇(MeFOSE)和EtFOSE,此两种物质被用来合成氟化乙酸类物质,如EtFOSAA;或合成磷酸酯类物质,如DiSAmPAP. PrePFOS一般在环境中呈中性,水溶性低,挥发性适中.几种环境中常见的PrePFOS的理化性质和化学结构见表1.
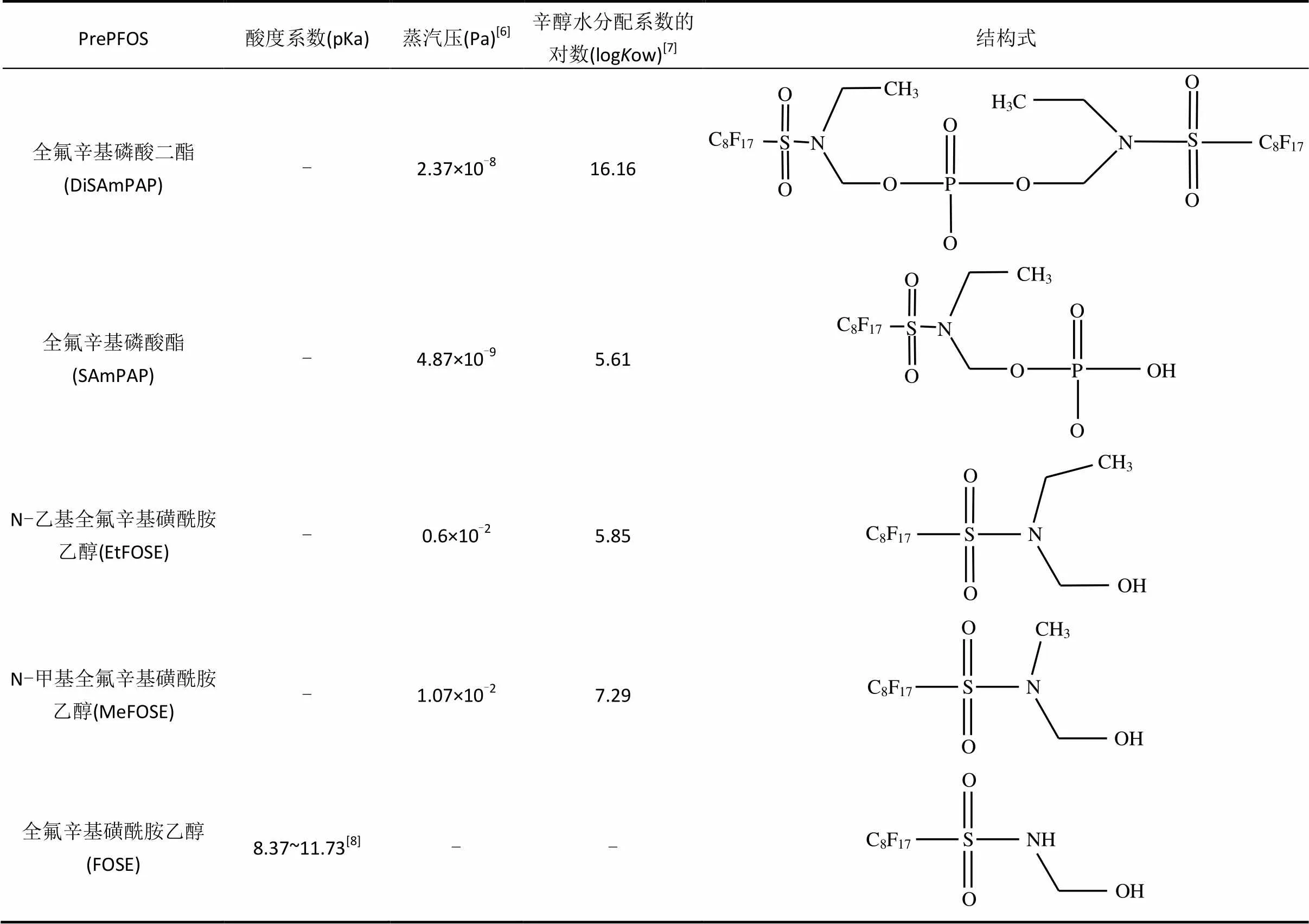
表1 典型PrePFOS的理化性质及结构式
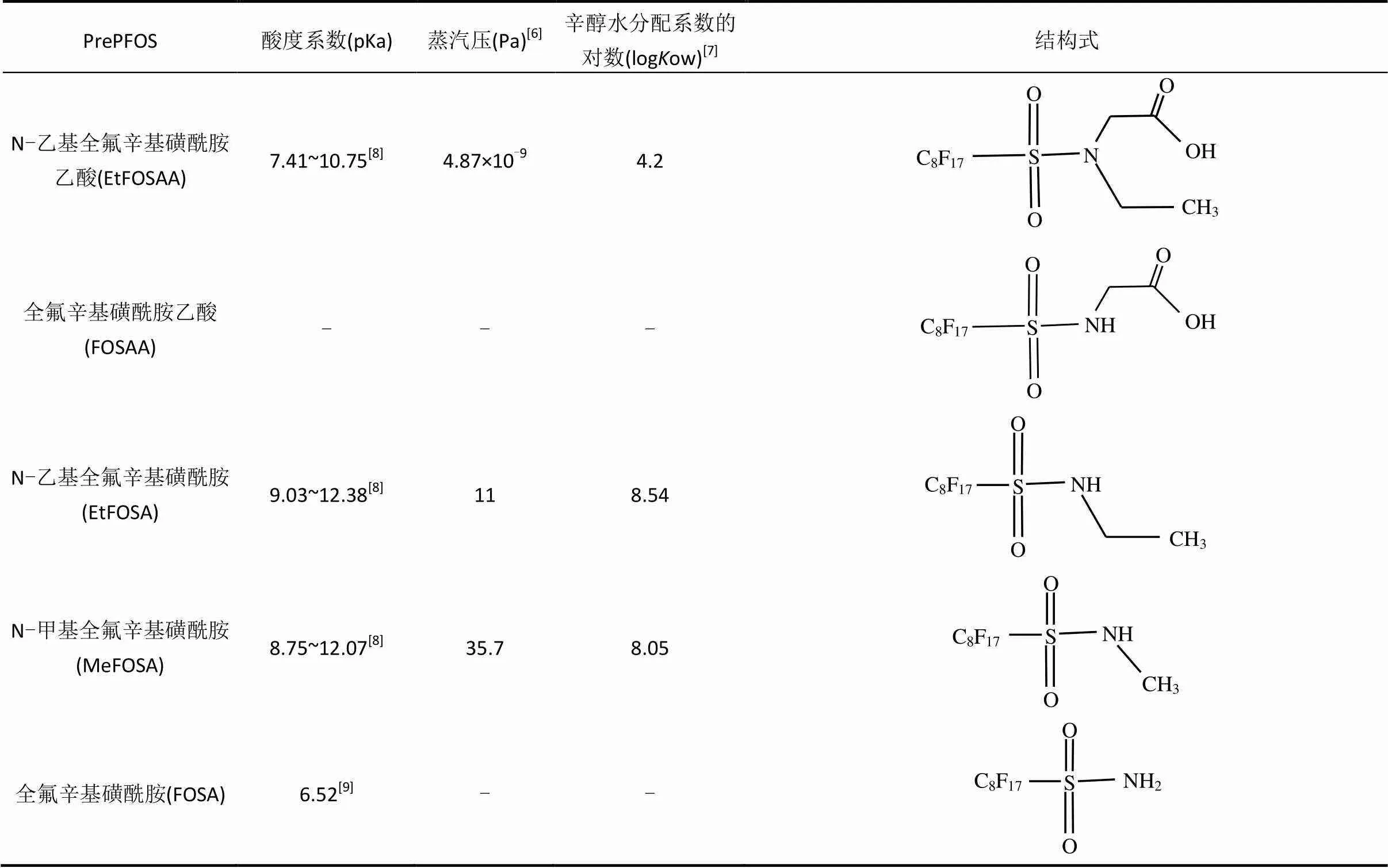
续表1
从1967年开始,EtFOSE被大量用于表面活性剂和杀灭蟑螂或蚂蚁的杀虫剂.目前,EtFOSE、EtFOSA、SAmPAP、DiSAmPAP等仍在中国、巴西、阿根廷等国家生产使用.巴西在2004~2015年期间生产FOSA和PFOS的总量为167~487t[10],中国在2001~ 2011年期间生产PFOS和PrePFOS的总量约1.8× 103t[11].据估计,仅在1970~2002年期间,PFOS和PrePFOS全球总生产量高达9.6×104~1.2×105t.其中,释放到空气和水中PFOS和PrePFOS的总量约为4.5×104t,PrePFOS的环境释放量要比PFOS高1~2个数量级[7,12].因此,PrePFOS是环境中PFOS的一个巨量的潜在来源.
2 PrePFOS在环境介质中的污染现状
在生产和使用过程中,PrePFOS通过多种途径进入水、土壤、大气等环境介质中.PrePFOS可随废水排入污水处理厂,或随固体介质进入垃圾填埋厂.污水处理厂中的非离子型PrePFOS或挥发至大气层,或随出水进入自然水体,吸附在活性污泥中的PrePFOS可作为生物固体施肥到土壤中,或进入垃圾填埋厂,渗透进入土壤或地下水.大气中的PrePFOS可随气流完成长距离迁移,或经沉降作用回到地表,进入河流或渗入土壤.河流中的PrePFOS汇流进入海洋环境,或通过饮水或表面接触进入水生动物体内,或被沉积物吸附[13].土壤中的PrePFOS随表面径流或雨水冲刷进入到河流,或转移至植物体内,或渗透至地下水.当地下水被用于灌溉或饮用时,随之进入土壤、植物、动物及人体内.除此以外, PrePFOS还可以通过呼吸和饮食等生命活动进入人体内.
2.1 水体和底泥中PrePFOS污染现状
水体为污染物的主要容纳体,PrePFOS在其中广泛存在.工业区附近的水体中PrePFOS的浓度通常很高,美国一家灭火器工厂附近的地下水体中[14], FOSA浓度高达6.57mg/L.PrePFOS在自然水体中的浓度较低.Ahrens等[13]发现大西洋中,FOSA的浓度(302pg/L)大于PFOS 的浓度(291pg /L).Busch等[15]在东格陵兰岛附近海水中亦发现FOSA的浓度高于PFOS,这主要源于FOSA挥发、迁移、沉降至该地区.在日本东京湾水体中检测到的PrePFOS包括FOSA和N-EtFOSAA,总量为16.7~42.3ng/L[16].太湖水样中FOSA的平均检测浓度为15ng/L[17].
PrePFOS在水体中的广泛分布性且较大底泥/水分配系数[18],使其不可避免的迁移到底泥中.日本东京湾表层底泥[16]检测到包括EtFOSAA、FOSA等多种PrePFOS,其浓度总量为0.29~0.36ng/g.2012年,DiSAmPAP在海水底泥中首次检出[19],浓度范围为32~200pg/g,可被降解为各种PrePFOS,解释了为何近年来底泥中DiSAmPAP潜在中间产物EtFOSAA的浓度大于或接近于PFOS的浓度(0.246ng/g)[16,20].
2.2 土壤和大气中PrePFOS的污染现状
在早期关于土壤中异源性有机污染物分析中,多只关注PFOS,未将PrePFOS列入检测清单[21].近些年来,EtFOSAA、FOSAA、FOSA等PrePFOS引起关注并在土壤中被频繁检出[22].由于低水溶性以及较高的有机质吸附性,PrePFOS常吸附在活性污泥上,随之排放到表层土壤中[20,23-24].有研究发现施用生物固体肥料超过10年的土壤中PFOS和PrePFOS的总浓度高达5µg/g[24].
PrePFOS的pKa一般高于环境pH值而以中性分子形态存在,水溶性较弱且挥发性适中(如表1所示),易从其它环境介质中挥发至大气,许多工业或非工业区空气均检测到了高浓度的PrePFOS[6,25-26].大气中PrePFOS的长距离迁移被认为是PFOS全球性分布的主要元凶之一[3,27].在德国某海滨村庄上方空气中[32],FOSA和MeFOSE浓度范围分别为0.5~13和0.1~4.1pg/m3.北极上方空气中[30],MeFOSE和EtFOSE的浓度范围分别为2.6~3.1和1.0~8.9pg/m3.
3 环境介质中PrePFOS的好氧生物降解
氯化作用、臭氧化作用或活性炭吸附与活性污泥联用法等常规污水处理技术都难以有效降解PrePFOS.因此,某些污水处理厂出水口PFOS的浓度大于进水口的浓度[29]主要是因为PrePFOS的生物降解导致了PFOS浓度的上升.目前,关于PrePFOS的生物降解的研究非常有限(已有研究如表2所示),很多科学问题还存在争议,但是PrePFOS通过生物过程可以降解为PFOS已成为共识.PrePFOS的生物降解主要涉及非氟化官能团的降解,非生物作用如水解、直接光解和间接光解对PrePFOS降解为PFOS影响较小[30],可以忽略不计.
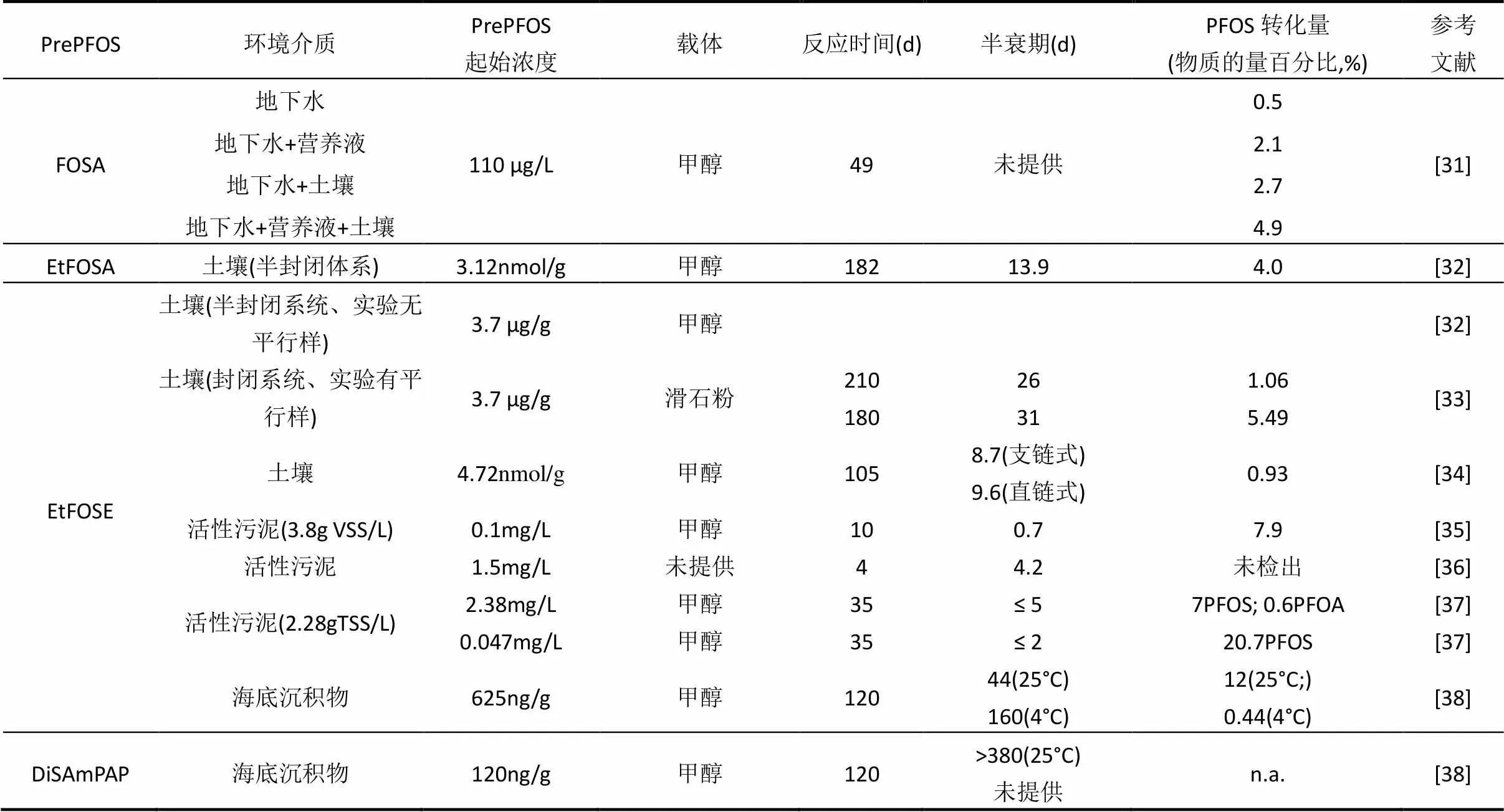
表2 环境介质中PrePFOS好氧生物转化的研究进展
3.1 FOSA的生物降解
FOSA是较高分子量PreFOS降解为PFOS主要中间产物之一.Murakami等[39]首次研究了土壤渗滤液中FOSA的生物降解,证实了少部分FOSA可以被生物降解为PFOS.并进一步证实在水体中FOSA同样可以被微生物降解为PFOS,添加营养物质和土壤会加快PFOS的产生速度.不同水体中负载同样浓度FOSA的降解实验发现,在表面径流水和地下水中检测到了PFOS,而在污水处理厂出水和雨水中未检测出,这可能是由于后2种介质中含有固体颗粒,对FOSA有强吸附性,因而阻碍了水体微生物降解FOSA.研究表明FOSA也可以在生物体内降解. Chen等[40]发现在鲤鱼体内,FOSA的支链异构体比相应的线性异构体更快地被消除.Zhao等[41]发现FOSA在大豆和南瓜体内可被依次降解为PFOS、全氟己基磺酸(PFHxS)和全氟丁基磺酸(PFBS).
3.2 EtFOSA的生物降解
Avendaño等[32]采用半封闭的体系研究了182d内EtFOSA在土壤中的好氧生物降解,发现EtFOSA在土壤中的半衰期为(13.9±2.1)d,PFOS的生产量是4.0%(物质的量百分比),证实了EtFOSA通过烷基氧化产生FOSAA途径的存在;FOSA和FOSAA是EtFOSA2个主要的降解产物,且这2种PrePFOS在土壤中半衰期很长,这也解释了很多环境介质中FOSAA和FOSA的浓度高于PFOS的现象[42-43].
3.3 EtFOSE的生物降解
EtFOSE是电氟化反应的重要产物,也是合成下游产物如磷酸酯的重要原料,关于它在环境介质中生物降解的研究较为深入.目前关于EtFOSE 的好氧生物降解途径如图1所示,图中:单实线指示 EtFOSE 在半封闭土壤体系中好氧生物降解途径[40];虚线为 EtFOSE 在日本青鳉鱼体内降解途径[48];双实线为本课题组首次提出的另外一种降解途径[41].(1)单实线路径:EtFOSE通过氧化转化为EtFOSAA,随后经过脱羧反应生成EtFOSA,接着EtFOSA直接脱去烷基转化为FOSA,或先通过烷基氧化为FOSAA,再经脱羧作用转化为FOSA,最后经脱氨转化为最终产物PFOS.(2)单虚线路径:部分EtFOSE直接脱醇转化为EtFOSA,一部分则通过氧化先转化为EtFOSAA,之后再脱羧转化为EtFOSA,还有一部分EtFOSE先通过脱烷基反应生成FOSE; EtFOSA随后再脱烷基生成FOSA,部分FOSE直接脱醇转化为FOSA,其余FOSE经过氧化转化为FOSAA,再脱羧转化成FOSA;FOSA最后脱氨转化为PFOS.(3)双实线路径:EtFOSE直接脱磺酰胺一步生成PFOS.
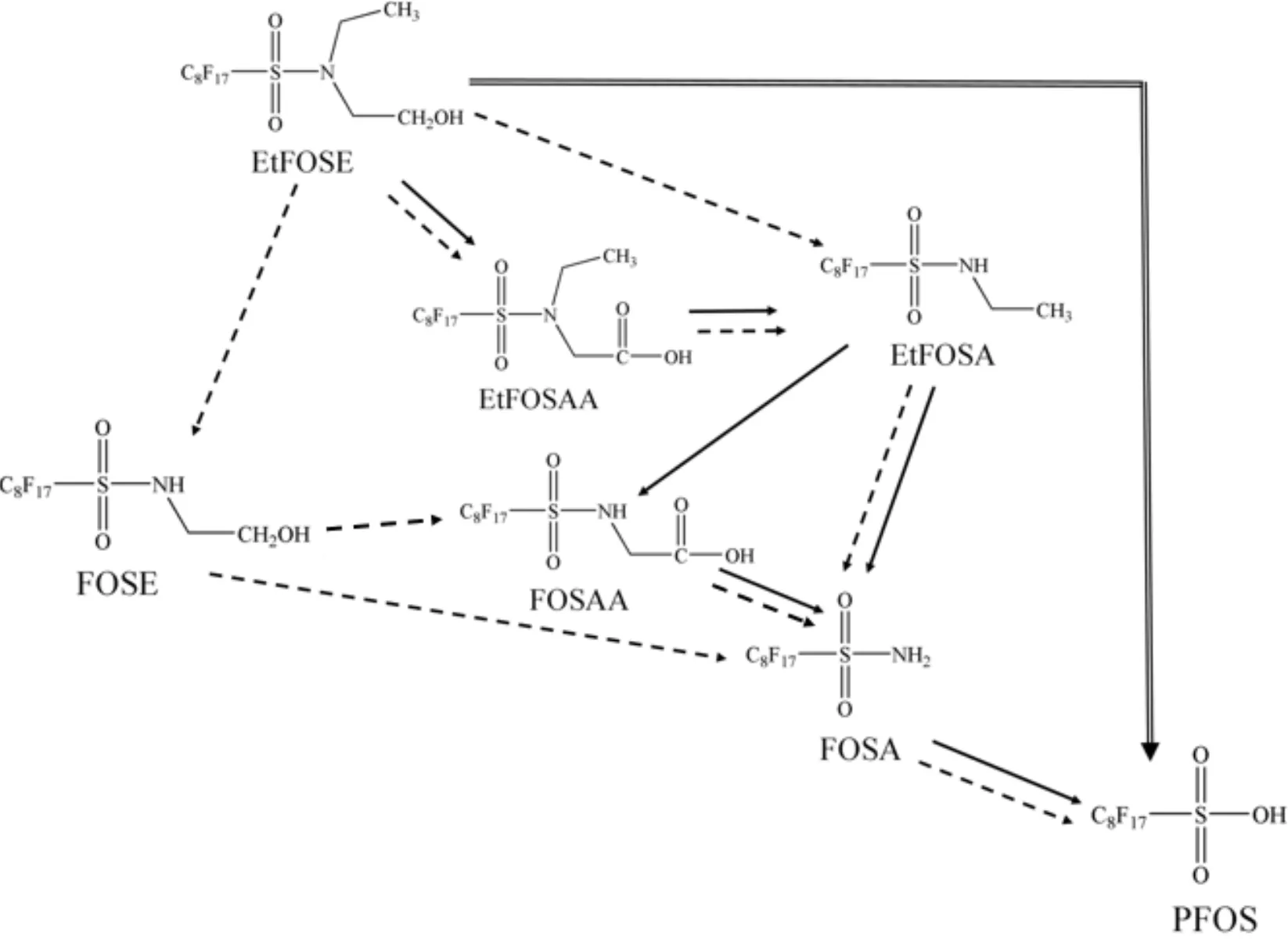
图1 EtFOSE主要的好氧生物降解途径
Lange[37]发现在活性污泥中,两种浓度的EtFOSE均通过图1单实线中五步反应路径逐步转化为PFOS.相比之下,低浓度EtFOSE的生物转化速率和转化成PFOS的量分别是高浓度的2倍和 3 倍.Boulanger 等[45]发现,在好氧活性污泥中EtFOSE仅通过虚线反应路径两步就转化为PFOS的直接前体物FOSA,可能由于反应时间较短(96h),未检测到终产物PFOS;在厌氧条件下,EtFOSE不能被生物降解. Rhoads等[35]发现,在好氧活性污泥中,EtFOSE的中间产物EtFOSA既可以经过烷基氧化成FOSAA,之后脱羧形成FOSA,也可以直接脱烷基变成FOSA,表明EtFOSE可经过单实线路径转化为PFOS.在沉积物中,EtFOSE通过单实线反应转化为PFOS,未发现EtFOSA直接脱烷基转化成FOSA途径的存在[38].尽管Lange[37]在研究EtFOSE的活性污泥降解时,中间产物中检测到了PFOA,他提出可能是PFOSI经非生物的单电子转移机制降解成PFOA,然而,后面所有研究中均未发现FSOA.推测FOSA的检出可能来自母体物的不纯或背景值.
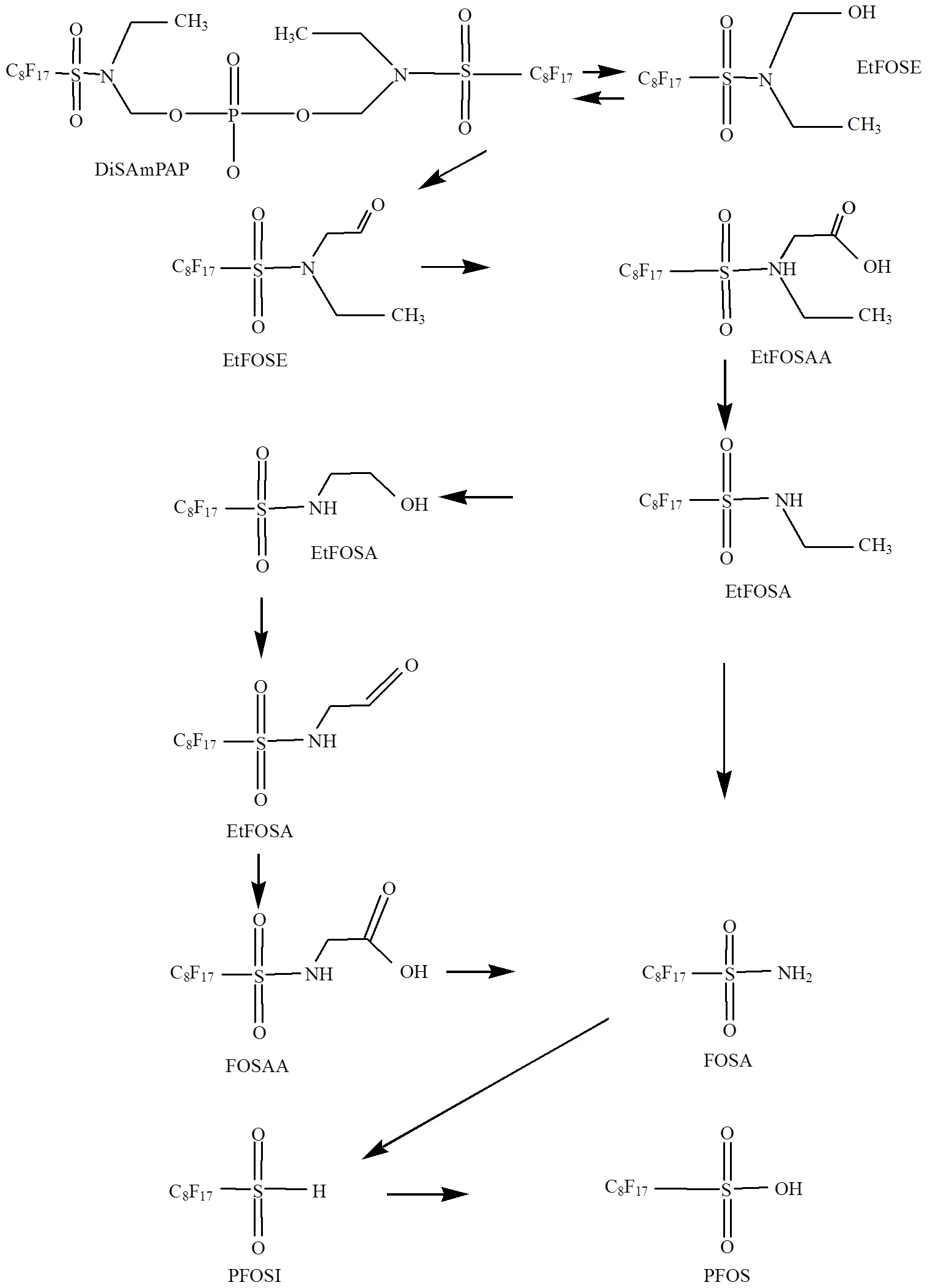
图2 DiSAmPAP在环境介质中可能的降解途径
Avendaño等[32]在半封闭体系中考察了EtFOSE在加拿大某未开垦土壤中的好氧生物转化行为并分析计算了单实线路径中各物质的半衰期和反应速率.本课题组在其研究基础上,在封闭体系中,进一步探究了EtFOSE在不同性质土壤中的降解速率和降解途径,首次利用KinGUII模型分析了EtFOSE及其代谢产物的降解速率[35].结果发现:在弱碱性土壤(pH=7.8)中,EtFOSE、EtFOSAA、EtFOSA、FOSAA、FOSA的半衰期分别约为30d,300~400d,20~25d, 100d,35~50d;在酸性土壤(pH=5.5)中,EtFOSAA、EtFOSA、FOSAA、FOSA的半衰期分别约为25d, 300d,25d, 245~334d,40d.其中FOSAA和EtFOSAA为半衰期最长的2种代谢产物,故EtFOSAA和FOSAA的形成是EtFOSE转化为PFOS的主要限速步骤.此外本课题还利用KinGUII模型分析了Avendaño等的实验数据,发现单实线途径不能得到很好的总体拟合度,基于EWAGA数据库,首次提出EtFOSE直接降解为PFOS这一新路径,数据得到了良好的总体拟合度[33].
本课题组封闭体系所用2种土壤的主要差别为pH值的不同(5.5和7.8),而且实验结果表明EtFOSE在2种土壤中降解、产物半衰期、反应速率以及PFOS产率(1.06%和5.49%)存在显著差异,EtFOSA、FOSAA、FOSA都具有可电离的基团(如羟基、氨基、羧基),在不同的pH值环境中,各物质的好氧生物降解行为会发生不同程度的改变.另外,各物质的同分异构体之间pKa也存在差异,EtFOSE和其降解过程中的产物如EtFOSE中直链式占总的60%~70%,直链式EtFOSE在环境pH值范围内呈中性,pKa低于支链式.直链式EtFOSA和FOSA在酸性土壤(pH=5.4)中分别呈中性和约10%带负电荷,在碱性土壤(pH=7.4和7.8)中分为5%~50%和50%~90%带负电荷.Liu等[36]研究了105d内EtFOSE同分异构体在土壤中的好氧生物降解行为,发现直链式EtFOSE和支链式EtFOSE的半衰期分别为9.6d和8.7d,无统计差异;中间产物EtFOSAA和FOSA的支链式均表现出生物降解的优势,EtFOSA相反,直链式和支链式半衰期分别为80.8d和11.2d.此外,土壤的微生物群落结构也会对其降解机制产生影响,目前关于微生物群落结构差异对PrePFOS降解具体影响机制研究还未见报道.
3.4 全氟磷酸二酯(DiSAmPAP)的生物降解
DiSAmPAP是商业品FC-807的主要成分, 2002年以前被大量用于食品包装,由于分析技术等原因,在2012年才在底泥中首次检出[20],同时在底泥中检测到了不同浓度的EtFOSAA、MeFOSAA、FOSA、FOSAA和PFOS,相关性分析显示EtFOSAA和MeFOSAA与DiSAmPAP浓度相关,表明EtFOSAA和MeFOSAA可能是其降解中间产物,之后进一步降解为PFOS,可能的降解途径如图2所示.进一步的底泥微生物降解DiSAmPAP的实验发现,在4或20℃培养条件下,DiSAmPAP在沉积物中均未被生物降解,在底泥中的半衰期> 350d[38].氟化物的吸附性随着碳链的增加而增大,DiSAmPAP大分子结构(分子量:1203)、低水溶性[20]、以及底泥中较低的微生物活性,共同导致DiSAmPAP极低的生物降解速率.
4 结语
4.1 PrePFOS是环境中PFOS的一个巨大潜在来源,全球范围内均有检出.工业区附近水体中PrePFOS,浓度尤高,FOSA检出频率最高. 土壤中PrePFOS主要来自于活性污泥的土地利用或堆放以及雨、雪等沉降作用.
4.2 目前关于PrePFOS在环境中的好氧生物降解的研究多侧重于土壤、活性污泥和海底沉积物. 同种PrePFOS在不同环境介质中的降解行为存在较大差异.
4.3 土壤中EtFOSE和EtFOSA均被证实可降解为PFOS,但降解机制受土壤理化性质显著影响.
4.4 展望:目前关于PrePFOS生物降解多集中于研究pH值、有机质等非生物因素对其生物转化动力学和途径的影响,很少探讨同分异构体和微生物群落结构对PrePFOS生物转化机制的影响.微生物是PrePFOS生物转化的主导者,但其在PrePFOS降解过程中的具体作用机制尚未明确.同时,关于PrePFOS对其赋存介质的理化性质以及其中微生物群落结构和功能的影响未曾见报道,在未来研究中应得到关注.此外,对于DiSAmPAP在环境中的好氧生物降解研究还有待进一步研究.
[1] Wang T Y, Wang P, Meng J, et al. A review of sources, multimedia distribution and health risks of perfluoroalkyl acids (PFAAs) in China [J]. Chemosphere, 2015,129:87-99.
[2] Zhang L, Niu J, Li Y, Wang Y, et al. Evaluating the sub-lethal toxicity of PFOS and PFOA using rotifer Brachionus calyciflorus [J]. Environmental Pollution, 2013,180(0):34-40.
[3] 史亚利,蔡亚岐.全氟和多氟化合物环境问题研究[J]. 化学进展, 2014,26(4):665-681. Shi Y L, Cai Y Q. Study of Per-and Polyfluoroalkyl Substances Related Environmental Problems [J]. Progess in Chemistry, 2014, 26(4):665-681.
[4] Wang S L, Wang H, Deng W J. Perfluorooctane sulfonate (PFOS) distribution and effect factors in the water and sediment of the Yellow River Estuary [J]. China. Environmental Monitoring & Assessment 2013,185(10):8517-8524.
[5] Pan C G, Ying G G, Liu Y S, et al. Contamination profiles of perfluoroalkyl substances in five typical rivers of the Pearl River Delta region, South China [J]. Chemosphere, 2014,114:16-25
[6] Howard P H, Muir D C G. Identifying new persistent and bioaccumulative organics among chemicals in commerce [J]. Environmental Science & Technology, 2010,44(7):2277-2285.
[7] Armitage J M, Schenker U, Scheringer M, et al. Modeling the global fate and transport of perfluorooctane sulfonate (PFOS) and precursor compounds in relation to temporal trends in wildlife exposure [J]. Environmental Science & Technology, 2009,43(24):9274-9280.
[8] Rayne S, Forest K. A new class of perfluorinated acid contaminants: Primary and secondary substituted perfluoroalkyl sulfonamides are acidic at environmentally and toxicologically relevant pH values [J]. Journal of environmental science and health. Part A, Toxic/hazardous substances & environmental engineering, 2009,44(13):1388-1399.
[9] Steinle-Darling E, Reinhard M. Nanofiltration for trace organic contaminant removal: Structure, solution, and membrane fouling effects on the rejection of perfluorochemicals [J]. Environmental Science & Technology, 2008,42(14):5292-5297.
[10] Gilljam J L, Leonel J, Cousins I T, et al. Is ongoing sulfluramid use in south America a significant source of perfluorooctanesulfonate (PFOS). Production inventories, environmental fate, and local occurrence [J]. Environmental Science & Technology, 2016,50(2):653-659.
[11] Xie S W, Wang T Y, Liu S J, et al. Industrial source identification and emission estimation of perfluorooctane sulfonate in China [J]. Environment International, 2013,52:1-8.
[12] Paul A G, Jones K C, Sweetman A J. A first global production, emission, and environmental inventory for perfluorooctane sulfonate [J]. Environmental Science & Technology, 2009,43(2):386-392.
[13] Ahrens L, Bundschuh M. Fate and effects of poly and perfluoroalkyl substances in the aquatic environment: A review [J]. Environmental Toxicology and Chemistry, 2014,33(9):1921-1929.
[14] Moody C A, Field J A. Determination of perfluorocarboxylates in groundwater impacted by Fire-Fighting activity [J]. Environmental Science and Technology, 1999,33(16):2800-2806.
[15] Ahrens L, Barber J L, Xie Z, et al. Longitudinal and latitudinal distribution of perfluoroalkyl compounds in the surface water of the Atlantic ocean [J]. Environmental Science and Technology, 2009, 43(9):3122-3127.
[16] Ahrens L, Taniyasu S, Yeung L W Y, et al. Distribution of polyfluoroalkyl compounds in Water, Suspended Particulate Matter and Sediment from Tokyo Bay, Japan [J]. Chemosphere, 2010,79(3): 266-272.
[17] Yu N, Shi W, Zhang B, et al. Occurrence of perfluoroalkyl acids including perfluorooctane sulfonate isomers in Huai River Basin and Taihu Lake in Jiangsu Province, China [J]. Environmental Science & Technology, 2013,47(2):710-717.
[18] Zhang Y, Meng W, Guo C, et al. Determination and partitioning behavior of perfluoroalkyl carboxylic acids and perfluorooctanesulfonate in water and sediment from Dianchi Lake, China [J]. Chemosphere, 2012,88(11):1292-1299.
[19] Benskin J P, Ikonomou M G, Gobas F A P C, et al. Observation of a novel PFOS-Precursor, the perfluorooctane sulfonamido Ethanol- Based phosphate (SAmPAP) diester, in marine sediments [J]. Environmental Science and Technology, 2012,46(12):6505-6514.
[20] Higgins C P, Field J A, Criddle C S, et al. Quantitative determination of perfluorochemicals in sediments and domestic sludge [J]. Environmental Science and Technology, 2005,39(11):3946-3956.
[21] Zareitalabad P, Siemens J, Hamer M, et al. Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater – A review on concentrations and distribution coefficients [J]. Chemosphere, 2013,91:725-732.
[22] Houtz E F, Higgins C P, Field J A, et al. Persistence of perfluoroalkyl acid precursors in AFFF-impacted groundwater and soil [J]. Environmental Science & Technology, 2013,47(15):8187-8195.
[23] Clarke B O, Smith S R. Review of 'emerging' organic contaminants in biosolids and assessment of international research priorities for the agricultural use of biosolids [J]. Environment International, 2011, 37(1):226-247.
[24] Yoo H, Washington J W, Ellington J J, et al. Concentrations, distribution, and persistence of fluorotelomer alcohols in sludge- applied soils near Decatur, Alabama, USA [J]. Environmental Science & Technology, 2010,44(22):8397-8402.
[25] Wang Z, Xie Z Y, Mi W Y, et al. Neutral poly/per-fluoroalkyl substances in air from the Atlantic to the southern ocean and in Antarctic snow [J]. Environmental Science & Technology, 2015, 49(13):7770-7775.
[26] 武晓果,谢周清.南北极全氟化合物的含量、分布及迁移[J]. 极地研究, 2009,21(3):198-210. Wu X G, Xie Z Q. The level, distribution and transportation of perfluorinated compounds in arctic and antarctic [J]. Chinese Journal of Polar Research, 2009,21,(3):198-210.
[27] 杨 琳,李敬光.全氟化合物前体物质生物转化与毒性研究进展[J]. 环境化学, 2015,34(4):649-655.Yang L, Li J G. Perfluorinated compound precursors: Biotransformation and toxicity [J]. Environmental Chemistry, 2015,34(4):649-655.
[28] Murakami M, Nishikoori H, Sakai H, et al. Formation of perfluorinated surfactants from precursors by indigenous microorganisms in groundwater [J]. Chemosphere, 2013,93(1):140-145.
[29] Sinclair E, Kannan K. Mass loading and fate of perfluoroalkyl surfactants in wastewater treatment plants [J]. Environmental Science and Technology, 2006,40,(5):1408-1414.
[30] Martin J W, Asher B J, Beesoon S, et al. PFOS or PreFOS? Are perfluorooctane sulfonate precursors (PreFOS) important determinants of human and environmental perfluorooctane sulfonate (PFOS) exposure? [J]. Journal of Environmental Monitoring, 2010,12(11): 1979-2004.
[31] Murakami M, Nishikoori H, Sakai H, et al. Formation of perfluorinated surfactants from precursors by indigenous microorganisms in groundwater [J]. Chemosphere, 2013,93(1):140-145.
[32] Mejia Avendaño S, Liu J. Production of PFOS from aerobic soil biotransformation of two perfluoroalkyl sulfonamide derivatives [J]. Chemosphere, 2015,119:1084-1090.
[33] Zhang L L, Linda S L, Niu J F, et al. Kinetic analysis of aerobic biotransformation pathways of a perfluorooctane sulfonate (PFOS) precursor in distinctly different soils [J]. Environmental Pollution, 2017,(229):159-167.
[34] Jinxia Liu, Guowei Zhong, Wei Li, et al. Isomer-specific biotransformation of perfluoroalkyl sulfonamide compounds in aerobic soil [J]. Science of the Total Environment, 2019,651:766-774.
[35] Rhoads K R, Janssen E M L, Luthy R G, et al. Aerobic biotransformation and fate of N-Ethyl perfluorooctane sulfonamidoethanol (N-EtFOSE) in activated sludge [J]. Environmental Science & Technology, 2008,42(8): 2873-2878.
[36] Boulanger B, Vargo J D, Schnoor J L, et al. Evaluation of perfluorooctane surfactants in a wastewater treatment system and in a commercial surface protection product [J]. Environmental Science and Technology, 2005,39(15):5524-5530.
[37] Lange C. The aerobic biodegradation of N-EtFOSE alcohol by the microbial activity present in municipal wastewater treatment sludge [R]. 3M Company, 2000.
[38] Benskin J P, Ikonomou M G, Gobas F A P, et al. Biodegradation of N-ethyl perfluorooctane sulfonamido ethanol (EtFOSE) and EtFOSE- based phosphate diester (SAmPAP diester) in marine sediments [J]. Environmental Science & Technology, 2013,47(3):1381-1389.
[39] Murakami M, Sato N, Anegawa A, et al . Multiple Evaluations of the Removal of Pollutants in Road Runoff by Soil Infiltration [J]. Water Research, 2008,42(10/11):2745-2755.
[40] Chen M, Qiang L, Pan X, et al. In Vivo and in Vitro Isomer-Specific biotransformation of perfluorooctane sulfonamide in common carp (cyprinus carpio) [J]. Environmental Science & Technology, 2015, 49(23):13817-24.
[41] Zhao S, Liang T, Zhou T, et al. Biotransformation and responses of antioxidant enzymes in hydroponically cultured soybean and pumpkin exposed to perfluorooctane sulfonamide (FOSA). [J]. Ecotoxicology & Environmental Safety, 2018,161:669-675.
[42] Sepulvado J G, Blaine A C, Hundal L S, et al. Occurrence and fate of perfluorochemicals in soil following the land application of municipal biosolids [J]. Environmental Science & Technology, 2011,45(19): 8106-8112.
[43] Busch J, Ahrens L, Sturm R, et al. Polyfluoroalkyl Compounds in Landfill Leachates [J]. Environmental Pollution, 2010,158(5):1467- 1471.
[44] Peng H, Zhang S, Sun J, et al. Isomer-specific accumulation of perfluorooctane sulfonate from (N-Ethyl perfluorooctane sulfonamido) ethanol-based phosphate diester in Japanese medaka (Oryzias latipes) [J]. Environmental Science and Technology, 2014,48(2):1058-1066.
[45] Boulanger B, Vargo J D, Schnoor J L, et al. Evaluation of perfluorooctane surfactants in awastewater treatment system and in a commercial surface protection product [J]. Environmental Science and Technology, 2005,39(15):5524-5530.
Aerobic biodegradation of perfluorooctane sulfonateprecursors in different environment media.
ZHOU Shao-hong, WANG Gan-gan, ZHANG Li-lan*
(State Key Laboratory of Coal Mine Disaster Dynamics and Control, Chongqing University, Chongqing 400044, China)., 2019,39(9):3967~3975
As one of persistent organic pollutants, perfluorooctane sulfonate (PFOS) has been widely detected in various environmental media and shows multiple toxic effects on human and animals. One of its main sources is from the biotransformation of PFOS precursor (PrePFOS). PFOS and PrePFOS have been found in various environmental media like soil, air and water. Understanding the biodegradation pathway and PFOS yield of PrePFOS are useful to predict the environmental fata of PFOS due to that its PFOS yield from abiotic degradation could be ignored. In this study, the occurrence and biodegradation of PrePFOS in different environmental media were summarized. Of all the PrePFOS, N-ethyl perfluorooctane sulfonamidoethanol (EtFOSE) were mostly explored. Its biodegradation pathway and PFOS yield have been studied in soil, activated sludge, and sediment, which have found that its biodegradation mechanism is closely related with the physicochemical properties and microbial community structure of the medium. The decarboxylation of N-ethyl perfluorooctane sulfonamidoacetic acid (EtFOSAA) to N-ethyl perfluorooctane sulfonamide (EtFOSA) is the main rate-limiting step for the conversion of EtFOSE to PFOS. The latest research on aerobic biodegradation of EtFOSE in soil first proposed that decarboxylation of perfluorooctane sulfonamidoacetic acid (FOSAA) to perfluorooctane sulfonamide (FOSA) might be another rate-limiting step in the conversion of EtFOSE to PFOS. EtFOSE-Based Phosphate Diester (DiSAmPAP) had been widely used in various commercial products before 2003, and it had not been detected in sediment until 2012 due to its high Kow value and the lack of detection technology. Its half-life was predicted to be > 380d and it might be biodegradated into EtFOSE firstly and finally transformed into PFOS. And the existing problems and future research direction were discussed too.
perfluorooctane sulfonate precursor(PrePFOS);distribution characteristics;aerobic biodegradation;soil;activated sludge;sediment
X172
A
1000-6923(2019)09-3967-09
周绍宏(1995-),男,重庆秀山人,重庆大学硕士研究生,主要从事土壤有机污染物危害及降解研究.
2019-02-18
国家自然科学基金资助项目(41603109);重庆市基础科研与前沿技术研究专项(cstc2017jcyjAX0362);中央高校基本科研业务费资助项目(106112016CDJXY240001,106112017CDJQ218844);重庆市留学回国人员创新资助项目重点项目
*责任作者, 副教授, lilanzhang@cqu.edu.cn

