刺参体壁胰/类胰丝氨酸蛋白酶的性质及其在自溶中的作用
徐锦华,孟泽玲,葛诗琪,薛 鹏,张公亮,侯红漫,孙黎明,*
(1.大连工业大学食品学院,辽宁 大连 116034;2.国家海洋食品工程技术研究中心,辽宁 大连 116034)
刺参(棘皮动物门,海参纲)与人参、燕窝、鱼翅齐名,是中国海产珍品之一。据统计,2016年,我国的养殖产量为20万 t,主产区在山东和辽宁[1]。与常见的经济水产品相比,刺参具有较强的自溶能力,受紫外线、机械摩擦等外界刺激极易发生自溶。在刺参的贮藏、运输和加工过程中,经常因自溶导致刺参原料品质下降而造成经济损失。相关研究表明,刺参自溶的根本原因是其组织内源性蛋白酶,半胱氨酸蛋白酶[2-3]、天冬氨酸蛋白酶[4]及基质金属蛋白酶[5-6]均可促进捕捞后刺参的自溶。
丝氨酸蛋白酶是活性中心含有丝氨酸作为亲核氨基酸的一大类蛋白酶的总称,广泛分布于真核和原核动物体内[7]。根据底物特异性,丝氨酸蛋白酶可以分为胰蛋白酶样、胰凝乳蛋白酶样、凝血酶样、弹性蛋白酶样和枯草杆菌蛋白酶样蛋白酶[8]。其中,胰蛋白酶样和胰凝乳蛋白酶样丝氨酸蛋白酶在自然界中分布最为广泛,根据MEROPS数据库提供的信息,已经有超过240 种[9]。水产动物贮运及加工过程中以蛋白质降解为典型特征的自溶现象比较普遍,丝氨酸蛋白酶已被发现参与虾[10]及鱼肉[11-12]的自溶。在刺参自溶研究方面,Yan Longjie等[13]利用从刺参肠中分离纯化得到丝氨酸蛋白酶,发现该酶能够降解从刺参体壁中提取的胶原蛋白。李傲婷等[14]利用蛋白酶特异性抑制剂发现丝氨酸蛋白酶参与刺参肠的自溶。Liu Ziqiang等[15]发现外源胰蛋白酶能够部分降解刺参胶原从而推测丝氨酸蛋白酶可能参与刺参自溶。至今,尚鲜有关于刺参体壁中内源性丝氨酸蛋白酶的一般酶学性质及对刺参体壁自溶影响的报道。因此,本研究从刺参体壁中提取粗酶液,利用特异性荧光底物对胰/类胰丝氨酸蛋白酶的基本酶学性质及其在刺参自溶中的潜在作用进行研究,为阐明刺参自溶机制提供理论支持。
1 材料与方法
1.1 材料与试剂
新鲜刺参,购自大连市刘家桥市场“长海县刺参专卖店”。
Boc-Phe-Ser-Arg-MCA、Suc-Ala-Ala-Pro-Phe-MCA、Suc-Ala-Pro-Ala-MCA、Suc-Ala-Ala-Ala-MCA日本Peptide Institute有限公司;蛋白酶抑制剂(Aprotinin)、邻菲咯啉、(3S)-7-氨基-1-氯-3-磺酰氨基-2-庚酮盐酸盐((3S)-1-chloro-3-tosylamido-7-amino-2-heptanone hydrochloride,TLCK)、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、Na-对甲苯磺酰-L-苯丙氨酸氯甲基酮((S)-1-chloro-3-tosylamido-4-phenyl-2-butanone,TPCK)、碘乙酸、乙二胺四乙酸、抗蛋白酶(Antipain)、4-(2-氨乙基)苯磺酰氟盐酸盐(4-(2-aminoethyl)benzenesulfonylflu oridehydrochlorid,AEBSF)、大豆胰蛋白酶抑制剂(soybean trypsin inhibitor,SBTI)、抑肽素(Pepstatin)生化试剂 美国Sigma化学药品公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
L-550台式低速离心机 湖南湘仪实验仪器开发有限公司;F-2700荧光分光光度计 日本Hitachi公司;RC-6+冷冻离心机 美国Thermo公司;T27127分光光度计 北京普析通用责任有限公司;M200酶标仪瑞士Tecan Infinite公司;JJ200Y精密电子天平 美国双杰兄弟(集团)有限公司;PB-10 pH计 德国Sartorius公司。
1.3 方法
1.3.1 刺身体壁粗酶液的制备
鲜活刺参去头去肠去体腔液后,用去离子水洗净附着的泥沙等异物。将体壁切碎,称取100 g加入Tris-HCl缓冲液(1∶1(g/mL),50 mmol/L,pH 7.5),于冰浴中进行匀浆(用3~5 s从2 000 r/min升到8 000 r/min,维持6~8 s然后降至2 000 r/min,如此反复3~5 次),在4 ℃层析柜内搅拌浸提1 h,然后13 500 r/min冷冻离心15 min,并收集上清液。加硫酸铵至40%,经13 500 r/min冷冻离心15 min后,取上清液,再加硫酸铵至80%,经13 500 r/min冷冻离心15 min后,收集沉淀。用缓冲液溶解沉淀,之后用相应的缓冲液透析24 h(透析袋截留分子质量为10 kDa),收集透析液。最后用10 kDa的超滤膜进行超滤,以去除小分子蛋白,并对粗酶液进行浓缩,收集未透过部分放入-80 ℃待用。
1.3.2 底物特异性测定
取150 μL的刺参丝氨酸蛋白酶粗酶液,加入75 μL Tris-HCl缓冲液,振荡混匀,在46 ℃孵育2 min,再分别加入75 μL以下4 种底物:Boc-Phe-Ser-Arg-MCA、Suc-Ala-Pro-Phe-MCA、Suc-Ala-Pro-Ala-MCA、Suc-Ala-Ala-Ala-MCA,同1.3.3节条件孵育30 min,然后加入300 μL终止液,并检测酶活力。
1.3.3 丝氨酸蛋白酶活力测定
按照Guo Chuan等[16]的方法,稍作修改进行测定。将丝氨酸蛋白酶底物Boc-Phe-Ser-Arg-MCA溶于DMSO配成1 mol/L贮存液,分装后于-20 ℃冰箱中备用,使用时用纯净水稀释至100 mmol/L。将75 μL酶液、150 μL的Tris-HCl缓冲液(50 mmol/L,pH 7.5)混匀,46 ℃预热2 min,再加入75 μL底物混匀,46 ℃孵育30 min,加入300 μL终止液(甲醇-异丙醇-水(35∶35∶30,V/V))混匀。用荧光光度计激发波长380 nm、发射波长460 nm测OD值,以等量的缓冲液代替酶液作对照。在此条件下,以每小时催化底物释放l μmol MCA的酶量定义为1 个活力单位U。
1.3.4 最适pH值、温度及热稳定性的测定
使用0.05 mol/L不同pH值缓冲溶液(HAc-NaAc缓冲液pH 4.0~6.0,Tris-HCl缓冲液pH 7.0~9.0,NaHCO3-NaOH缓冲液pH 10.0)测定刺参丝氨酸蛋白酶的最适pH值。取150 μL的刺参丝氨酸蛋白酶粗酶液,分别加入上述不同pH值缓冲液,在46 ℃将上述pH值溶液和底物反应30 min并测定酶活性。使用最适pH值缓冲液,将提取的蛋白酶在25~80 ℃的范围内进行最适温度的测定。为确定其热稳定性,将提取的蛋白酶在25~80 ℃孵育30 min后检测酶活力[4]。
1.3.5 金属离子对丝氨酸蛋白酶的影响
取75 μL的刺参丝氨酸蛋白酶,分别加入75 μL以下金属离子:Cu2+、Pb2+、Fe2+、Mn2+、Ba2+、Fe3+、Cr3+、Zn2+、Mg2+,在最适温度下孵育30 min后加入150 μL缓冲液,在最适温度下孵育2 min,加入特异性底物75 μL反应30 min后加终止液300 μL混匀,取出后检测酶活力[17]。
1.3.6 抑制剂对丝氨酸蛋白酶的影响
取75 μL的刺参丝氨酸蛋白酶粗酶液,分别加入75 μL抑制剂TPCK、TLCK、PMSF、碘乙酸、Antipain、乙二胺四乙酸、二硫苏糖醇、邻菲咯啉、Aprotinin、AEBSF,在最适温度下孵育30 min后加入150 μL缓冲液,孵育2 min,加入特异性底物75 μL反应30 min后加终止液300 μL混匀,并检测酶活力[17]。
1.3.7 丝氨酸蛋白酶对刺参自溶的影响
称取一定量的刺参(100±10)g剁碎,然后在冰浴中用匀浆机匀浆(8 000 r/min,10 s,3~5 次)。称取(0.5±0.002)g刺参匀浆物于10 mL EP管中。用50 mmol/L pH 7.5的Tris-HCl缓冲液将丝氨酸蛋白酶的特异性抑制剂(PMSF、TPCK、TLCK、AEBSF、SBTI)稀释到需要的终浓度的2 倍,然后按照质量与抑制剂体积比为1∶1(g/mL)添加,立即振荡混匀。用Tris-HCl缓冲液代替抑制剂作为对照组。最后于46 ℃孵育0、2、4、5、6 h,诱导自溶。对应的时间点将EP管取出放入冰水浴中终止反应,13 500×g、4 ℃离心15 min,取上清液备用。采用福林-酚法测定上清液中可溶性蛋白含量[18]。取上清液,按照体积比1∶2添加10% TCA,混匀并反应20 min后,10 000×g、4 ℃离心15 min,取上清液,采用福林-酚法检测可溶性寡肽的含量。取上清液,按照1.3.2节方法测定丝氨酸蛋白酶活力的变化。
1.4 数据处理
采用Origin 8.0绘制曲线;采用SPSS 19进行差异显著性分析,P<0.05,差异显著。
2 结果与分析
2.1 底物特异性

图1 刺参体壁丝氨酸蛋白酶底物特异性Fig. 1 Substrate specificity of serine protease in dermis of S. japonicus
利用4 种丝氨酸蛋白酶的荧光底物Boc-Phe-Ser-Arg-MCA(胰/类胰蛋白酶底物)、Suc-Ala-Ala-Pro-Phe-MCA(胰凝乳蛋白酶)、Suc-Ala-Pro-Ala-MCA(弹性蛋白酶)、Suc-Ala-Ala-Ala-MCA(弹性蛋白酶)测定刺参体壁丝氨酸蛋白酶的活性,结果见图1。其中,用Boc-Phe-Ser-Arg-MCA测得的酶活力远高于其他3 种底物,表明刺参丝氨酸蛋白酶识别和水解该底物的特异性最高而且刺参体壁中胰/类胰蛋白酶的活性较高。蛋白酶对不同底物的识别特异性的确存在较大差异。刺参肠道蛋白酶对血红蛋白、酪蛋白和BApNA这3 种底物的水解能力存在很大差异,对酪蛋白的水解活性最强,而对常用的丝氨酸蛋白酶底物BApNA的水解最弱[19]。Osatomi[20]和Guo Chuan[16]等均发现鲤鱼和鲫鱼肌肉中丝氨酸蛋白酶对荧光底物中Phe-Ser-Arg、Gln-Arg-Arg、Val-Pro-Arg这三联氨基酸残基的催化活性最强。由此可见,刺参丝氨酸蛋白酶中的胰/类胰蛋白酶与鲫鱼和鲤鱼胰/类胰蛋白酶的底物特异性有相似之处。在后续的酶活检测中均选取Boc-Phe-Ser-Arg-MCA作为最适底物。
2.2 最适pH值、温度及热稳定性分析
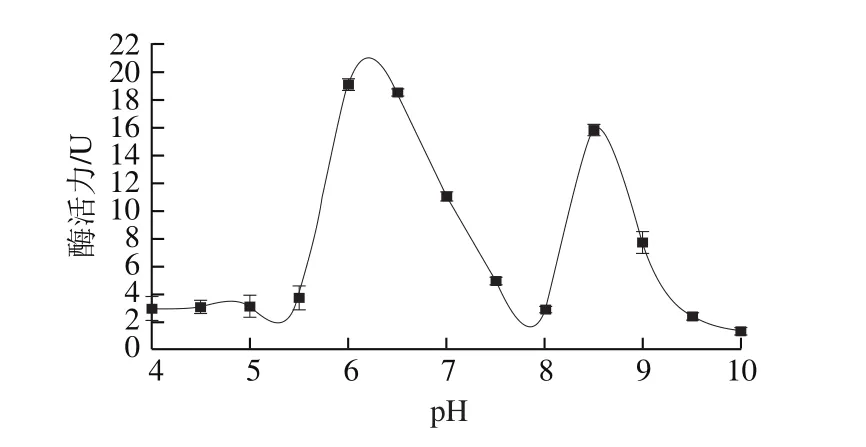
图2 刺参丝氨酸蛋白酶的最适pH值分析Fig. 2 Optimal pH of sea cucumber serine protease
由图2可见,对于刺参体壁中丝氨酸蛋白酶,在pH 6.2、8.5出现2 个酶活力峰表明刺参体壁中至少含有2 种胰/类胰蛋白酶。Yan Longjie等[13]刺身肠道中分离出一种类型为subtilisin/kexin的丝氨酸蛋白酶,该酶的最适pH值为7.0,pH值低于5或高于9时酶活性几乎消失。Fu Xueyan等[19]发现在pH 8、13.5出现酶活力峰的两种刺参肠道蛋白酶为丝氨酸蛋白酶。由此可推测,刺参体壁丝氨酸蛋白酶的类型及性质与肠道丝氨酸蛋白酶有较大差异。
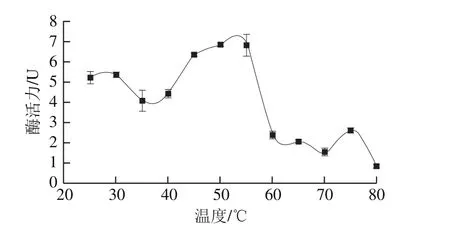
图3 刺参丝氨酸蛋白酶的最适温度分析Fig. 3 Optimal temperature of sea cucumber serine protease
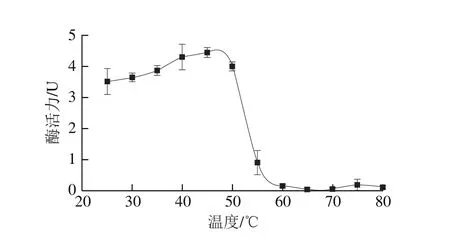
图4 刺参丝氨酸蛋白酶的热稳定性分析Fig. 4 Temperature stability of sea cucumber serine protease
由图3可见,温度在45~55 ℃时酶活力均处于较高水平,50~55 ℃时酶活力出现峰值,由于酶活力峰较宽,提示两种胰/类胰蛋白酶的最适温度敏感性比较相似。当温度高于55 ℃时,酶活力迅速大幅度下降,提示55 ℃是刺参胰胰/类胰蛋白酶最大活力和失活的临界点。本实验室系列研究显示刺身体壁和肠道的半胱氨酸蛋白酶的最大酶活力温度也均在50~55 ℃[17,21-22]。尽管蛋白酶类型不同,但海参体壁及肠道蛋白酶却有相似的最适温度。研究发现,欧洲鲫鱼肌原纤维结合型丝氨酸蛋白酶的最适温度为55 ℃[16],日本鲈鱼肝胰腺组织中的胰凝乳蛋白酶的最适温度为45 ℃[23],鲣鱼内脏胰蛋白酶的最适温度为60 ℃[24],真鲷肌肉中丝氨酸蛋白酶的最适温度为40 ℃[25],由此,水产经济动物体内蛋白酶最适温度很可能与物种本身关系最为密切。
图4显示,刺参体壁中胰/类胰蛋白酶在30~50 ℃范围内活力稳定且有一定提高,提示该类蛋白酶具有一定的热激活特性。但与图3对应,当温度超过50 ℃时其酶活力急剧下降,超过60 ℃其酶活力基本丧失,这一结果也与刺参半胱氨酸蛋白酶的温度稳定性几乎相同[17,21-22]。
2.3 金属离子对丝氨酸蛋白酶活力的影响
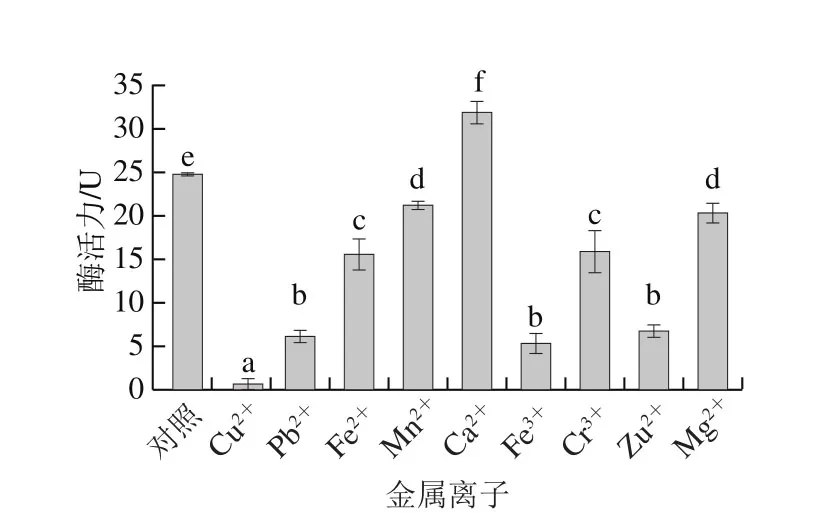
图5 金属离子对刺参丝氨酸蛋白酶活性的影响Fig. 5 Effect of metal ions on the activity of sea cucumber serine protease
从图5可以看出,只有Ca2+能够促进该酶活力;Fe2+、Mn2+、Cr3+、Mg2+对刺参体壁丝氨酸蛋白酶有一定的抑制作用,抑制作用在14.2%~37.1%之间;Cu2+、Fe3+、Pb2+、Zn2+则能强烈抑制该酶的活性,抑制率均在73%以上,其中Cu2+几乎完全抑制该酶活性。王梦想等[26]也报道Cu2+对蓝圆鲹丝氨酸蛋白酶有显著抑制作用,Fe2+、Mn2+有较明显的抑制作用。Costa等[27]也报道了终浓度为1 mmol/L的Zn2+、Cu2+、Pb2+对黄尾鲹丝氨酸蛋白酶活力有明显抑制作用。Grover等[28]报道Cu2+以非竞争性抑制而Zn2+则以反竞争性抑制的方式抑制类胰蛋白酶的活性。金属离子通过与蛋白酶活性域或底物识别/结合位点中某些氨基酸的结合,使催化位点或更为稳定或更不稳定,实现对蛋白酶活力的促进或抑制作用[7]。
2.4 抑制剂对丝氨酸蛋白酶活性的影响
图6显示,与对照组比较,丝氨酸蛋白酶特异性抑制剂TLCK、PMSF、TPCK、AEBSF和SBTI以及半胱氨酸/丝氨酸蛋白酶抑制剂Antipain均能够明显抑制该酶活力。Aprotinin为一种来自牛肺的胰蛋白酶抑制剂,对该酶的抑制作用较弱,提示海参胰/类胰蛋白酶与牛胰蛋白酶在结构上有较大差异。邻菲咯啉和乙二胺四乙酸对该酶的抑制作用分别为47%和20%,提示该酶具有一定的离子依赖性。作为半胱氨酸的修饰剂,碘乙酸体现出强烈的酶活抑制作用,提示半胱氨酸对刺参胰/类胰蛋白酶活性中心或底物识别/结合部位的空间结构有较大影响。
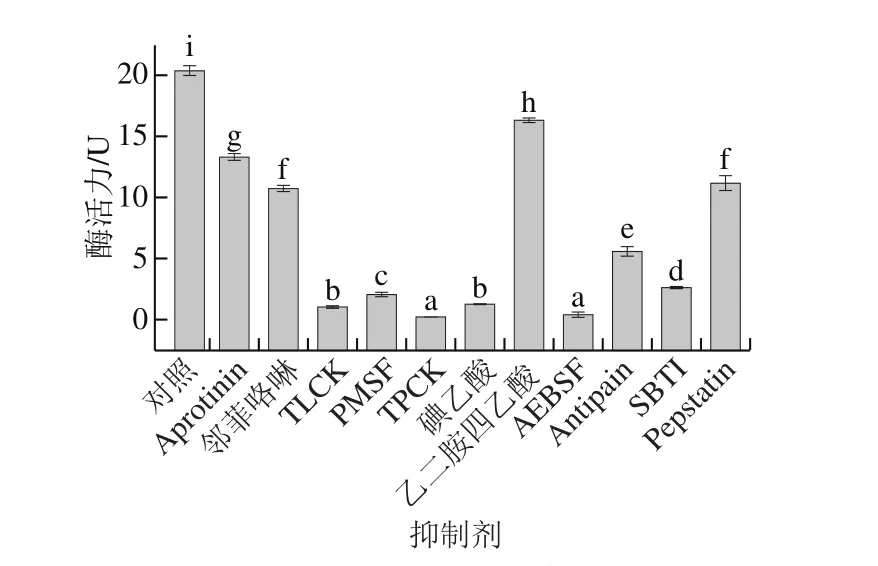
图6 蛋白酶抑制剂对刺参丝氨酸蛋白酶的影响Fig. 6 Effect of protease inhibitors on the activity of sea cucumber serine protease
2.5 自溶过程中可溶性蛋白的变化
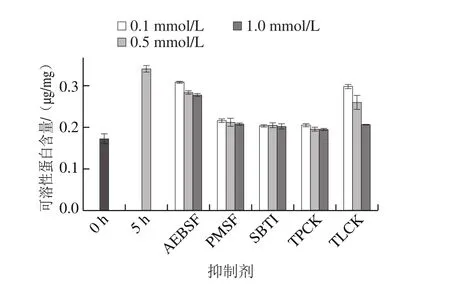
图7 丝氨酸蛋白酶抑制剂对刺参自溶5 h后可溶蛋白含量的影响Fig. 7 Effect of serine protease inhibitors on soluble protein content in sea cucumber after 5 h autolysis
实验室前期研究发现,海参自溶过程中可溶性蛋白的降解早于其他类型蛋白的改变[2]。由图7可知,5 种抑制剂均可抑制自溶过程中总可溶性蛋白的生成。其中,以PMSF、SBTI、TPCK的抑制作用最为显著,终浓度为0.1 mol/L即可达到最大抑制作用。AEBSF和TLCK的抑制作用相对小一些,但有良好的量效关系。虽然5 种抑制剂对刺参胰/类胰蛋白酶的抑制作用机制不同,但对可溶性蛋白生成量的抑制提示丝氨酸蛋白酶很可能参与了刺参体壁的自溶(蛋白降解)过程。李傲婷等[14]研究了内源酶对刺参肠自溶的影响,结果表明,Pepstatin、SBTI、TLCK、TPCK等均对刺参肠的自溶也有一定抑制作用,同时丝氨酸蛋白酶参与了海参自溶过程。
2.6 自溶过程中TCA可溶性寡肽的变化
如图8所示,5 种丝氨酸蛋白酶特异性抑制剂均可在一定程度上抑制自溶过程中TCA可溶性寡肽的生成,其中终浓度为1 mmol/L AEBSF的抑制作用最为显著。与图7比较,丝氨酸蛋白酶抑制剂对TCA寡肽生成的抑制作用不如对可溶性蛋白生成的抑制作用强。这提示丝氨酸蛋白酶很可能主要参与自溶初期大分子蛋白的解离或断裂;而TCA寡肽的生成,除丝氨酸蛋白酶的作用外,还有其他类型蛋白酶或端肽参与。郑杰等[29]也发现海参自溶过程中TCA可溶性寡肽含量有明显上升。
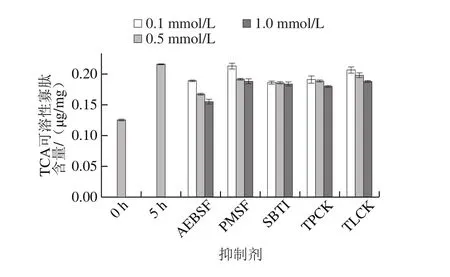
图8 丝氨酸蛋白酶抑制剂对刺参自溶5 h后TCA可溶性寡肽含量的影响Fig. 8 Effect of serine protease inhibitors on TCA soluble oligopeptide content in sea cucumber after 5 h autolysis
2.7 自溶过程中丝氨酸蛋白酶活力的变化
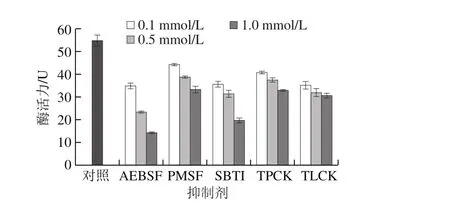
图9 丝氨酸蛋白酶抑制剂对刺参自溶5 h丝氨酸蛋白酶活力变化的影响Fig. 9 Effect of serine protease inhibitors on serine protease activity in sea cucumber after 5 h autolysis
图9 显示刺参体壁自溶5 h后丝氨酸蛋白酶活力及抑制剂对酶活力的影响。AEBSF的抑制作用最为明显,其次是SBTI,量效关系最为显著。AEBSF和SBTI均为胰/类胰蛋白酶抑制剂,与前面底物特异性实验结果对应,而且进一步提示刺参体壁中的胰/类胰蛋白酶是参与刺参自溶的主要丝氨酸蛋白酶类型。
3 结 论
刺参体壁中至少存在2 种胰/类胰丝氨酸蛋白酶的活力较高,分别在pH 6.2和pH 8.5呈现较高活力,其最适温度范围均为50~55 ℃,在50 ℃以下具有一定稳定性;Cu2+、Fe3+、Pb2+、Zn2+则能强烈抑制该酶的活性,Ca2+可促进该酶活力;PMSF、TPCK、TLCK、AEBSF、SBTI 5 种丝氨酸蛋白酶特异性抑制剂均可抑制该酶活力,并可降低自溶过程中可溶性蛋白和TCA可溶性寡肽的生成,说明该类丝氨酸蛋白酶很有可能参与海参自溶过程。

