大鼠宫腔粘连(IUA)模型中的上皮间质转化(EMT)现象
郭罗培 陈丽梅 陈 芳 江宁红 隋 龙,2
(1复旦大学附属妇产科医院宫颈疾病诊疗中心 上海 200011; 2上海市女性生殖内分泌相关疾病重点实验室 上海 200011)
宫腔粘连(intrauterine Adhesion,IUA)多因宫内操作造成内膜损伤,表现为月经不规律,不孕与复发性流产。根据文献报道,人工流产后IUA发生率在8.1%~21.2%。虽然宫腔镜下粘连分解术可以治疗IUA,但是此病的复发率仍高达62.5%[1-2]。目前针对IUA尤其是重度IUA尚无较好的治疗方法,关于此病的发病机制也是知之甚少。
妇产科医师普遍认同IUA是一种纤维化疾病,子宫内膜上皮细胞对激素失去敏感性,纤维组织增生,显微镜下病理表现为纤维化,大量内膜被纤维组织所替代[3]。上皮间质转化(epithelial-mesenchymal transition,EMT)是指上皮性细胞经过特定程序转化为具有间质细胞表型的生物过程,包括胚胎发育相关的Ⅰ型EMT,纤维化相关的Ⅱ型EMT与肿瘤相关的Ⅲ型EMT[4]。EMT在创伤导致的纤维化疾病的发生发展中具有重要作用,由此推测Ⅱ型EMT极可能在IUA纤维化的发生过程中发挥关键调节作用。在小鼠IUA模型中,间质指标Vimentin蛋白水平较正常小鼠升高,上皮指标Cytokeratin蛋白水平下降[5]。但是小鼠子宫内膜组织难以准确提取,并且上皮与间质标志在宫腔内的定位关系无法通过Western blot体现。针对这一问题,本研究采用机械损伤方式建立大鼠IUA模型,采用免疫组化的方式检测上皮及间质标志,以期为IUA内膜纤维化的发病机制提供研究线索。
材料和方法
动物材料24只清洁级SD成年雌性大鼠,6~8周龄,体重200~250 g,购自上海斯莱克实验动物有限责任公司(批号:SCXK沪2017-0005)。饲养条件:室温(21±2) ℃,恒湿(40%~60%),光照12 h/12 h,正常饮食,自由摄水。
试剂和仪器LEICA显微镜(德国Leica公司),石蜡切片机(金华市益迪医疗设备厂),戊巴比妥钠,显微手术器械(上海金中器械厂),医用7-0缝线(上海强生公司),苏木素和伊红(武汉谷歌生物有限公司),Masson染色试剂盒(南京凯基生物科技发展有限公司),鼠抗E-cadherin(美国Santa-Cruz公司),兔抗N-cadherin (武汉赛维尔生物科技有限公司),兔抗CD31兔抗Vimentin,兔抗TGF-β1及488山羊抗兔IgG荧光二抗(英国Abcam公司),兔/鼠通用型免疫组化二抗试剂盒和二氨基联苯胺(DAB)染色液(上海杰浩生物技术公司)。
模型制备SD大鼠术前禁食1晚,10%戊巴比妥钠按5 mL/kg腹腔注射麻醉后固定大鼠。剃去下腹部毛发,碘伏棉球消毒。在动物实验中心超净台中于耻骨联合上端2~3 cm处挑起外层皮肤,剪刀纵向剪开腹壁皮肤2 cm,逐层切开腹层黏膜、肌肉组织,进入腹腔,缓慢挑出大鼠的 Y型子宫(双子宫、双宫颈、单阴道,两侧宫角互不相通),于左侧子宫造模(IUA-L组),眼科剪于子宫中段正中央纵向剪开子宫壁,尽量全部剪开(大鼠子宫全长3~4 cm),眼科剪沿着子宫内膜慢慢剪,彻底去除子宫内膜全层,手术过程中无菌纱布随时止血,保证视野清晰,深度控制在子宫组织浅肌层至深肌层,以确保子宫浆膜面的完整性。子宫内膜切除完成后,7-0显微无菌手术缝线间断缝合子宫,清除血液,右侧子宫作自身对照(IUA-R组)。Sham假手术组左侧子宫(Sham-L组)仅切开再缝合,右侧子宫(Sham-R组)不做处理。手术完成后,将子宫还纳至腹腔,清洗腹腔,4-0手术缝线关腹。7天和28天后分别处死各组大鼠,子宫取样,4%多聚甲醛固定组织,48 h内石蜡包埋、切片[6]。
HE和Masson染色石蜡切片脱蜡、复水,HE染色。镜下观察整个子宫形态及炎症反应情况,计算每只大鼠子宫中的所有腺体数目。Masson染色用于计算子宫内膜纤维化程度。石蜡切片脱蜡复水后,使用Masson复合染色液染色6 min,磷酸钼染色5 min,中性树胶封片。每张片子拍摄3~5个视野,用Image Pro-Plus 6.0 (IPP)统计纤维化率。打开其中一张Masson图片,先建立一个统一扫描模板,然后直接批量打开要统计的图片,框出每张图片的间质部分,获得读数即为纤维化率[7]。
免疫组化子宫石蜡切片常规二甲苯脱蜡、梯度酒精入水,3%H2O2溶液去除内源性过氧化物酶,柠檬酸高压锅修复3 min,山羊血清封闭非特异性结合位点,CD31、E-cadherin、N-cadherin、TGF-β1 于4 ℃孵育过夜,二抗孵育60 min,DAB显色,苏木素衬染细胞,中性树胶封片。每张切片采集3~5个视野,根据CD31染色结果统计血管数,E-cadherin、N-cadherin、TGF-β1应用Image Pro-Plus 6.0统计平均光密度(mean optical density,MOD)。
免疫荧光切片脱蜡复水,高压修复,Vimentin 4 ℃孵育过夜,488山羊抗兔荧光二抗孵育60 min,DAPI封片剂封片,Confocal荧光显微镜拍照。
结 果
大鼠子宫内膜形态改变手术后7天及28天IUA组大鼠造模子宫积水,病理组织学可见宫腔堵塞充血,内膜上皮细胞几乎不可见,宫腔内充斥大量红细胞和中性粒细胞。7天时大鼠内膜几乎无腺体及微血管再生,28天时大鼠腺体可见少数再生(图1、2)。当观察到腺上皮细胞,并围成一个腔隙时,认为其是腺体结构。图1黑色箭头指向由腺上皮围成的腺体结构。黑箭头所指可见腺上皮细胞,认为其为腺体(图1B、1F),若未观察到腺上皮,即使可见腔隙,也不能认为是腺体(图D),28天IUA-L虽然可见小的腔隙,但是腔隙形态僵硬,并且未观察到腺上皮细胞,不能认为其是腺体。红色箭头指向炎症细胞(中性粒细胞为主)和红细胞,炎症细胞在HE染色图片中表现为暗黑色小点,与细胞核相似(但是更小),并可以发现炎症细胞弥散在间质内(图1B)。Sham-L组、IUA-R组和Sham-R组子宫内膜结构均完整,宫腔表面呈波浪状,上皮细胞与间质细胞形态分明,腺体数量密集。应用CD 31免疫组化显示小血管,可见内皮细胞阳性表达CD 31,用于计数统计(图2,×400)。可见 IUA-L组少量散在的微血管(图2A、2B),并能观察到密集的微小血管(图2C~2H),与Sham-L组、IUA-R组和Sham-R组相比,IUA-L组的微血管密度(microvascular density,MVD)明显下降。7天IUA-L组宫腔腺体数量(P<0.01)及7天和28天MVD(P<0.001)均较Sham-L组和IUA-R组减少(P<0.05);28天IUA-L组宫腔腺体数量较IUA-R组减少(P<0.05,表1)。
IUA大鼠内膜纤维化内膜纤维化是评价IUA的重要指标,本研究利用Masson染色计算内膜纤维化程度。Masson染色后胶原纤维呈蓝色,子宫内膜细胞、血管和肌肉呈暗红色。高倍镜下IUA-L组子宫内膜水肿严重,蓝染的胶原纤维弥散整个宫腔,IUA-L组7天时可观察到密集的红染炎症细胞(图3)。IUA-L组子宫纤维化面积比率明显高于IUA-R组和Sham-L组(P<0.001),Sham-L组与Sham-R组比较差异无统计学意义(表1)。

Black arrow points at epithelial cells and glands.Red arrow points at neutrophils and red blood cells.
图1 IUA-L组、IUA-R组、Sham-L组及Sham-R 组子宫7天与28天时HE染色结果
Fig 1 HE staining of uterus in IUA-L,IUA-R,Sham-L,Sham-R group on day 7 and day 28
图2 IUA-L组、IUA-R组、Sham-L组及Sham-R组子宫7天与28天时CD31染色结果(×400)Fig 2 CD31 staining of IUA-L,IUA-R,Sham-L and Sham-R on day 7 and day 28 (×400)
上皮及间质指标的表达及定量分析上皮指标E-cadherin在正常内膜腺上皮和腔上皮细胞胞质中呈现强阳性表达,间质细胞中偶可见E-cadherin表达。N-cadherin是一个鲜少表达于内膜上皮与间质细胞中的EMT指标。本研究中,可以观察到IUA-L组大鼠子宫内膜上皮细胞中E-cadherin表达明显低于IUA-R组和Sham-L组(P<0.001),Sham-L组与Sham-R组相比差异无统计学意义(图4)。N-cadherin在正常大鼠子宫内膜上皮和间质细胞中几乎不表达,但在造模的IUA-L组大鼠子宫中可发现病变的上皮细胞质中N-cadherin表达阳性,而间质细胞中未见表达(图5)。N-cadherin在IUA-L组中的表达明显高于IUA-R和Sham-L组(P<0.01),Sham-L组与Sham-R组N-cadherin的表达差异无统计学意义。Vimentin通常表达于间质细胞质中,荧光图片中可以清楚发现该指标在IUA-L组大鼠子宫内膜上皮细胞胞质中出现,而在未发生病变和正常的内膜中,Vimentin只表达于间质细胞中,不涉及腺上皮及腔上皮。表达Vimentin的上皮细胞所围成的腺体形态大多僵硬(图6)。
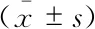
表1 各组子宫内膜腺体数量、MVD计数及纤维化率比较Tab 1 Gland numbers,MVD and fibrosis rate of endometrium in different groups

图3 IUA-L组、IUA-R组、Sham-L组及Sham-R组子宫7天与28天时Masson染色结果Fig 3 Masson staining of IUA-L,IUA-R,Sham-L and Sham-R on day 7 and day 28
转化生长因子TGF-β1的表达及分析TGF-β1作为一个促炎分子,强阳性表达于IUA-L内膜上皮及间质细胞质中,Sham-L组与正常内膜的IUA-R组和Sham-R组的上皮细胞可见弱表达的TGF-β1,间质细胞则几乎不表达。IUA-L组造模子宫内膜中TGF-β1的表达显著升高,其在IUA-R组及Sham-L组中的表达较弱(P<0.01,图7)。IUA-L组TGF-β1与N-cadherin不相关(P=0.694),而与E-cadherin相关(P=0.031,r=0.288)。
讨 论
本研究探讨了IUA纤维化与EMT之间的关系。IUA是一种医源性疾病,多因宫内操作(如刮宫)等引起,我国的发病率远远高于其他国家[8]。如果将月经看成是一种机体正常的创伤修复,那么IUA则类似于严重创伤造成的瘢痕,过度损伤子宫内膜功能层及基底层,从而造成严重的炎症反应,导致内膜纤维化的发生[9]。
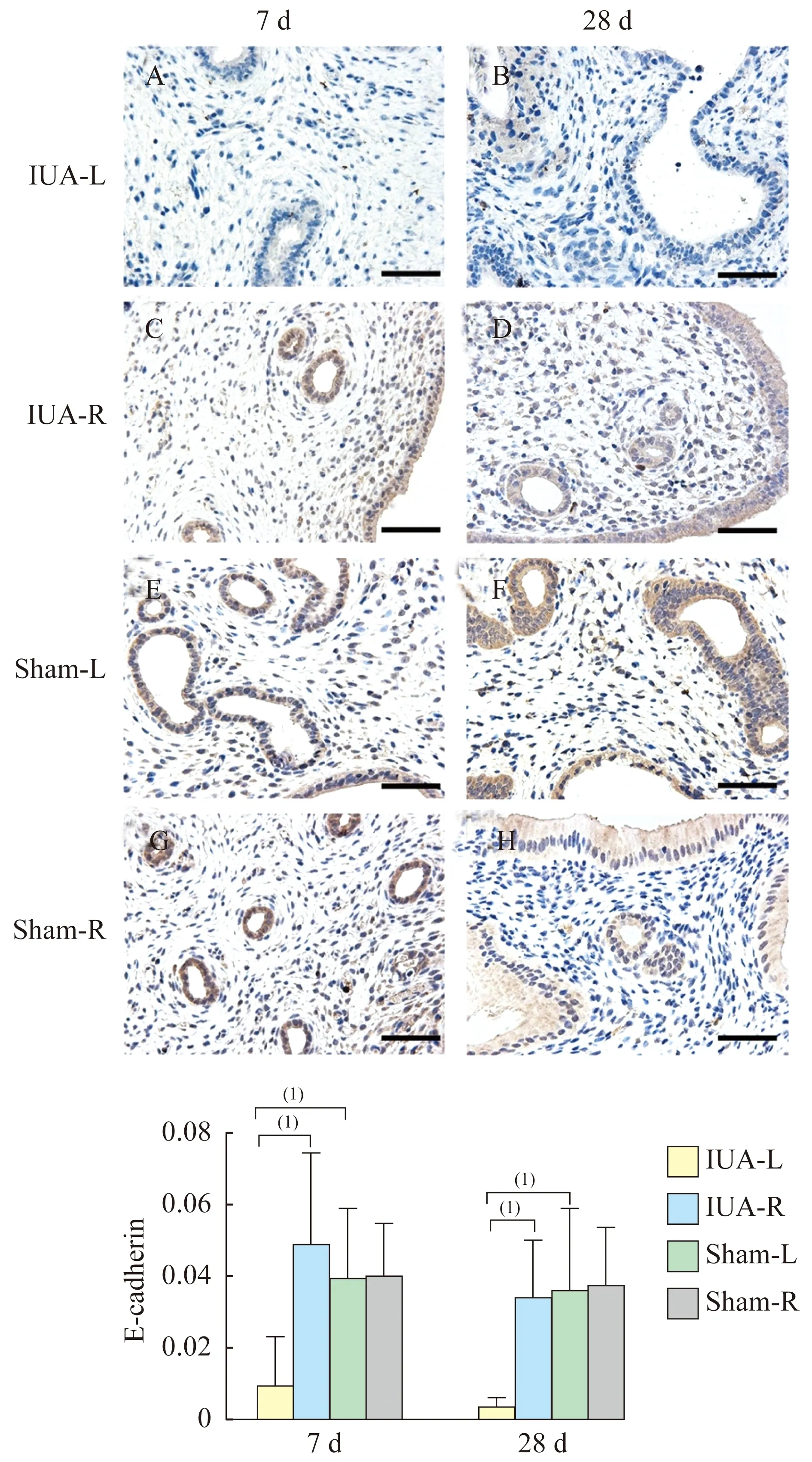
(1)P<0.001.
图4 免疫组化检测IUA-L组、IUA-R组、Sham-L组及Sham-R组子宫7天与28天时E-cadherin表达(×400)
Fig 4 E-cadherin of IUA-L,IUA-R,Sham-L andSham-R on day 7 and day 28 by IHC (×400)
根据文献报道,虽然有些学者选择LPS、苯酚胶浆或电热损伤等方式建立IUA模型,但是本研究倾向于以切除全层子宫内膜的方式建立稳定的动物模型,因为此方法更加贴近临床上IUA的发病原因[10-11]。7天和28天的时间节点也提示本模型效果长期有效。本实验通过建立IUA组以及Sham组模型,以排除单纯切开缝合子宫对造模方式的影响,同时本实验应用了自身对照的方法。如果对大鼠子宫双侧子宫同时进行造模手术,术后双侧子宫粘连到一起的概率较高,不利于解剖取材及观察。因此本实验选择自身对照的方法,既节约了动物材料,又能较好地获得观察效果。

(1)P<0.01.
图5 免疫组化检测IUA-L组、IUA-R组、Sham-L组及Sham-R组子宫7天与28天时N-cadherin表达(×400)
Fig 5 N-cadherin of IUA-L,IUA-R,Sham-L andSham-R on day 7 and day 28 by IHC (×400)
EMT过程中上皮细胞失去细胞黏附性,同时获得更多的间质细胞特性,原本整齐排列的上皮细胞在遭受外界强烈的炎症刺激后表现出更多的侵袭迁移特性[12]。上皮指标E-cadherin表达下降,细胞逐渐趋于长梭形,细胞间缝隙连接变得稀疏,间质指标N-cadherin表达开始出现[13]。本研究发现,E-cadherin和N-cadherin在病变的内膜上皮细胞中表达改变。同样,荧光图片中Vimentin出现于腺体上皮细胞中,更是直观又强有力地证明了EMT。本研究首次系统地在动物模型中介绍EMT与IUA内膜纤维化发病机制的关系,即IUA内膜纤维化发生后,可以确切观察到上皮细胞逐渐产生间质细胞的特性。通过对E-cadherin、N-cadherin和Vimentin这3个重要的上皮间质指标的观察,本研究说明EMT在IUA内膜纤维化的发生中发挥了至关重要的作用。近年来发现,不论是在正常月经内膜脱落后再生,还是在妇科疾病子宫内膜异位症和子宫腺肌病的发病机制中,EMT均发挥了重要作用,学者们也逐渐认为子宫内膜上皮细胞特性改变,获得越来越多的间质特性,从而获得运动能力,侵入肌层或侵袭迁移至周边组织器官,进而导致内异症或腺肌症的发生[14-15]。内异症、腺肌症和IUA的共通之处在于组织病理学均表现为内膜组织的纤维化,越来越多的研究证实EMT在内异症和腺肌症的内膜纤维化中存在,结合本研究结果,我们预测EMT与IUA纤维化发生密切相关。但是本研究无法阐明EMT与纤维化的因果关系。

White arrow points at epithelial cells obtained with Vimentin.
图6 免疫荧光法检测IUA-L组、IUA-R组、Sham-L组及Sham-R 组子宫7天与28天时Vimentin表达(×500)
Fig 6 Vimentin of IUA-L,IUA-R,Sham-L and Sham-R on day 7 and day 28 by immunofluorescence (×500)

(1)P<0.01.
图7 免疫组化检测IUA-L组、IUA-R组、Sham-L组及Sham-R组子宫7天与28天TGF-β1表达(×400)
Fig 7 TGF-β1 of IUA-L,IUA-R,Sham-L and Sham-Ron day 7 and day 28 by IHC (×400)
TGF-β1是一个重要的促炎分子,不论是在动物模型还是人体内膜标本中,TGF-β1的表达均明显升高[16-19]。本研究提示TGF-β1与E-cadherin的表达相关,这一现象揭示炎症反应与EMT的联系,即TGF-β1可能诱导上皮细胞性状的改变,推动内膜以EMT的方式向纤维化发展。Smad通路是TGF-β1下游经典的通路蛋白,这又提示TGF-β1/Smad通路极有可能以EMT的方式改变内膜上皮细胞特性,使内膜上皮细胞向基质细胞或成纤维细胞和肌成纤维细胞分化,经Smad信号通路调控其向纤维化发展[20]。
本研究通过建立大鼠IUA模型,说明IUA的发生过程中存在EMT现象。许多研究一直在探讨IUA的干细胞治疗策略,以期为临床宫腔粘连松解术后提供辅助治疗,尤其是为了降低重度IUA的复发率[21-22]。了解IUA的发病机制能够为其治疗带来更多新思路和治疗参考价值。

