心脏骤停(CA)的SD大鼠复苏后CD4+T细胞功能的改变
幸春林 朱雪梅 张晓磊 陈 扬 陆国平
(复旦大学附属儿科医院重症医学科 上海 201102)
随着心肺复苏(cardiopulmonary resuscitation,CPR)指南进步,心脏骤停(cardiac arrest,CA)患者自主循环恢复(return of spontaneous circulation,ROSC)率较高,但住院患者最终存活出院率仍不理想[1-2]。CA、CPR时机体经历急性的强烈的非感染应激反应过程,全身各系统都发生剧烈改变,其中包括免疫系统。研究显示CA患者ROSC后出现全身炎症反应,存在类似于脓毒症免疫功能紊乱的表现:(1)CPR后单核细胞HLA-DR的表达减少,且与降低的CD4+T细胞有相关性,死亡患者表达降低更明显,存活患者的表达有恢复趋势,且低体温治疗不能改变HLA-DR的表达状态[3]。(2)CA患者的白细胞分泌细胞因子功能受损,且可能与CPR后第1天体内细胞损伤后持续释放的危险相关模式分子有关[4-5]。(3)CA后24 h时T细胞比例降低,Th1/Th2失衡[6-7]。小鼠CPR模型复苏3 h内脑组织中就有大量T细胞浸润,并介导CPR后缺血性的神经损伤[8]。因此免疫功能紊乱是CA患者ROSC后重要表现之一。
免疫系统包括细胞免疫及体液免疫,其中T细胞是细胞免疫中最重要的细胞,T细胞数量减少或功能降低是重症患者出现继发感染、预后不良的重要指标[9-10],通过调节T细胞功能可提高脓毒症患者的生存率[11-12]。但目前关于CPR后CD4+T细胞分泌的炎症因子变化及表面共刺激及共抑制分子的改变研究较少,因此,本研究通过建立SD大鼠CA模型,研究外周血中促炎因子肿瘤坏死因子α(tumor necrosis factor,TNF-α)、白介素6(interleukin 6,IL-6)、干扰素γ(Interferon γ,IFN-γ)和抗炎因子IL-4、IL-10的变化,CD4+T细胞数量及其表面分子PD-1、CD28、CTLA-4的表达情况,为进一步研究CA后免疫改变机制和可能的治疗干预方式提供参考。
材料和方法
实验动物300~410 g清洁级SD大鼠,雌雄不限(上海杰思捷实验动物有限公司,许可证号:SCXK(沪)2013-0006),本动物实验研究得到复旦大学附属儿科医院伦理委员会的批准。
试剂及设备流式试剂:Anti-Rat CD3 Per-eFluor 710、Anti-Rat CD8a PE-Cy7、Anti-Human CD279(PD-1) APC、Anti-Rat CD152(CTLA-4) PE、Anti-Rat CD28 FITC(美国eBioscience公司)、V450 Mouse Anti-Rat CD4 (美国BD公司),ELISA 试剂盒:TNF-α、IFN-γ、IL-4、IL-10、IL-6(杭州联科生物公司);小动物呼吸机(型号:ALC-V8D,上海奥尔科特生物科技有限公司),心电监护仪(型号:MP40,荷兰PHILIPS公司);流式细胞仪(型号FACSCantoⅡ,美国BD公司);多功能酶标仪(美国Bio Tek公司)。
动物分组将SD大鼠随机分为心脏骤停(CA)组和假手术(sham-operated,SO)组,每组24只,每组再按3、24、72 h 3个时间点分为3个亚组,每个亚组8只。CA组建立CA模型,SO组仅行气管插管和动静脉置管。分别于建模或操作后3、24、72 h行心脏采血。
动物模型建立参照文献[13]建立CA模型。所有大鼠造模前禁食12 h,不禁水。实验前用10%水合氯醛4 mL/kg腹腔内注射麻醉,行气管切开插管,股动静脉置管及动脉血压监测、心电监护,稳定10 min。在大鼠呼气末时堵住气管导管,窒息6 min后开始CPR,松开气管导管,机械通气,参数设置为呼吸频率80 次/min,吸呼比为1∶1.5,潮气量6~10 mL/kg,氧气浓度100%。同时开始胸部按压,频率约180 次/min,按压深度为胸骨前后径的1/3,按压10 s后股静脉注射肾上腺素(0.02 mg/kg),持续按压2 min后评估1次,若出现ROSC,则停止按压,未恢复则继续按压。每3~5 min静脉注射肾上腺素(0.02 mg/kg),若10 min之后还未达到ROSC标准,则放弃抢救,判为复苏失败,复苏失败大鼠不纳入实验。ROSC后予补液,3 h组于3 h后直接取血,24 h和72 h组于建模3 h后撤离呼吸机,拔除气管导管及动静脉置管,缝合伤口,放置于笼内,予氧气吸入,正常饮食及饮水,于24 h和72 h时取血,如未到实验时间动物死亡,死亡动物不纳入研究。
CA模型成功标准心率呼吸下降,平均动脉压降至20 mmHg (1 mgHg=0.133 kPa,下同),认为建模成功。
ROSC标准大鼠出现自主心率,MAP≥60 mmHg且持续10 min以上,心律恢复为窦性心律,认为达到ROSC。
外周血中T细胞表面分子表达取3个流式管(抗体管A,同型对照管B,空白对照管C),每管加100 μL 肝素抗凝血,A管按说明书剂量加入CD3、CD4、CD8、PD-1、CTLA-4、CD28共6种抗体同时标记,B管加PE-Cy7、APC、FITC、PE标记的同型对照、Per-eFluor 710标记的CD3抗体、V450标记的CD4抗体各5 μL,混匀,C管不加任何抗体,A、B管均避光孵育25 min。每管加2 mL溶血素,混匀,37 ℃放置10 min以溶解红细胞。500×g离心10 min,弃上清液。每管加2 mL FBS,混匀,500×g离心5 min,弃上清液。每管加250 μL PBS,重悬细胞。2 h内上机检测。采用FlowJo软件分析结果,根据前向散射光(forward scatter,FSC)和侧向散射光(side scatter,SSC)信号选定淋巴细胞群,分析其中CD3+(即T细胞)的比例,CD4+T细胞设门为CD3+CD4+CD8-,CD8+T细胞设门为CD3+CD8+CD4-,并分别分析CD4+T细胞表面CD28、CTLA-4、PD-1的表达(图1)。
ELISA检测运用ELISA法检测大鼠血清中TNF-α、IL-6、IL-10、IFN-γ、IL-4的浓度。按照联科生物公司试剂盒的Protocol操作,多功能酶标仪在450 nm处检测吸光度值(D)。
结 果
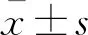
各组基线特征与生理学参数各组大鼠性别、体重差异无统计学意义,各组大鼠的基线特征:呼吸、心率、平均动脉压差异无统计学意义(P> 0.05,表1)。诱导CA时间为(226±28) s,非干涉时间为(136±26) s,CPR时间为(168±115) s。实验各组基线特征可比,组间个体差异较小。
促炎因子水平CA组血清中TNF-α的浓度在3 h和24 h时均高于SO组,但差异无统计学意义(P>0.05)。IL-6在CA后3 h时最高,在3 h (P=0.001)和24 h(P=0.005)均显著高于SO组,差异有统计学意义,到72 h后IL-6降低至与SO组无统计学差异。IFN-γ的浓度3 h时较SO组高,在24 h和72 h时降低,显著低于SO组(P<0.001,P=0.018,图2)。
抗炎因子水平CA组血清中IL-10的变化与IL-6一样,在CA后3 h时最高,在3 h(P=0.015)和24 h(P<0.001)均显著高于SO组,差异有统计学意义,到72 h后IL-6降低至与SO组无统计学差异。而IL-4在3个时间点(3、24、72 h)均显著高于SO组(P=0.002,P=0.028,P=0.021,图3)。
T细胞数量及表面分子表达CA组的T细胞在ROSC后3 h已经开始降低,到24 h和72 h时显著低于SO组,差异具有统计学意义(P=0.009,P=0.034,表2)。CA后3 h、24 h和72 h时3组T细胞CD4和CD8亚群比例均无显著改变。在本实验中,与SO组相比,CA组CD4+T细胞表面共刺激因子CD28及共抑制因子CTLA-4、PD-1在CA后24 h时均处于较高表达状态,差异具有统计学意义(P=0.037,P=0.003,P<0.001,图4)。

(1)P<0.05,(2)P<0.001.
图2 CA组和SO组大鼠在3个时间点TNF-α、IL-6、IFN-γ的含量变化
Fig 2 Levels of TNF-α,IL-6 and IFN-γ in rats between CA group and SO group at three time points
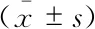
表1 SO组和CA组大鼠基线特征与生理学参数Tab 1 Baseline values and physiological parameters in rats of SO group and CA group
MAP:Mean arterial pressure.

(1)P<0.05,(2)P<0.01,(3)P<0.001.
图3 CA组和SO组大鼠在3个时间点IL-10和IL-4的含量变化
Fig 3 Levels of the IL-10 and IL-4 in rats of CA group and SO group at three time points
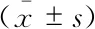
表2 SO组和CA组大鼠T细胞及T细胞亚群比例比较Tab 2 Comparison of T cells and subsets in rats of SO group and CA group

(1)P<0.05,(2)P<0.01,(3)P<0.001.
图4 CA组和SO组在3个时间点CD28、CTLA-4、PD-1的表达
Fig 4 The percentage of PD-1,CTLA-4 and CD28 expressed on CD4+T cells of CA group and SO group at three time points
讨 论
在动物研究中发现,窒息后立即发生高碳酸血症和低氧血症,伴短暂的心动过速、血压升高和全身血管阻力增加,5 min后进展为心动过缓和低血压、低心输出量、肺高压、组织缺氧、乳酸酸中毒、持续加重最后导致CA,ROSC后虽然血液动力学、呼吸和全身代谢参数恢复,但是组织尤其是内脏器官缺氧持续存在[14]。CPR过程存在急性炎症反应,不仅释放致炎细胞因子(如IL-1、TNFα、IL-6等)引起类似于脓毒症的全身炎症反应综合征,同时释放大量的炎症抑制因子(如IL-4、IL-10、IL-1Ra等)[5,15],这些细胞因子相互作用,同时参与机体的免疫应答和免疫调节。本研究中的细胞因子均可由CD4+T细胞分泌,CD4+T细胞通过分泌细胞因子参与炎症反应[16]。CA后3 h抗炎因子和促炎因子均升高,在72 h时促炎因子IL-6、TNFα与对照组无差别,IFN-γ甚至低于对照组,而抗炎因子IL-4仍高于对照组,提示在CA最初抗炎反应和促炎反应同时存在,3天后促炎反应减少,抗炎反应仍然存在。
在创伤患者中最初4天淋巴细胞持续低水平与死亡率和住院天数的增加有关,淋巴细胞数量不能恢复者预后差,提示淋巴细胞在创伤后的改变对预后很重要[17]。T淋巴细胞是淋巴细胞中最主要的细胞,Gouel等[18]对创伤患者的研究也证实,CD4+T细胞数量降低的患者更易继发感染。陈永斌等[19]发现细胞免疫功能水平与危重症患者病情的严重程度有关,可以作为评估危重症患者病情的检测指标。本研究发现CA组CD3+T细胞比例在24 h和72 h时显著低于SO组,有可能与CA后导致T细胞凋亡有关,与Gu等[6]研究结果一致。
T细胞的活化需要双重信号的刺激,其中表达于T细胞表面的CD28作为共刺激因子最为重要,外周血几乎所有CD4+T细胞和50%CD8+T细胞表达CD28,T细胞活化后CD28表达水平升高,B细胞和抗原提呈细胞表面的B7家族分子是其配体[20]。本研究证实CD28持续表达于CD4+T细胞表面,在CA 24 h后CD28表达显著升高,表明在CA 24 h后CD4+T细胞活化明显,活化功能正常。
CTLA-4主要表达于活化的T细胞表面,与CD28具有高度同源性,但与B7亲和力更强,可竞争性抑制CD28与B7结合,有效限制T细胞活化与增殖反应,应用CTLA-4/Ig融合蛋白竞争性抑制CD28与B7结合,可发挥强的免疫作用,并已用于临床治疗[21]。在脓毒症的动物模型中发现CTLA-4表达升高,阻断CTLA-4通路能提高生存率[22]。本研究中CA组CTLA-4表达在24 h后较SO组显著升高,与在脓毒症研究中的改变一致,表明CA后负性调控的表达先于活化受体的表达,且持续较高,T细胞处于受抑制调控状态。
PD-1是T细胞表面标志物之一,主要表达于活化的T细胞表面,与配体PD-L1和PD-L2结合后可抑制T细胞增殖和产生IL-10、IFN-γ等,在免疫起始和效应阶段均可发挥负调节作用,在小鼠脓毒症模型中,PD-1在T细胞表面的表达率上调,阻断PD-1的信号转导可提高大鼠对致病微生物的清除率,提高脓毒症大鼠的生存率[23]。本研究中PD-1的表达在CA组 3 h时开始升高,在24 h时较SO组比较差异有统计学意义,且至第3天时仍处于高表达状态,说明在CA后T细胞表面的负性调节分子表达升高,且持续处于高表达状态,表明T细胞功能处于持续受抑制调控的状态,这样的高表达状态是否与脓毒症一样会造成T细胞的严重耗竭[24],以及对预后的影响有待于进一步研究。
总之,本实验通过建立SD大鼠窒息致CA模型,研究了CD4+T细胞分泌的炎症因子变化及表面共刺激及共抑制分子表达。证实了CA后最初3 h和24 h促炎反应和抗炎反应同时存在,72 h后抗炎反应为主。 CD4+T细胞在CA 24 h时共抑制因子表达升高,处于受抑制调控状态。

