含肉桂醛猪肉糜中金黄色葡萄球菌热失活模型的建立
卢杨柳 马静一 艾志录 ,, 谢新华 王 娜 黄忠民 索 标 ,,*
(1河南农业大学食品科学技术学院 国家速冻米面制品加工技术研发专业中心 郑州450002
2农业农村部大宗粮食加工重点实验室 郑州450002
3速冻面米及调制食品河南省工程实验室 郑州 450002)
由食源性致病菌引起的食品安全事件屡屡暴发,严重危害到人们的身体健康和食品产业的发展[1]。肉糜作为多种加工食品中的重要原材料,由于接触表面积较大,容易被食源性致病菌污染。为了防止食源性致病菌造成的巨大经济损失,保障人们的食用安全,在食品中添加抑菌剂仍是目前食品工业界的重要手段之一[2]。肉桂醛是一种源于食品肉桂的植物源天然广谱抑菌剂,近年来的研究表明,肉桂醛对沙门氏菌[3]等细菌和轮状镰刀霉菌[4]等真菌都有很强的抑制效果。肉桂醛等植物源天然产物作为食品级天然抑菌剂在食品工业中具有广阔的应用前景。
目前,有关肉桂醛对食源性致病菌的抑制效果及机理的研究已有报道,如Di Pasqua等[5]研究表明,肉桂醛使大肠杆菌和沙门氏菌的细胞膜长链不饱和脂肪酸发生变化。对单核细胞增生李斯特菌的研究表明,肉桂醛可抑制细胞能量的产生,阻碍葡萄糖的利用和摄取,并对细胞膜的通透性具有破坏作用[6]。
在当前的肉制品加工业中,热处理方式仍是常用的杀菌手段[7],然而过度的热处理常造成食品营养和品质的破坏,同时也会产生一定的危害物[8]。近年来,随着预测微生物学和统计学的快速发展,采用建立微生物消长模型的方法,对食源性致病菌在加工条件下的失活规律进行拟合,对于在保障食品营养品质的同时,更加有效地杀除致病菌具有重要意义[9-11]。此外,在食品中添加一定量的天然抑菌活性成分,与热处理相结合,提高杀菌效率,从而在保证食品品质的前提下保障食品安全,减少能源的消耗,在食品工业中具有广阔的应用前景。然而,有关添加肉桂醛后对肉类食品中金黄色葡萄球菌的热杀菌作用规律及其机制的研究,国内外尚未有报道。
本试验中以猪肉糜为材料,添加不同浓度的肉桂醛,进行不同温度的热处理。随后将试验所得数据进行拟合,选择最优杀菌模型。通过扫描电镜对肉桂醛处理前、后的金黄色葡萄球菌细胞形态进行观察,探讨肉桂醛对金黄色葡萄球菌的抑菌机理。
1 材料与方法
1.1 菌株与菌悬液的制备
金黄色葡萄球菌ATCC6538来源于美国标准菌种收藏所,于-80℃甘油管保存。在无菌操作台上,将储存的金黄色葡萄球菌接种到含0.6%酵母浸粉的TSA平板上,37℃条件下培养24 h,挑取典型菌落至无菌的含0.6%酵母浸粉的TSB培养基中,37℃,150 r/min摇床上培养至指数后期(约108~109CFU/mL)。将培养好的菌液转移至无菌离心管中,5 000×g离心10 min,弃去上清液,重复上述步骤,得到约109CFU/mL的菌液备用。
1.2 培养基、试剂与设备
胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)、酵母浸粉(YE)、Baird-Parker基础培养基、亚碲酸钾卵黄增菌液,北京路桥技术有限责任公司;氯化钠(分析纯),天津市德恩化学试剂有限公司。使用时均按使用说明配制。肉桂醛(≥98%,化学纯),天津市光复精细化工研究所。猪肉糜购自当地超市。
SX-500高压蒸汽灭菌锅,日本Tomy公司;JJ-CJ-2F洁净工作台,吴江市净化设备总厂;SHZ-82A水浴恒温振荡器、XH-T漩涡混合器,金坛市医疗仪器厂;THA-100恒温培养摇床,上海一恒科技仪器有限公司;LHP-250智能恒温恒湿培养箱,上海鸿都电子科技有限公司;TGL-16G高速台式离心机,上海安亭科学仪器厂;0.01~1 000 mL移液器,德国Eppendorf公司;S-3400N-Ⅱ扫描电子显微镜,日本日立公司;1stOpt 5.0软件,七维高科有限公司。
1.3 添加肉桂醛的肉糜样品的处理
肉糜购自当地超市并保存在-18℃冰箱中,使用前,将肉糜置于4℃条件下过夜解冻后,称取3 g的样品放入无菌自封袋中,加入肉桂醛使其终浓度分别为0,0.1%,0.5%,1.0%,与0.1 mL的菌液混合均匀后将肉碾成1~2 mm的薄片状,并尽可能地排除袋内的空气以防止产生气泡,以此来保证热传递均匀,随后封口待用。
1.4 热处理
将准备好的样品放置在预热的恒温水浴锅中进行热处理,水浴锅的设定温度分别为60,65,70,75℃,经预定的时间处理后,立即放入冰水中冷却。
1.5 菌落计数
将处理后的样品在洁净无菌的环境条件下,加入3 mL的盐水(0.85%),在均质器中拍打2 min,使之与样品混合均匀。用0.85%的盐水连续稀释后,取1 mL菌液涂布于加有亚碲酸钾卵黄增菌液的Baird-Parker选择性固体培养基上,在37℃条件下培养48 h后计数。
1.6 扫描电子显微镜观察
取1 mL的对照组(未添加肉桂醛)和处理(加0.05%和0.1%肉桂醛处理24 h)的菌液离心(4 000 r/min),弃上清,用 PBS(pH 7.2~7.4)缓冲液清洗 3次,加入2.5%的戊二醛(用PBS缓冲液配制)固定4 h后,用PBS缓冲液清洗2次,再用无菌纯水清洗2次,随后分别用30%,50%,70%,80%,90%,100%的乙醇依次梯度脱水,加50 μL的无水乙醇混合均匀后,将悬浮液滴在铝箔纸上,自然风干,喷金后进行扫描电镜观察[12-13]。
1.7 统计分析与曲线拟合
每组试验平行3组,取平均值,标准差由Microsoft Excel 2013中的STDEV计算得出,数据分析通过Origin 9.0软件得出。初级模型曲线拟合用 Curve Expert 1.4 拟合(https://www.curveexpert.net/),该软件包含60种模型[14],选择出最适合的模型来拟合曲线。本试验拟合结果得出4个较为合适的模型,分别为:
线性模型:

二次拟合:

指数拟合

多项式拟合:

y——时间为x的菌落数的对数值(lg CFU/g);x——时间(min);a,b,c——模型参数。
以初级模型的参数为基础建立二级模型,二级模型由1stOpt 5.0软件拟合得出。
二级模型拟合公式为:

y——t7.0的自然对数;t7.0--杀死7 lg CFU/g所需要的时间;x1--肉桂醛含量(%);x2——处理温度(℃);a,b,c——模型参数。
2 结果与分析
2.1 肉桂醛添加的猪肉糜中金黄色葡萄球菌的热失活模型拟合
2.1.1 初级模型 为了研究肉桂醛对热处理猪肉糜中金黄色葡萄球菌的协同抑制效果,本试验采用了60,65,70,75℃等4个温度梯度分别处理添加不同浓度肉桂醛的猪肉糜,并将16组试验所得数据的平均值用CurveExpert软件进行拟合,从而通过对比选择出最优模型。表1中列出的4个模型(分别是线性、二次拟合、指数拟合和多项式拟合模型)是在60种模型中选择出的最为合适的4个模型,每组试验数据的拟合相关系数都大于0.9。将这4种模型进行比较可以得出,多项式拟合的相关系数更高,全部在0.98以上。故本试验选择多项式拟合作为初级模型来描述肉桂醛对猪肉糜中金黄色葡萄球菌的热失活促进作用。
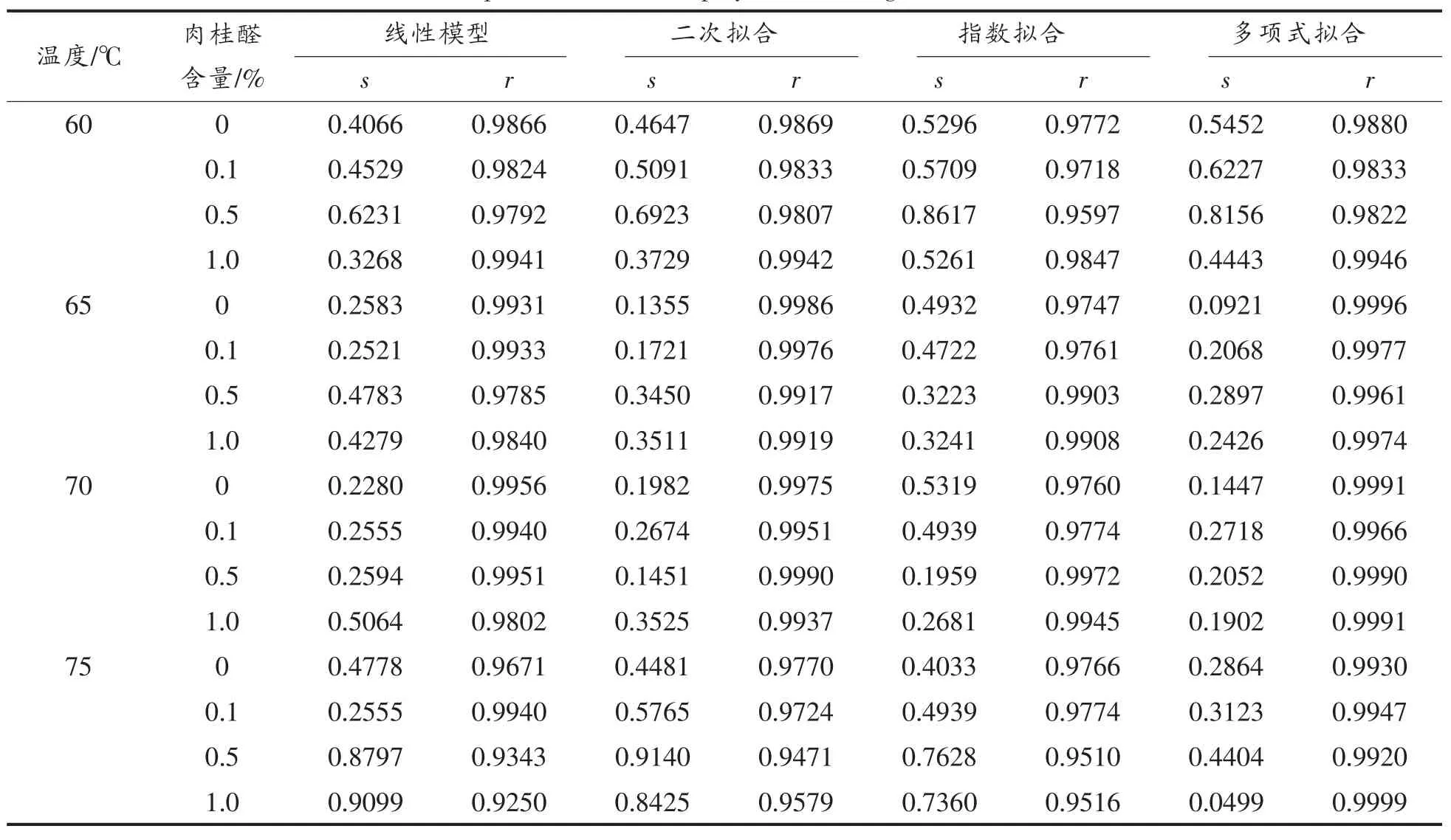
表1 线性模型、二次拟合、指数拟合和多项式拟合的标准误差(s)和相关系数(r)统计分析Table 1 Statistical parameter,standard error(s)and relation index(r)from the individually linear,quadratic fit,exponential fit,and polynomial fitting models
将16组试验数据进行多项式拟合结果如图1所示,随着处理温度的升高,拟合曲线从平滑到逐渐出现肩形,在70℃时,添加有1.0%肉桂醛试验组的拟合曲线隐约出现一个肩,当温度为75℃时,每组处理都有一个肩,随着肉桂醛浓度的增加,肩出现的时间也逐渐缩短。模型拟合时出现肩和尾的形状,在许多前人研究中均有报道[15],Juneja等[16]拟合家禽肉中沙门氏菌的非线性生长曲线时,62.5℃和65℃条件下出现肩形拟合曲线。肩形的出现说明金黄色葡萄球菌对热处理有一定的抵抗能力,肩形越来越窄,说明肉桂醛的添加降低了金黄色葡萄球菌的热抵抗能力。
在不同温度条件下,与不添加肉桂醛的样品相比,肉桂醛对肉糜中金黄色葡萄球菌的抑制效果随着温度的升高而逐渐增加。当热处理温度为60℃时,添加肉桂醛的样品在0~5 min之间与不添加肉桂醛的对照样品相比没有明显区别(P>0.05)。随后,随着肉桂醛浓度的升高,抑菌效果逐渐增强,处理时间为20 min时,添加0.5%和1.0%肉桂醛的样品比未添加肉桂醛样品的菌落值低1 lg CFU/g左右。65℃时,在加热初期添加肉桂醛的样品和未添加肉桂醛的样品没有明显区别(P>0.05),2 min以后差距逐渐增大,添加0.5%和1.0%肉桂醛的样品比未添加肉桂醛样品的菌落值低1 lg CFU/g左右,当处理时间达到10 min以后,差距逐渐减小,15 min时已无太大差距。当猪肉糜样品在70℃下处理2 min时,添加1.0%肉桂醛的样品比不添加肉桂醛样品的菌落值低约2 lg CFU/g。当采用75℃的热处理温度时,添加1.0%肉桂醛的猪肉糜样品在3 min后即无金黄色葡萄球菌检出。由此得出,肉桂醛对猪肉糜中金黄色葡萄球菌的热杀菌效果具有明显的促进作用,随着热处理温度的升高,肉桂醛的促进作用愈加明显,而且随着肉桂醛浓度的增大,金黄色葡萄球菌的失活速率更大。

图1 多项式拟合肉桂醛对肉糜中金黄色葡萄球菌的热失活规律Fig.1 Survival curves of S.aureus in ground pork for the different combinations of cinnamaldehyde concentrations for a temperature range from 60 to 70℃,as modeled by regression for polynomial fitting models
2.1.2 二级模型 将Ln t7.0与处理温度和肉桂醛浓度以及初级模型的4个公式代入1stOpt软件中,进行二级模型拟合,并得出公式中的参数值以及拟合系数(R2)。将R2作为模型的选择标准,R2越接近1说明模型拟合效果越好。将拟合结果进行比较,选择出较优的一个模型作为二级模型。如表2所示,线性回归模型拟合效果较好,拟合系数(R2)为 0.9310,说明初级模型参数 Ln t7.0与处理温度和肉桂醛浓度呈较好的线性关系。故线性模型更适合作为二级模型用来描述处理温度和肉桂醛浓度对初级模型得到的参数Ln t7.0的影响。将初级模型得到的参数Ln t7.0与处理温度、肉桂醛浓度以及公式(5)在1stOpt软件中进行拟合,得出公式(5)中参数 a,b,c 的值,代入公式(5)可得出二级拟合模型的公式为:
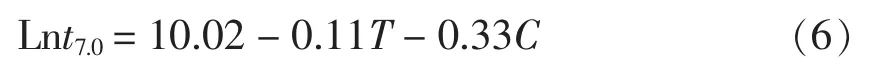
Ln t7.0——t7.0的自然对数;t7.0——杀死7 lg CFU/g所需要的时间;C——肉桂醛的含量(%);T——温度(℃)。其中10.02即为公式(5)中的a,-0.11 为公式(5)中的 b,-0.33 为公式(5)中的 c。

表2 二级模型拟合结果比较Table 2 Comparison of regressed secondary models
根据二级模型拟合结果,本研究得出Ln t7.0和肉桂醛的浓度及处理温度的线性关系图(图2)。图2a显示出,随着处理温度的上升,Ln t7.0逐渐下降,75℃时,Ln t7.0的值达到最低。从图2b中可以看出,不同温度条件下,肉桂醛浓度对Ln t7.0值的影响随着温度的上升而逐渐增大,温度为75℃时,肉桂醛的添加对Ln t7.0值的影响最为明显,这与图2a的结果一致。因此,该二级模型可根据猪肉糜中肉桂醛的添加浓度和处理温度,估算出达到特定杀菌效果所需要的时间。
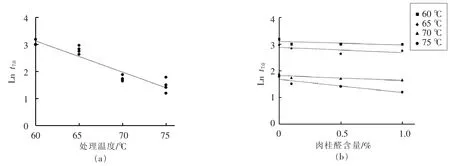
图2 Ln t7.0和肉桂醛浓度及处理温度的线性关系曲线Fig.2 The linear relationship curves between Ln t7.0and the cinnamaldehyde content and treatment temperature
2.2 不同浓度肉桂醛处理后金黄色葡萄球菌形态变化的扫描电镜分析
肉桂醛处理前后金黄色葡萄球菌菌体形态变化如图3所示,未经过肉桂醛处理的金黄色葡萄球菌(图3a)菌体饱满,呈较规则的球状;经过0.05%肉桂醛处理后(图3b)的菌体个别细胞出现破洞,细胞内液体外漏,细胞形状大小不一;经过0.1%肉桂醛处理(图3c)的菌体大部分都出现漏洞,甚至菌体破碎,细胞严重破损,这也与前人的研究结果相一致[17]。已知温和热处理条件下,细胞膜的破损是食源性致病菌失活的主要原因[18]。因此,本研究得出肉桂醛加快金黄色葡萄球菌热失活的可能原因是,在热处理条件下肉桂醛促进了金黄色葡萄球菌细胞膜的热损伤,加快细胞质泄露,从而加速细胞失活。
3 结论
本文将植物源天然抑菌剂与传统的热杀菌方法相结合,研究了猪肉糜中金黄色球菌的热失活规律。本研究结果表明,在75℃时,添加1.0%肉桂醛对金黄色葡萄球菌的热抵抗能力影响较大,显著减少了热杀菌所需的时间。对试验数据进行了模型拟合,得出多项式拟合适合作为初级模型,而线性曲线较适合建立二级模型,以描述肉桂醛添加后肉糜中金黄色葡萄球菌热失活曲线。扫描电镜观察肉桂醛对金黄色葡萄球菌细胞形态的结果显示,肉桂醛可以使金黄色葡萄球菌的细胞膜遭到严重的破损,这可能是其促进金黄色葡萄球菌热失活的重要原因。本研究结果所建立的二级模型可根据猪肉糜中肉桂醛的添加浓度和处理温度,估算出达到特定杀菌效果所需要的时间,为以后肉桂醛在食品行业的应用,尤其是在热加工肉制品中的应用提供了依据。

图3 扫描电镜观察肉桂醛处理下金黄色葡萄球菌的菌体形态Fig.3 Scanning electron micrographs of S.aureus following treatments with and without cinnamaldehyde

