喹诺酮-唑杂合体在抗肿瘤领域的研究进展(一)
马西灿,冯连顺 编写 刘明亮,郭慧元 审校
(1 西南民族大学药学院,成都 610041;2 中国医学科学院北京协和医学院医药生物技术研究所,北京 100050)
1 前言
癌症,又称恶性肿瘤,是控制细胞生长增殖机制失常而引起的疾病。癌症可发生在人体的各个器官和组织包括血液,是仅次于心血管疾病的第二大致死性疾病。据世界卫生组织估计,每年约有1400万癌症新发病例,约900万人死于癌症相关疾病,占死亡总数的六分之一。癌症每年所造成的经济损失高达1.16万亿美元,给各国医疗系统带来了沉重的负担。肺癌、乳腺癌、直肠癌、前列腺癌、胃癌和皮肤癌是临床上最常见的癌症,而肺癌、直肠癌、胃癌、肝癌和乳腺癌则是最致命的癌症。抗癌药物对癌症的治疗不可或缺,但肿瘤细胞以对现有药物产生了耐药性。尽管多种具有全新结构的候选物正处于临床评价阶段,有望于不久的将来为人类健康服务,但数量仍不能满足患者的需求。因此,研发新型抗癌药物势在必行。
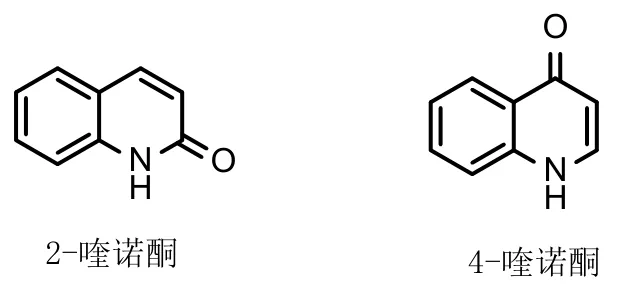
图1 2-喹诺酮和4-喹诺酮母核
喹诺酮可分为2-喹诺酮和4-喹诺酮(图1),广泛存在于自然界中。喹诺酮类化合物具有抗菌、抗结核、抗疟疾、抗人类免疫缺陷病毒、抗丙肝和抗肿瘤等多种生物活性,在新药研发领域举足轻重。上世纪80年代末,科学家发现喹诺酮对真核II型拓扑异构酶(拓扑异构酶II)具有潜在的抑制活性且对肿瘤细胞系显示出良好的活性,拉开了喹诺酮在抗肿瘤领域的研发序幕。研究发现,某些喹诺酮是潜在的微管蛋白聚合抑制剂,对多种类型的肿瘤细胞具有良好的选择性,极大的激发了科学家的研发热情。经过科学家的不懈努力,目前多个喹诺酮类化合物如 voreloxin、AT-3639和quarfloxin(图2)已用于临床治疗各种癌症或正处于临床评价阶段。
将两个或多个药效团嵌入到一个分子中的杂合体策略具有克服耐药性和增强生物活性等诸多优点,是当今药物化学领域研究的热点。多个喹诺酮杂合体如Ro 23-9424和MCB3837(图2)等目前正处于临床评价阶段,有望于不久的将来为人类健康服务。显然,将喹诺酮与其它具有抗肿瘤活性的药效团杂合是获得对药敏型和耐药型肿瘤均有效的新型抗癌药物的有效途径。
唑包括吡唑、咪唑、三氮唑、四氮唑、噁唑、噻唑、噁二唑和噻二唑等,具有多种生物活性,是一类极为重要的含氮杂环化合物。某些唑类化合物如来曲唑已在临床上用于癌症的治疗,故将喹诺酮与唑杂合可能会进一步提高此类化合物的抗肿瘤活性。
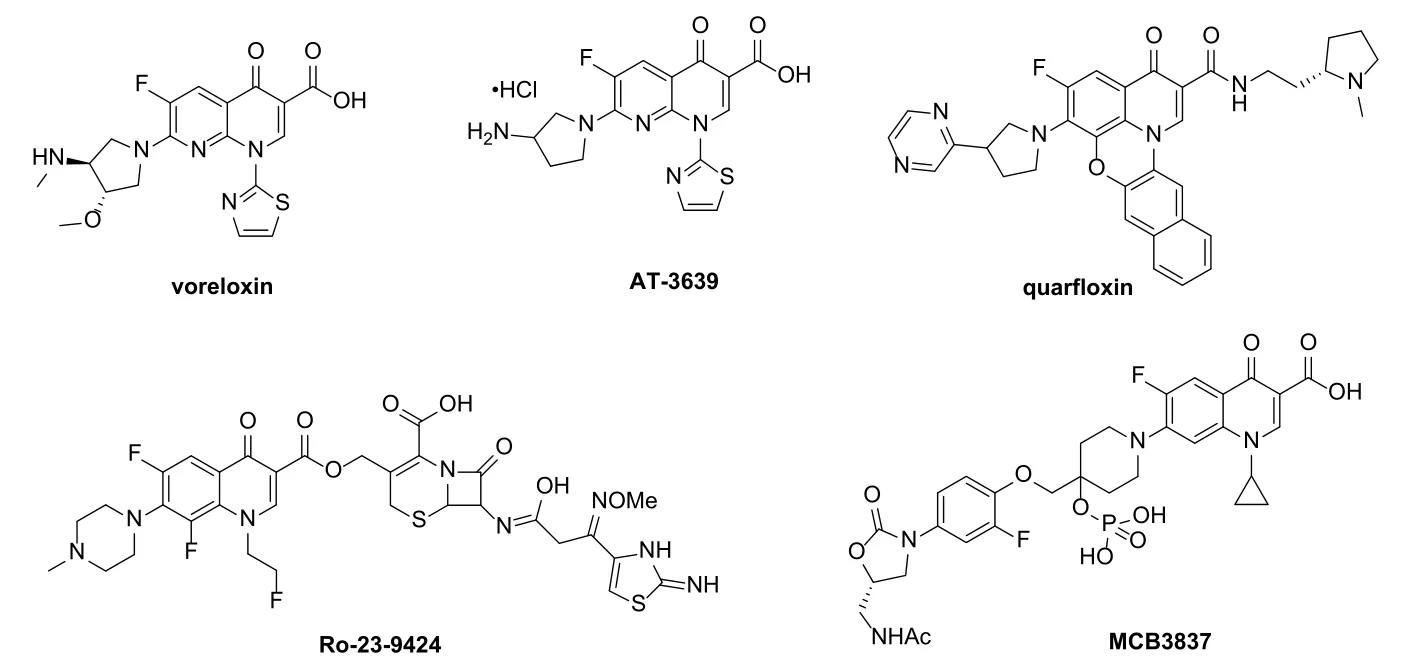
图2 voreloxin, AT-3639, quarf l oxin, Ro 23-9424和MCB3837的化学结构
近30年来,科学家设计合成并评价了多个系列喹诺酮-唑杂合体的抗肿瘤活性,其中的某些杂合体具有良好的体内外活性。本文将重点介绍近年来喹诺酮-唑杂合体在抗肿瘤领域的研究进展,并总结构-效关系(SAR),为更合理的设计此类杂合体提供理论基础。
2 喹诺酮-四氮唑/三氮唑杂合体
对环丙沙星-四氮唑杂合体1(图3)和吡哌酸-四氮唑杂合体2的体外抗SiHa、MDAMB-231和PANC-1肿瘤细胞系活性评价结果显示,除杂合体2g外,所有杂合体的50%生长抑制所需的药物浓度(GI50)为0.06~2 μmol/L。其中,5个杂合体对SiHa、11个杂合体对MDA-MB-231和1个杂合体对PANC-1肿瘤细胞系的活性优于对照药他莫昔芬(GI50: 0.24, 0.12和0.15 μmol/L)。SAR显示吡哌酸-四氮唑杂合体2的活性普遍优于环丙沙星-四氮唑杂合体1。四氮唑N-1位的取代基对抗肿瘤活性有显著影响,且苄基和(取代)苯基优于乙基。向苯基引入4-溴或2,3,4-三氟取代基对活性有利,而4-三氟甲基对活性不利。其中,4个杂合体1c、1d、2c和2f对SiHa和MDA-MD-231肿瘤细胞系具有良好的活性,GI50≤ 0.1 μmol/L,与他莫昔芬相当。而吡哌酸-四氮唑杂合体2d (GI50: 0.08, 0.22和0.07 μmol/L)对所测的SiHa、MDAMB-231和PANC-1肿瘤细胞系具有广谱活性,略优于他莫昔芬,值得进一步研究。
2-喹诺酮-四氮唑杂合体3在浓度为100 nmol/L时对MCF-7肿瘤细胞系具有优秀的抗迁移活性。在小鼠体内模型中,将杂合体3与阿霉素或依托泊苷联合给药时将提高阿霉素或依托泊苷的体内活性,提示杂合体3与阿霉素或依托泊苷具有协同作用。
左氧氟沙星-1,2,3-三氮唑杂合体4和5对A549、HepG2、MCF-7、PC-3和HeLa肿瘤细胞系的半抑制浓度(IC50)分别为7.8~16.5 μmol/L和0.3~12.8 μmol/L,远优于母药左氧氟沙星(IC50: 64.2~>100 μmol/L)。不仅如此,这类杂合体(IC50: >100 μmol/L)对健康MCF-10A细胞无毒,而对照药伏立诺他(IC50: 25.2 μmol/L)则显示出一定的毒性。SAR研究结果表明,含有羟肟酸结构片段的杂合体5的活性优于相应的羧酸衍生物4,这可部分归因于杂合体5可同时抑制组蛋白去乙酰化酶(IC50: 0.021~0.85 μmol/L)和微管蛋白聚合酶(IC50: 1.79~6.36 μmol/L)所致。酰胺(X = NH)杂合体的活性优于相应的酯(X = O),且7个碳(n = 6)的羟肟酸和羧酸结构单元优于6个碳 (n = 5)和8个碳(n = 7)。杂合体5e (IC50: 0.3~4.9 μmol/L)对所测所有肿瘤细胞系的活性均优于伏立诺他(IC50: 2.9~6.4 μmol/L),可作为先导物进一步优化。
SAR显示,向喹诺酮-1,2,3-三氮唑杂合体6 (IC50:13.10~88.37 μmol/L)的R1和R2位引入卤素如氟和氯可增强抗HepG2、HT29和HL60肿瘤细胞系活性,而向 R1和R2位引入甲基或向R2位引入硝基将会导致活性降低。其中,代表物6c (IC50: 13.61~66.03 μmol/L)和6e (IC50: 13.10~70.19 μmol/L)具有中等到优秀的抗HepG2、A549、Hela、HT29和HL60肿瘤细胞系活性,且对HepG2、HT29和HL60肿瘤细胞系的活性优于顺铂(IC50: 12.02, 21.03和43.34 μmol/L),可作为先导物进一步优化。
喹诺酮-1,2,3-三氮唑杂合体7 (IC50: >10 μmol/L)对A549、Hela、HCT-116和PANC1肿瘤细胞系的活性较弱,明显弱于对照药他莫昔芬。三氮唑并氟喹诺酮8对所测HT29、HCT116、SW620和SW480肿瘤细胞系的IC50为105.9~608.4 μmol/L,远逊于顺铂(IC50: 1.3~38.0 μmol/L)。
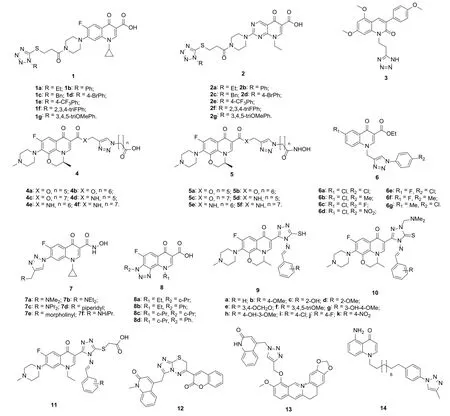
图3 喹诺酮-四氮唑杂合体1~3和喹诺酮-三氮唑杂合体4~14的化学结构
氧氟沙星-1,2,4-杂合体9 (IC50: 9.4~50.2 μmol/L)、氧氟沙星-1,2,4-三氮唑-5(4H)-硫酮杂合体10(IC50: 0.14~17.6 μmol/L)和培氟沙星-1,2,4-三氮唑杂合体11 (IC50: 5.8~63.4 μmol/L)对L1210、HL60和CHO肿瘤细胞系具有中等到良好的活性。SAR显示,1,2,4-三氮唑-5(4H)-硫酮杂合体10对所有所测肿瘤细胞系的活性高于相应的1,2,4-三氮唑杂合体9和11,提示硫酮结构片段的引入可改善活性。活性最高的杂合体10c对L1210、HL60和CHO肿瘤细胞系的MIC分别为6.8、0.14和1.7 μmol/L,值得进一步研究。
喹诺酮-1,2,4-三氮唑杂合体12 (IC50: 43.3和20.4 μg/mL)对PC3和DU-145肿瘤细胞系的活性远逊于对照药阿霉素(IC50: 0.4 μg/mL),而 2-喹诺酮-1,2,3-三氮唑杂合体13 (IC50: 75.55~181.48 μmol/L)具有弱到中等强度的抗MCF-7、MCF-7/ADR、SW-1990、SMMC-7721和HUVECs肿瘤细胞系活性,对SW-1990、SMMC-7721和HUVECs肿瘤细胞系的抑制活性弱于对照药小檗碱(IC50: 18.34~65.6 μmol/L)。
5-氨基喹诺酮-1,2,3-三氮唑杂合体14对KB、L1210、SW403、MCF7和OVCAR3肿瘤细胞系具有极为优秀的活性,半数中毒剂量(TD50)低至<1~89 ng/mL,对除SW403之外的肿瘤细胞系的活性是阿霉素(TD50: 14~98 ng/mL)的≥4.6倍。杂合体 14对正常人胚二倍体肺细胞WI38 (TD50: 7.45 μg/mL)的毒性较低,但对正常人胚二倍体肺细胞MRC5 (TD50: 33 ng/mL)的毒性较高。在小鼠淋巴肿瘤模型中,即使杂合体14的给药剂量10 mg/kg时仅可减轻13.1%的肿瘤质量,不具备进一步研究价值。
3 喹诺酮-苯并咪唑/苯并噁唑/苯并噻唑/咪唑杂合体
对31个氟喹诺酮-苯并咪唑/苯并噁唑/苯并噻唑杂合体15(图4)的体外抗KB、A2780和Bel7402肿瘤细胞系的活性评价结果表明,其中的12个杂合体15a-l对所测的3株肿瘤细胞的IC50低至亚微摩尔级。作者进一步测定了杂合体15a-l对12株人肿瘤细胞系(Hela、HT-29、AGS、MCF-7、MDA-MB-261、A549、HepG2、Hep3B、PC-3、U937、THP-1和K562)的抑制活性,发现杂合体15c-e (IC50: 0.2~8.2 μmol/L)对所测所有肿瘤细胞系均具有潜在的活性,但弱于喜树碱(IC50: 0.02~1.7 μmol/L)和托泊替康(IC50: 0.3~2.0 μmol/L)。代表物15e对所测肿瘤细胞系的IC50为0.2~5.5 μmol/L,可在浓度为5 μmol/L时长时间(14天)抑制HT-29人大肠腺癌细胞。杂合体15e对拓扑异构酶I具有良好的抑制活性,其可在细胞水平上抑制拓扑异构酶I蛋白表达。进一步研究发现,与杂合体15e所作用的拓扑异构酶I解离复合体DNA序列异于喜树碱。在注射HT-29移植瘤的裸鼠模型中,杂合体15e可分别抑制52% (75 mg/d/kg组)和65%(150 mg/d/kg组)肿瘤生长,且未发现小鼠死亡和体重的改变。极广的抗肿瘤谱、优秀的体内外抗肿瘤活性加之良好的安全性,使得杂合体15e极具进一步开发的潜力。
依诺沙星-苯并咪唑杂合体LZ-106 (16)在细胞水平和裸鼠模型中对非小细胞肺癌(NSCLC)均显示出极高的活性。作用机制研究结果表明,LZ-106可通过线粒体和内质网应激凋亡通路诱导NSCLC凋亡。进一步研究发现,LZ-106可显著的诱导活性氧过度生产和DNA损伤应答,而DNA损伤应答和凋亡可在活性氧清除剂N-乙酰半胱氨酸存在的条件下有所降低,提示活性氧依赖性的DNA损伤应答也是LZ-106诱导凋亡的作用机制之一。
蛋白激酶B α和核因子活化B细胞κ轻链增强子(NF-κB)在不同肿瘤细胞中往往被上调节,故二者均是抗肿瘤药物潜在的作用靶点。2-喹诺酮-苯并咪唑杂合体17对蛋白激酶B (α, β和γ)和NF-κB的抑制蛋白(α和β)具有潜在的抑制活性,IC50为1.64~44.46 μmol/L。SAR显示:1)向2-喹诺酮母核的N-1位引入甲基将导致活性的降低;2)R2位点可容忍氯、溴和甲基;3)向苯并噻唑的C-5位(R4)引入氟和溴可提高抗肿瘤活性,而甲基和二氟取代基对活性不利。杂合体17a (IC50: 1.90~6.49 μmol/L)不仅对蛋白激酶B (α, β和γ)和NF-κB的抑制蛋白(α和β)具有良好的抑制活性,对包括鞘氨醇激酶(1和2)、猫科肉瘤癌基因和极光激酶B在内的所有所测激酶均显示出优秀的抑制活性,IC50在微摩尔水平。进一步研究发现,杂合体17a 具有良好的血浆和微粒体代谢稳定性,且在裸鼠体内模型中该化合物(口服给药, 每周2次, 剂量为10和25 mg/kg)可显著地抑制体内肿瘤生长。
2-喹诺酮-苯并咪唑杂合体18对MCF-7、SKBR-3、MDA-MB-231和HCT116 肿瘤细胞系抑制活性极高,IC50为0.03831~0.1167 μmol/L,但对HepG2、HeLa、Wi38和HaCaT的活性较弱,IC50仅为34.87~>100 μmol/L。对2-喹诺酮-苯并咪唑杂合体19的SAR研究结果显示,苯并咪唑上的取代基(R1位)对活性有显著影响,且氯>溴>氟,而向2-喹诺酮母核C-6位引入甲基和甲氧基对活性不利。杂合体19a-g具有广谱抗肿瘤活性,对HepG2、SKOV-3、NCI-H460和BEL-7404肿瘤细胞系的IC50为8.45~30.36 μmol/L,优于5-氟尿嘧啶(IC50: 26.34~45.44 μmol/L)。代表物19b (IC50: 8.45~16.54 μmol/L)对所有所测肿瘤细胞系的活性是顺铂(IC50: 10.12~20.36 μmol/L)和5-氟尿嘧啶的~1.2和>2倍。所有杂合体(IC50: >100 μmol/L)对人正常肝细胞HL-7702 未显示出体外毒性,且在昆明小鼠体内模型中,杂合体19b和19g在给药剂量为50 mg/kg时未表现出明显的毒性,提示这类杂合体安全性良好。在NCI-460肿瘤小鼠体内模型中,杂合体19b在给药剂量为25 mg/kg和50 mg/kg时,体内NCI-460肿瘤细胞的增殖率(T/C)分别为40.6%和30.7%,弱于顺铂(给药剂量为2 mg/kg时T/C为29.9%)。杂合体19b在给药剂量为50 mg/kg时可抑制体内66.9%的肿瘤细胞生长,优于顺铂(63.2%)。杂合体19g在给药剂量为25 mg/kg和50 mg/kg时,体内NCI-460肿瘤细胞的T/C分别为48.8%和38.1%,对肿瘤细胞的抑制率分别为46.2%和55.1%。在BEL-7402肿瘤小鼠体内模型中, 杂合体19g在给药剂量为25 mg/kg和50 mg/kg时对肿瘤细胞均有明显的抑制作用,抑制率分别为41.2%和44.9%,优于5-氟尿嘧啶(给药剂量为25 mg/kg时的抑制率为34.5%)。作用机制研究结果显示,杂合体19b和19g可能通过调控凋亡蛋白表达水平、胞内钙离子释放和活性氧促使肿瘤细胞凋亡。在细胞的生命周期中,二者可阻滞G2/M期。值得一提的是,在小鼠体内模型中,小鼠的体重没有发生大的变化且未发生任何副作用。显然,杂合体19b和19g可作为候选物进一步开发。喹诺酮-咪唑杂合体如20也具有潜在的抗肿瘤活性,但弱于对照药。
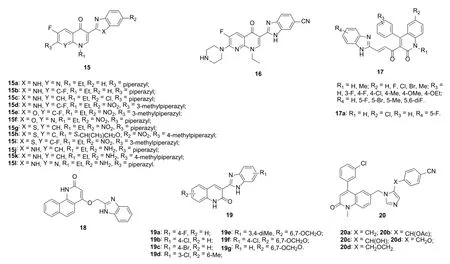
图4 喹诺酮-苯并咪唑、喹诺酮-苯并噁唑、喹诺酮-苯并噻唑和喹诺酮-咪唑杂合体15~20的化学结构
4 喹诺酮-噻唑/-吡唑/-噁唑杂合体和硒二唑并喹诺酮
几乎所有喹诺酮-噻唑-金刚烷杂合体21(图5)对所测所有肿瘤细胞系均无活性,而2-喹诺酮-苯并噁唑22a (IC50: 26.7和35.7 nmol/L)和2-喹诺酮-苯并噻唑22b (IC50: 74.8和61.6 nmol/L)对MCF-7和HCT-116肿瘤细胞均具有极高的活性,但弱于阿霉素(IC50: 8.4和8.8 nmol/L)。喹诺酮-噻唑杂合体23a,b、喹诺酮-苯并噻唑杂合体23c-e 和喹诺酮-吡唑杂合体23f,g对NCIH460、HCT116和U251肿瘤细胞系具有潜在的活性,IC50为0.6~16 μmol/L。SAR显示,苯并噻唑杂合体的活性优于相应的噻唑杂合体。向噻唑结构片段引入甲基可大幅提高活性(23a和23b的IC50分别为5~16和2.43~2.9 μmol/L),而苯并噻唑或吡唑引入氟或甲氧基则会导致活性降低。其中,杂合体23c(IC50: 0.6~1 μmol/L)的活性最高,优于伏立诺他(IC50:1~2 μmol/L)。喹诺酮-吡唑杂合体24 (IC50: 0.16~0.3 μmol/L)抗EAC肿瘤细胞活性优于5-氟尿嘧啶(IC50:0.54 μmol/L),但不含吡唑结构单元的衍生物活性更高,提示吡唑片段的引入对活性不利。2-喹诺酮-吡唑杂合体25a-f、2-喹诺酮-噁唑杂合体25g和环丙沙星-1,3,4-噻二唑杂合体26也具有潜在的抗肿瘤活性,但普遍较弱。
左氧氟沙星-噻二唑杂合体28 (IC50: 0.019~0.127 μmol/L)和29 (IC50: 0.046~0.203 μmol/L)对组蛋白去乙酰化酶的抑制活性与伏立诺他(IC50: 0.012-0.044 μmol/L)相当,且远优于左氧氟沙星-噻二唑杂合体27 (IC50: 1.1~14.3 μmol/L),提示末端的羧基对活性不利。所有杂合体不仅对SW620、MGC-803、PC-3、NCIH460、MCF-7和HepG2肿瘤细胞系均具有潜在的活性,IC50为0.6~15.9 μmol/L, 而且对正常GES-1细胞的细胞毒性极低(IC50: ≥81.5 μmol/L),安全性良好。SAR显示,连接子的碳链长度与活性息息相关,且n= 6活性最高。杂合体的抗肿瘤细胞活性与抑组蛋白去乙酰化酶活性一致,且活性顺序为28 > 29 > 27。其中,代表物28d (IC50: 0.6~3.1 μmol/L)对所测所有肿瘤细胞系的活性优于伏立诺他(IC50: 1.7~6.4 μmol/L),且对正常GES-1细胞的细胞(IC50: >100 μmol/L)无毒,值得进一步研究。
硒二唑并喹诺酮30和31对HeLa和L1210仅显示出较弱的活性,其中,化合物30h (IC50: ≤100 μmol/L)对所测肿瘤细胞系的活性最高,且对正常人成纤维细胞BHNF-1无毒。
5 喹诺酮-二唑杂合体
培氟沙星-/氧氟沙星-/环丙沙星-噻唑并[3,2-b][1,2,4]三氮唑杂合体32~34(图6)(IC50: 3.6~56.8 μmol/L)对所测SMMC-7721、L1210、HL60、Hep-3B和Capan-1肿瘤细胞系具有潜在的活性,且均优于母药培氟沙星、氧氟沙星和环丙沙星(IC50: >100 μmol/L)。SAR显示氟喹诺酮母核对活性有显著影响,且氧氟沙星和环丙沙星对活性的贡献高于培氟沙星。氢键供体羟基和卤素氟可提高活性,且单甲氧基杂合体33b (IC50: 26.7~35.7 μmol/L)的活性优于二甲氧基衍生物33g (IC50: 35.7~53.6 μmol/L),提示甲氧基的个数对活性有影响。杂合体34g (IC50: 3.6~7.6 μmol/L)对HL60、Hep-3B和Capan-1肿瘤细胞系的活性略弱于阿霉素(IC50: 1.8~3.5 μmol/L),可作为先导物进一步优化。
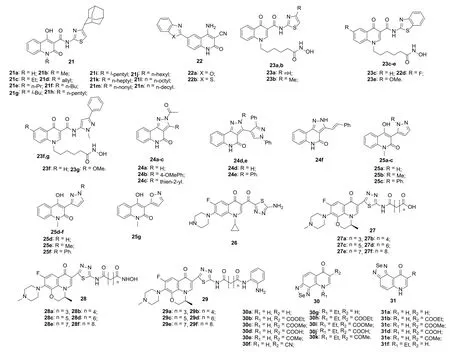
图5 喹诺酮-噻唑/-吡唑/-噁唑杂合体和硒二唑并喹诺酮21~31的化学结构
培氟沙星-1,2,4-三氮唑-噁二唑杂合体35 (IC50:3.8~35.2 μmol/L)和36 (IC50: 1.5~24.5 μmol/L)对SMMC-7721、L1210、HL60、Hep-3B和Capan-1肿瘤细胞系也显示出潜在的活性。SAR研究结果表明,苯环上连有2-甲氧基和4-氟时对活性有利。其中,代表物36i (IC50: 1.5~5.2 μmol/L)对SMMC-7721、L1210和HL60细胞系的活性优于阿霉素(IC50: 1.2~2.6 μmol/L)。氧氟沙星-二噁二唑杂合体37 (IC50: 5.7~24.7 μmol/L)和38 (IC50: 2.4~32.4 μmol/L)对SMMC-7721、L1210、HL60和CHO肿瘤细胞系的活性弱于相应的氢碘酸盐(IC50: 3.0~18.4和1.1~18.3 μmol/L)。其中,杂合体38b的氢碘酸盐(IC50: 1.1~2.8 μmol/L)对L1210、HL60和CHO肿瘤细胞系的活性最高,可作为先导物进一步优化。
对环丙沙星-噻唑并[1,2,4]三氮唑酮杂合体39(图7)的SAR研究结果表明,向苯环的间位和对位引入羧酸、羧酸甲脂和磺酰胺(杂合体39i-n和39q,r的IC50为0.3~8.4 μmol/L)比引入甲氧基、硝基、甲基、氰基、氯和溴(IC50: >10 μmol/L)对抗Hep-3B、Capan-1和HL60肿瘤细胞系活性有利。杂合体39q对Hep-3B、Capan-1和HL60肿瘤细胞系的IC50分别为0.7、0.3和1.5 μmol/L,是对照药阿霉素(IC50: 2.6, 1.7和3.5 μmol/L)的2.3~5.6倍,极具进一步开发前景。
6 喹诺酮-三氮唑酮/-噻唑啉酮/-吡唑啉/-噁唑啉杂合体
对31个2-喹诺酮-噻唑啉-4-酮杂合体40(图7)的体外抗BT-549和HeLa细胞系活性评价结果表明,这类杂合体在浓度为100 mg/mL时对所测肿瘤细胞的抑制率为14.231~83.762%,弱于顺铂(96.873%和98.264%)。其中,活性最高的杂合体40a,b(63.163~83.762%)进一步测定了其抗BT-549、HeLa、COLO-205和ACHN肿瘤细胞系的IC50。结果表明,二者对所测肿瘤细胞系的IC50为 20.737~78.861 μmol/L,对BT-549和HeLa的活性弱于顺铂(IC50: 6.937和2.870 μmol/L),对COLO-205和ACHN的活性弱于5-氟尿嘧啶(IC50: 4.562和9.784 μmol/L)。在小鼠体内模型中,与安慰剂组(平均存活时间为18.16d)相比,杂合体40a,b (平均存活时间分别为29.16和32.16d)可极大地延长小鼠的存活时间,但略弱于顺铂(平均存活时间为38.5d)。
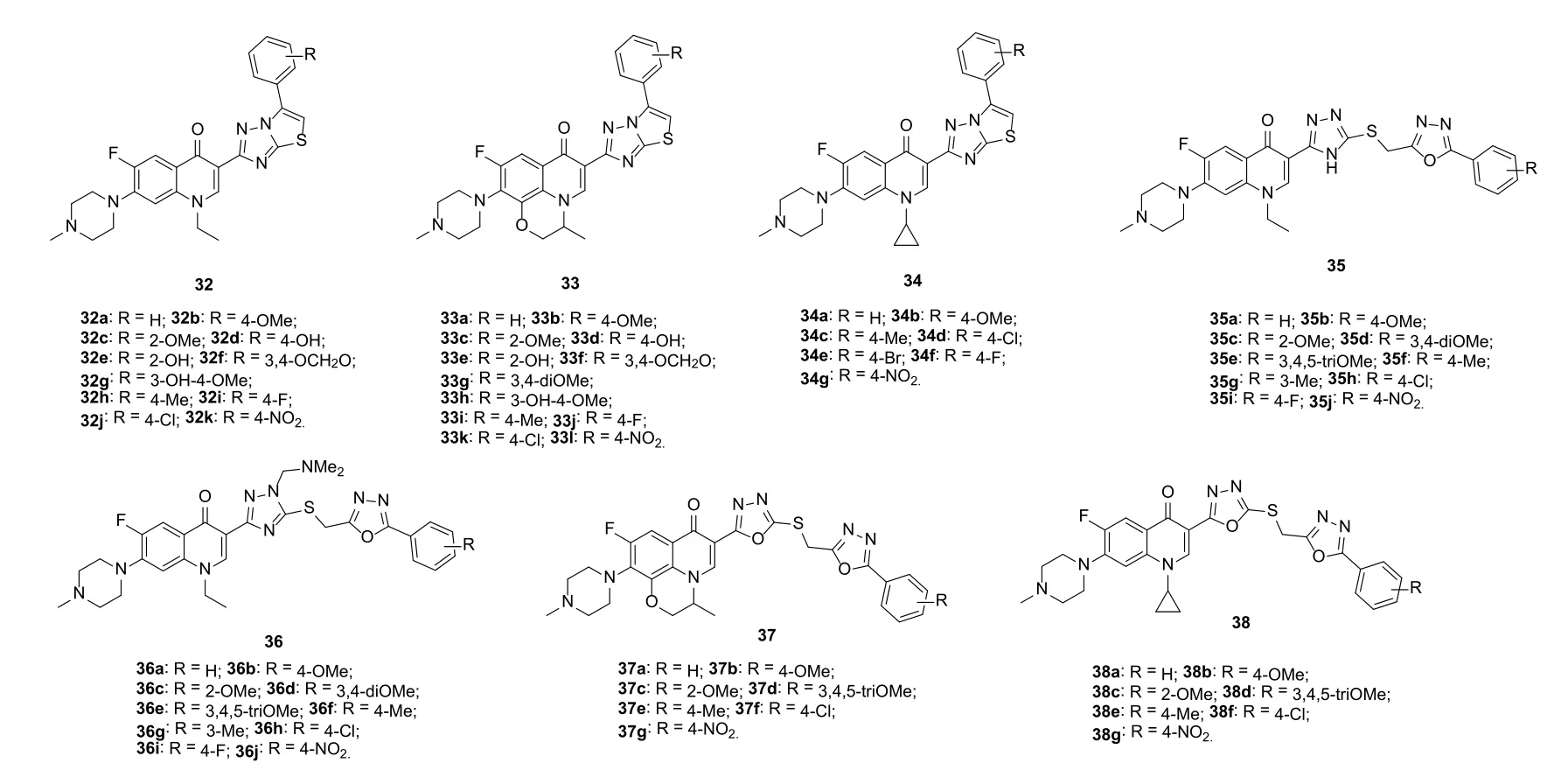
图6 喹诺酮-二唑杂合体32~38的化学结构
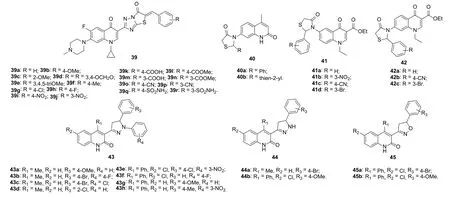
图7 喹诺酮-三氮唑酮/-噻唑啉酮/-吡唑啉/-噁唑啉杂合体39~45的化学结构
喹诺酮-噁唑啉酮杂合体41和42在浓度为10 μmol/L对所测细胞系未显示出任何毒性。喹诺酮-吡唑啉和喹诺酮-噁唑啉杂合体43~45对HeLa、HCT 116和HCT-8肿瘤细胞系具有潜在的活性,且活性顺序为43 > 45 > 44。对喹诺酮-吡唑啉杂合体43而言,R1位为苯基比甲基对活性有利,R3位为甲氧基最优。代表物 43g (IC50: 2.4, 2.2和5.6 μmol/L)对所测HeLa、HCT 116和HCT-8肿瘤细胞系的活性优于阿霉素(IC50:6.3, 8.7和7.2 μmol/L),值得进一步研究。
7 结束语
癌症是仅次于心血管疾病的第二大致死性疾病。抗癌药物对癌症的治疗不可或缺,但肿瘤细胞以对现有药物产生了耐药性,研发新型抗癌药物势在必行。喹诺酮和唑类化合物均具有潜在的抗肿瘤活性,其中的某些产品已用于临床治疗各种癌症。显然,将喹诺酮和唑杂合到一个分子中可能会获得对药敏型和耐药型癌症均有效地候选物,如杂合体15e、17a、19b和19g等具有良好的体内外抗肿瘤活性和安全性,值得深入研究。
本文综述了近年来喹诺酮-唑杂合体包括喹诺酮-四氮唑、喹诺酮-三氮唑、喹诺酮-苯并咪唑、喹诺酮-苯并恶唑、喹诺酮-苯并噻唑、喹诺酮-咪唑、喹诺酮-噻唑、喹诺酮-噁唑、喹诺酮-噻二唑、喹诺酮-硒二唑、喹诺酮-二唑、喹诺酮-三氮唑酮、喹诺酮-噻唑啉酮、喹诺酮-吡唑啉酮和喹诺酮-噁唑啉酮在抗肿瘤领域的研究进展。本文还总结了喹诺酮-唑杂合体的抗肿瘤构-效关系,为更合理的设计此类杂合体提供理论基础。

