喹诺酮衍生物及其抗耐甲氧西林金葡球菌活性
柴芸,冯连顺 编写 刘明亮,郭慧元 审校
(1 国家药品食品监督管理局,北京 100022;2 中国医学科学院北京协和医学院医药生物技术研究所,北京 100050)
1 前言
金黄色葡萄球菌(金葡球菌)是一类棒状革兰阳性菌,可引起严重甚至致命性感染。目前,金葡球菌对几乎所有的抗生素均产生了不同程度的耐药性,其中,60%以上的临床分离株对甲氧西林耐药即耐甲氧西林金葡球菌(MRSA)。MRSA可引起多种难治性感染如皮肤和软组织感染、败血症、心内膜炎、肺炎、肠炎、脑膜炎、骨髓炎和毒性休克综合症等,严重威胁人类健康。几乎所有的MRSA临床分离株均会产生β-内酰胺酶和青霉素结合蛋白,进而降低MRSA与β-内酰胺类抗生素的结合力。万古霉素被认为是治疗MRSA感染的最后防线,遗憾的是,MRSA已对万古霉素产生了耐药性。因此,研发新型抗MRSA药物迫在眉睫。
喹诺酮包括氟喹诺酮,可分为2-喹诺酮和4-喹诺酮。喹诺酮衍生物具有抗菌、抗肿瘤、抗结核、抗人类免疫缺陷病毒(HIV)和抗疟疾等多种生物活性,在新药研发领域举足轻重。喹诺酮是最常见的抗感染化疗药物之一,经常被用来治疗各种细菌感染。尽管近年来喹诺酮新品种不断问世,但仍不足以对付肆虐的耐药菌如MRSA和耐甲氧西林表葡球菌(MRSE)。喹诺酮骨架可修饰的位点较多,对MRSA也具有优秀的体内外活性,是开发新型抗MRSA药物的理想结构单元。
近年来,科学家筛选了众多喹诺酮衍生物的体内外抗MRSA活性,并发现了若干苗头化合物。本文将重点介绍近年来喹诺酮类化合物在抗MRSA领域的最新研究进展,并归纳此类化合物的构-效关系(SAR),为进一步研究提供理论支持。
2 2-喹诺酮类化合物
2-喹诺酮具有多种生物活性,其中的某些衍生物具有潜在的抗MRSA活性。更重要的是,某些2-喹诺酮化合物如GSK945237和AZD9742(见图1)目前正处于治疗细菌(包括MRSA)感染的临床评价阶段,有望于不久的将来为人类健康服务。基于此,有必要研究2-喹诺酮的抗MRSA活性。
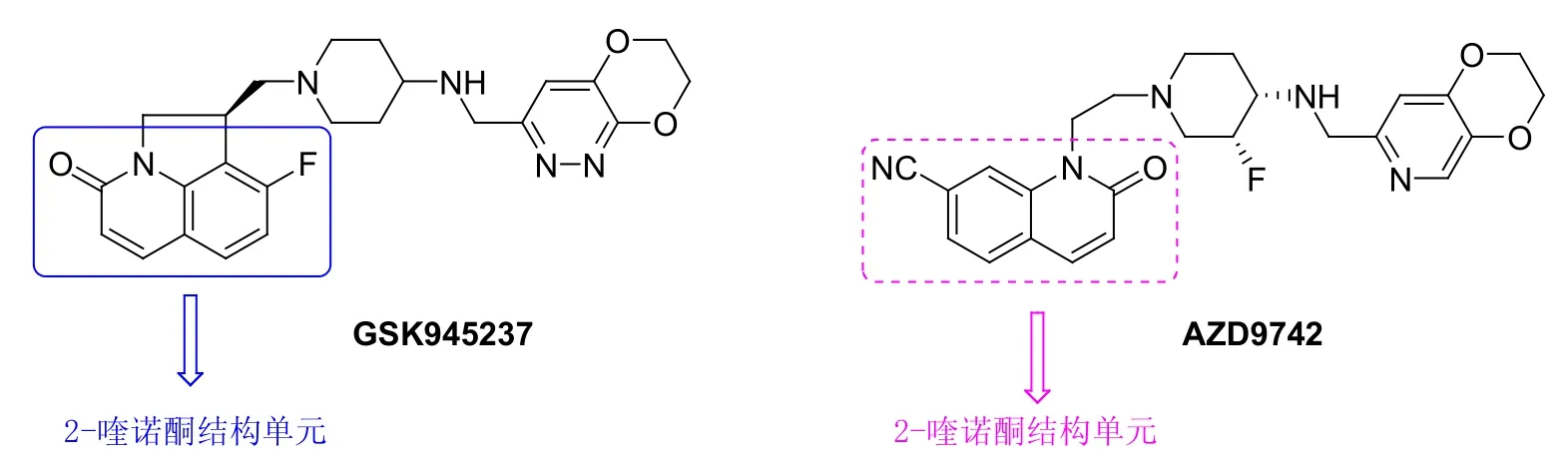
图1 2-喹诺酮化合物GSK945237和AZD9742的化学结构
2-喹诺酮-吡啶杂合体1和2(见图2)对甲氧西林敏感型金葡球菌(MSSA)具有良好的体外活性,最小抑制浓度(MIC)为0.06~0.25 μg/mL。其中的R,S-1b即AZD9742对社区(CA)和院内(HA)MRSA的活性极高,MIC分别为0.06和0.125 μg/mL。本品对CA-MRSA的活性是利奈唑胺(MIC: 1 μg/mL)、万古霉素(MIC: 2 μg/mL)和左氧氟沙星(MIC: 8 μg/mL)的16~128倍,对HA-MRSA的活性是利奈唑胺(MIC: 2 μg/mL)和万古霉素(MIC: 2 μg/mL)的16倍。AZD9742的药代动力学性质(PK)在可接受范围之内,在雄性比格犬模型中,其清除率为6.2 mL/(min·kg)、容积为1.5 L/kg、半衰期为3.4 h、生物利用度为60%。在粒细胞减少小鼠大腿感染MRSA模型中,在氮杂苯并三氮唑存在的条件下,AZD9742 [给药60 mg/(kg·d)]可降低1.5 log CFU单位细菌负载量,与左氧氟沙星[给药80 mg/(kg·d)可降低1.4 log CFU单位细菌负载量]相当。不仅如此,AZD9742 [AUC∞: 53 μg/(h·mL)]的药时曲线下面积(AUC)高于左氧氟沙星[AUC∞: 11 μg/(h·mL)]。目前,AZD9742的I期临床试验正在进行,结果值得期待。
Yamamoto等研究了2-喹诺酮/香豆素-吲哚杂合体3对多种致病菌包括MRSA的体外活性,发现2-喹诺酮-吲哚杂合体(A = NMe)的抗MRSA活性优于相应的香豆素衍生物(A = O);对2-喹诺酮-吲哚杂合体而言,R2为酯基时活性高于酰胺;R1为4-OCF3的活性与4-CF3相当,且均优于3-Br。除3h和3n外,所有R1为4-OCF3或4-CF3的杂合体(MIC: 1 μg/mL)对MRSA均具有良好的活性,与利奈唑胺(MIC: 1 μg/mL)相当,而是万古霉素(MIC: 2 μg/mL)的2倍。
Ross等评价了从Zanthoxylum monophyllum树叶和树皮中分离的23个天然产物的抗菌和抗原虫活性,发现2-喹诺酮4 (IC50: 8 μmol/L)对MRSA具有潜在的活性,且在浓度为25 μg/mL时对VERO细胞无毒。Laphookhieo等测定了从五叶山小橘中分离的过氧喹诺酮5a及其衍生物5b的体外抗菌活性,但二者对所测试的MRSA SK1菌株并未显示出任何活性。
3 4-喹诺酮衍生物
包括氟喹诺酮在内的4-喹诺酮在抗感染化疗领域举足轻重,其中的某些第四代喹诺酮如莫西沙星、德拉沙星、西他沙星、加雷沙星、奈诺沙星和奥泽沙星等(见图3)目前已在临床上用于MRSA感染的治疗。
4-喹诺酮可修饰的位点较多,其中,C-7位被认为是最适合修饰的位点。C-7位取代基对抗菌谱、抗菌活性、生物利用度、溶解性、安全性和PK等息息相关,实际上,近年来上市的喹诺酮新品种绝大多数是对C-7位修饰的成果。
3.1 4-喹诺酮杂合体
将两个或多个药效团嵌入到一个分子中的杂合体策略具有拓展抗菌谱、提高抗菌尤其是耐药菌活性、降低毒副作用和改善PK的潜力,是近年来新药研发常用的策略之一。尽管杂合体策略起步较晚,但多个喹诺酮杂合体如Ro-23-9424和MCB3681(见图4)对耐药菌和难治性致病菌具有良好的体内外活性,目前正处于临床评价阶段,结果值得期待。因此,4-喹诺酮杂合体对研发新型抗菌药至关重要。
4-喹诺酮的C-7位一般含有一个四元、五元或六元碱性氮杂环如氮杂环丁烷、吡咯烷、哌嗪和哌啶等,向这些杂环上引入其它药效团不会改变4-喹诺酮的渗透性,故通过向该位点的杂环引入其它药效团是近年来研究的热点。
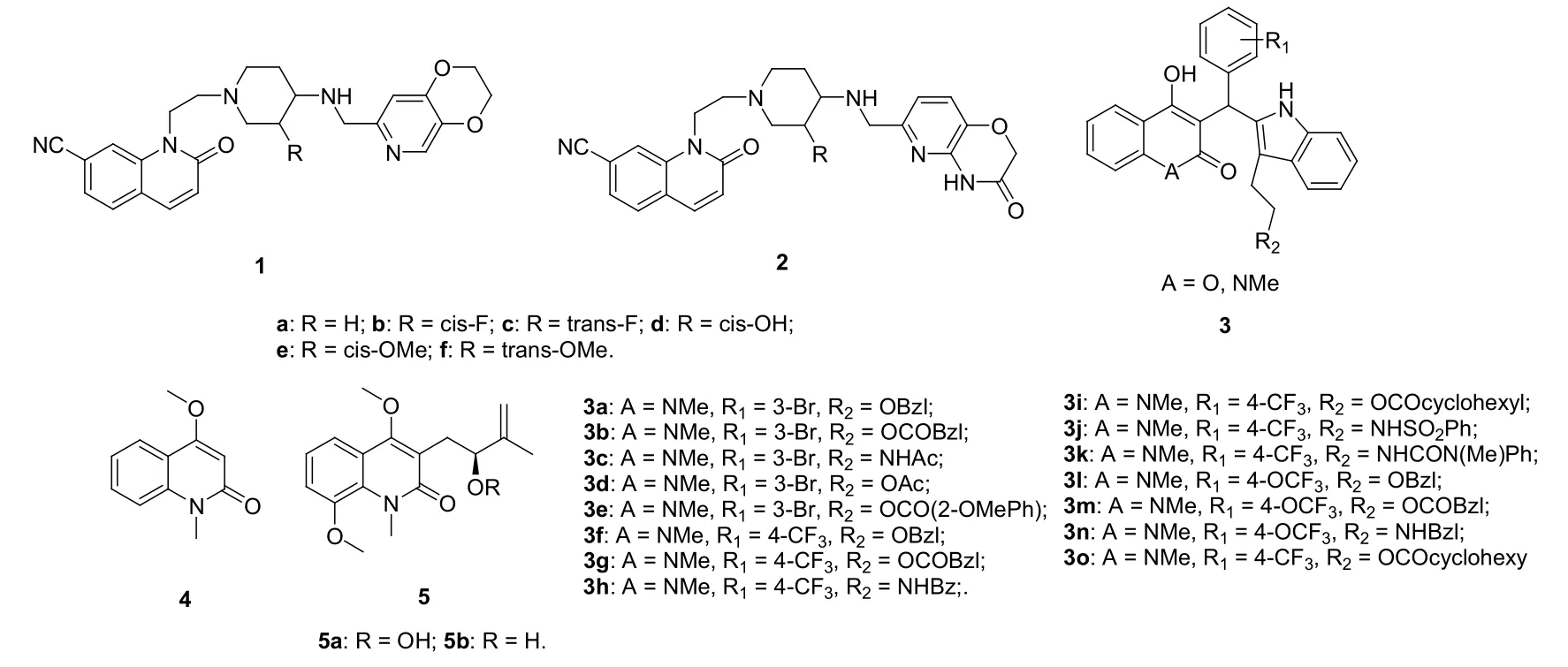
图2 2-喹诺酮衍生物1~5的化学结构
3.1.1 4-喹诺酮-肟杂合体
肟基是头孢菌素类药物的常见官能团,将该基团引入至喹诺酮成功地开发出了具有广谱抗菌活性的吉米沙星、扎博沙星(DW224a)和DW286(见图5)。吉米沙星、扎博沙星(DW224a)和DW286具有良好的体内外抗MRSA活性和PK性质,提示肟基与4-喹诺酮可能是良好的搭配。
近年来,药物化学家向4-喹诺酮C-7位的氮杂环丁烷、吡咯烷和哌啶基引入了多种肟基,并评价了这些4-喹诺酮-肟杂合体的体内外抗菌包括MRSA活性,并发现了若干活性高、安全性良好的候选物。
本课题组对多个系列扎博沙星位置异构体6、吉米沙星衍生物7和DW286类似物8(见图6)的体外抗MRSA活性评价结果表明,这类杂合体对MRSA具有潜在的活性,MIC为0.5~>128 μg/mL。SAR显示,甲肟和乙肟最优,且对抗MRSA活性贡献相当;N-1位取代基对活性有显著影响,且总体而言,环丙基最佳。对吉米沙星衍生物7而言,C-7位杂环取代基的体积大小与活性息息相关,且哌啶基≈吡咯烷基>氮杂环丁烷。其中,化合物7a (MIC: 0.5 μg/mL)的抗MRSA活性与母药吉米沙星(MIC: 0.5 μg/mL)相当,而是左氧氟沙星(MIC: 1 μg/mL)和环丙沙星(MIC: 4 μg/mL)的2和8倍;化合物7b (MIC: 0.5 μg/mL)对所测3株MRSA的活性是莫西沙星(MIC: 8 μg/mL)、左氧氟沙星(MIC: 32 μg/mL)和环丙沙星(MIC: 64 μg/mL)的16~128倍。对DW286类似物8而言,化合物8a~c (MIC: 8 μg/mL)的活性是左氧氟沙星(MIC: 16 μg/mL)的2倍,且8a (CC50: 176.76 μg/mL)对VERO细胞的毒性较低。然而,向氮杂环上的伯胺引入甲基(-Me)如化合物9 (MIC: 64~>128 μg/mL)对抗MRSA活性不利。向吉米沙星侧链再引入一个肟基所得的衍生物10对MRSA也具有良好的活性,MIC为0.06~2 μg/mL,且相当一部分衍生物的MIC为0.06~0.25 μg/mL,与吉米沙星(MIC: 0.25 μg/mL)和左氧氟沙星(MIC: 0.125 μg/mL)相当或更优。代表物10a,b (MIC:0.06 μg/mL)的抗MRSA活性是吉米沙星和左氧氟沙星的2和4倍,值得进一步研究。
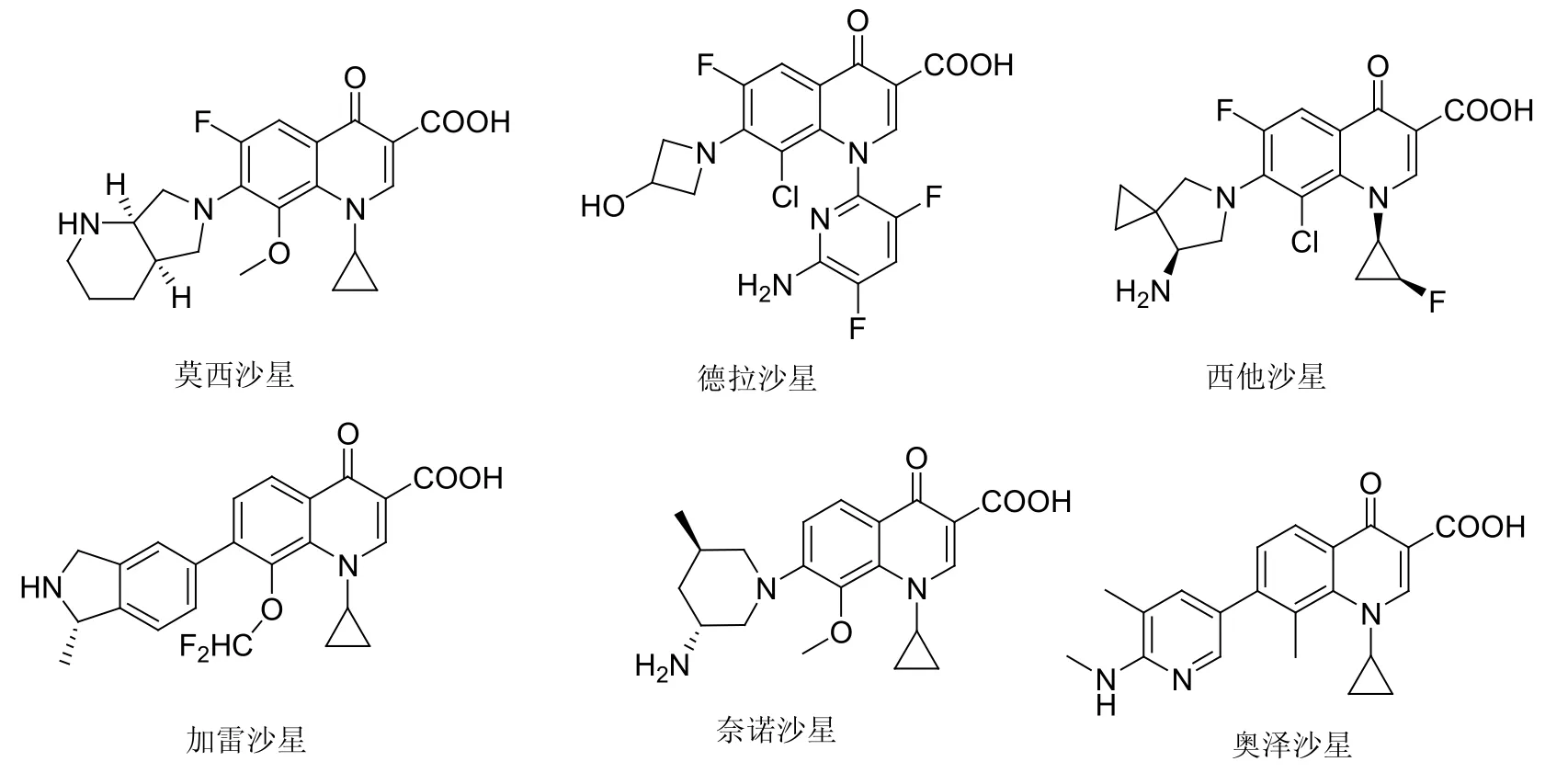
图3 莫西沙星、德拉沙星、西他沙星、加雷沙星、奈诺沙星和奥泽沙星的化学结构
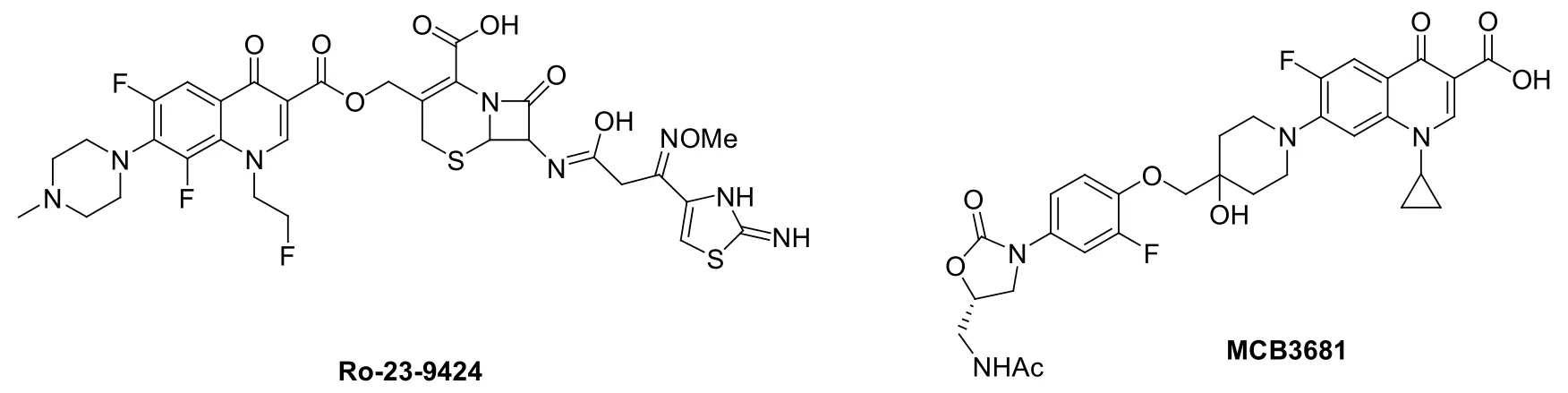
图4 喹诺酮杂合体Ro-23-9424和MCB3681的化学结构

图5 吉米沙星、扎博沙星和DW286的化学结构
由本课题组开发的IMB-070593 (11a)及其衍生物11 (MIC: <0.008~8 μg/mL)对所测的4株MRSA具有良好的活性,远优于环丙沙星(MIC: 64~>128 μg/mL)和左氧氟沙星(MIC: 32~64 μg/mL)。值得关注的是,与无取代衍生物相比,向R3位引入甲基(12)并不会影响抗MRSA活性,但将甲基移至C’-3位(13,MIC: 8~>128 μg/mL)将会导致活性的大幅降低。化合物13的位置异构体14 (MIC: 0.25~2 μg/mL)也具有良好的抗MRSA活性,与第四代氟喹诺酮吉米沙星、莫西沙星和加替沙星相当。在这些衍生物中,IMB-070593 (11a)对MRSA的活性极高,MIC为0.015~2.0 μg/mL,是巴洛沙星(MIC: 4~8 μg/mL)、吉米沙星(MIC: 4~16 μg/mL)和左氧氟沙星(MIC: 32 μg/mL)的8~64倍。在小鼠系统感染模型中,IMB-070593的疗效与吉米沙星和莫西沙星相当,且体内毒性(包括光毒性、肝毒性和心脏毒性)极低。目前,IMB-070593已完成临床前研究,深入研究结果值得期待。
除上述氟喹诺酮-肟杂合体外,研究人员还评价了加替沙星-肟杂合体15、左氧氟沙星-肟杂合体16和诺氟沙星-肟杂合体17的体外抗MRSA活性。尽管某些杂合体如17a (MIC: 0.2 μmol/L, 活性是母药诺氟沙星的24倍)对MRSA的活性较高,但绝大多数杂合体的活性较弱。尽管如此,这类研究丰富了SAR,为进一步设计打下了基础。
3.1.2 4-喹诺酮-唑杂合体
唑包括三氮唑、咪唑、噁唑、吡唑和噻唑等是药物分子中的常见结构片段,将其引入到喹诺酮母核可能会增强喹诺酮对MRSA的活性。
某些第四代头孢菌素类抗生素如头孢噻利含有3-氨基吡唑结构单元,基于此,Wang等评价了一系列3-氨基吡唑-4-喹诺酮杂合体18(见图7)的抗革兰阳性菌和阴性菌活性。结果表明,杂合体18对所测的2株MRSA具有优秀的活性,MIC为0.125~16 μg/mL,且向3-氨基吡唑的N-2位引入甲基可提高抗MRSA活性。进一步分析发现,喹诺酮母核对活性也有显著影响,其中1-环丙基-8-二氟甲氧基喹诺酮、1-环丙基-8-甲氧基喹诺酮和1-乙基-8-氟喹诺酮对抗MRSA活性有利。代表物18i,m,n对所测MRSA的MIC为0.125和0.25 μg/mL,与对照药莫西沙星、吉米沙星、加替沙星和左氧氟沙星(MIC: 0.06~0.25 μg/mL)相当。
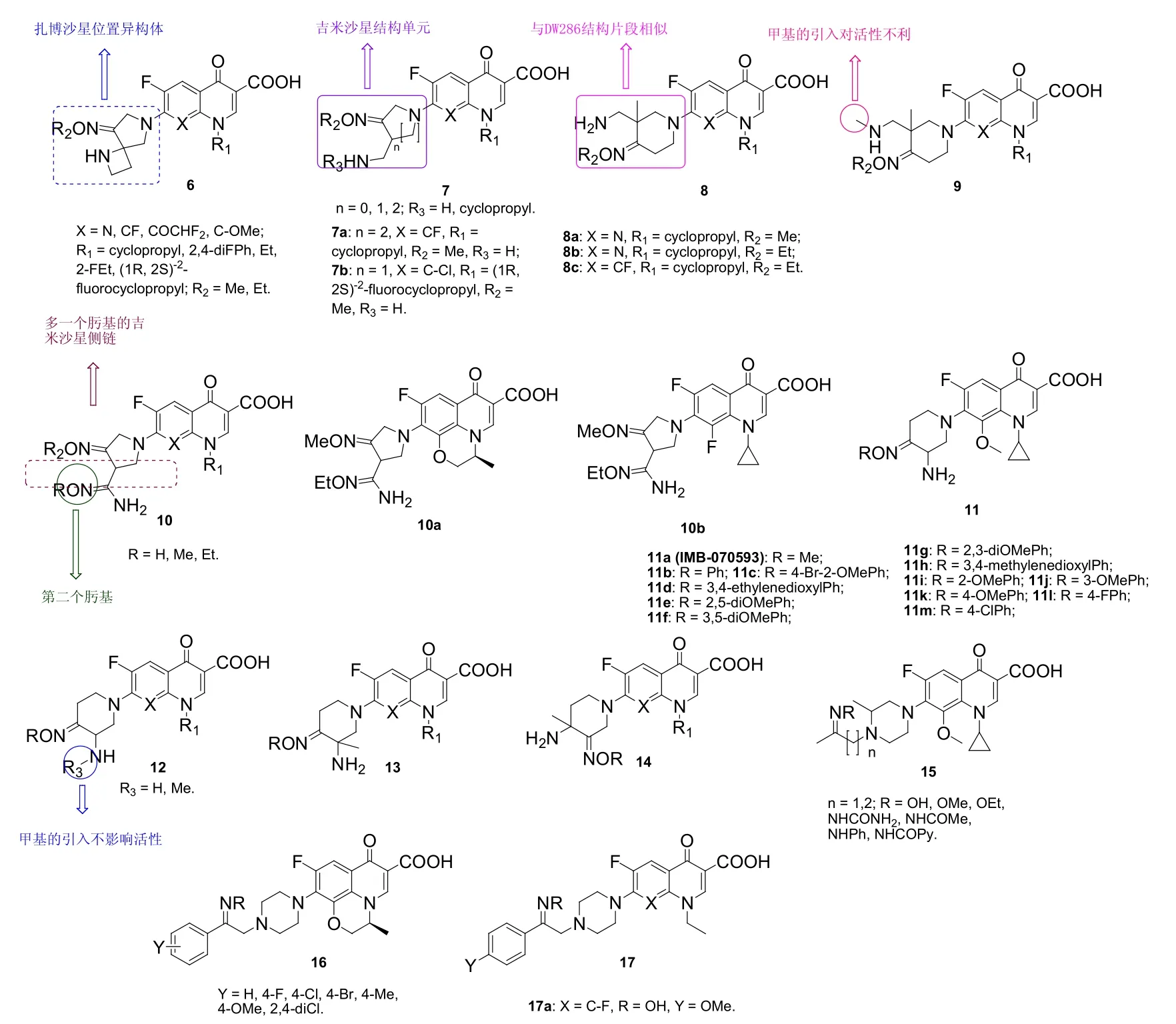
图6 4-喹诺酮-肟杂合体6~17的化学结构
对2-羟基-3-硝基咪唑-氟喹诺酮杂合体19的体外抗菌活性测定结果表明,这类杂合体具有潜在的抗MRSA活性,MIC为2~>32 μg/mL,部分杂合体抗MRSA活性与加替沙星(MIC: 16 μg/mL)相当或更优。氟喹诺酮对活性影响显著,且莫西沙星>巴洛沙星>加替沙星>环丙沙星;与无取代氟喹诺酮相比,C-8位甲氧基取代的氟喹诺酮活性更优;丙基2位羟基的立体构型对杂合体与DNA-促旋酶结合至关重要;硝基咪唑结构片段上的硝基在C-4位优于在C-5位。莫西沙星杂合体19a (MIC: 2 μg/mL)的体外抗MRSA活性最高,是加替沙星的8倍。对接试验表明,杂合体19a的与作用靶点结合方式与加替沙星相似,但2-羟基-3-硝基咪唑基丙基可形成两个额外的氢键。进一步修饰所得的克林沙星-咪唑杂合体20对革兰阳性菌、阴性菌和真菌尤其是MRSA具有潜在的活性。SAR显示,与未取代的杂合体20d,e (MIC:52.92 nmol/L)相比,向咪唑母核引入硝基20a~c(MIC: 0.39-12.15 nmol/L)可显著地提高抗MRSA活性。其中,杂合体20a (MIC: 0.39 nmol/L)的抗MRSA活性远优于对照药氯霉素、诺氟沙星、环丙沙星和克林沙星(MIC: 35.66, 20.89, 8.79和2.01 nmol/L)。作用机制研究结果显示,杂合体20a可通过形成稳定的20a-Cu2+-DNA 三元复合物抑制DNA复制,进而发挥抗菌活性。
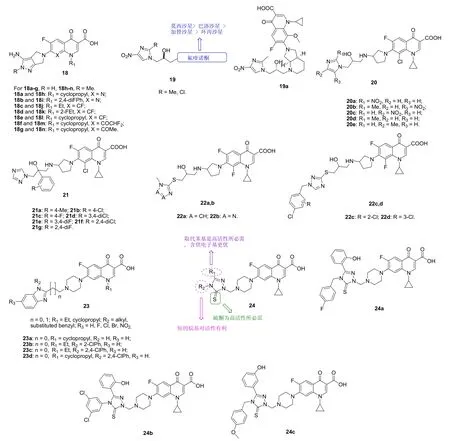
图7 4-喹诺酮-唑杂合体18~24的化学结构
用1,2,4-三氮唑或四氮唑代替咪唑所得的杂合体也具有潜在的抗MRSA活性,对1,2,4-三氮唑杂合体而言,苯环上含有供电子如甲基时活性优于吸电子取代基如氯和氟;双取代杂合体的活性优于单取代杂合体。其中,代表物1,2,4-三氮唑-克林沙星杂合体21a,d,g和四氮唑杂合体22b (MIC: 0.25 μg/mL)是母药克林沙星(MIC: 1.0 μg/mL)的4倍。
对苯并咪唑-诺氟沙星/环丙沙星杂合体23而言,连接子和苯并咪唑片段氮上的取代基对抗MRSA活性有明显影响:短的次甲基连接子优于长的次乙基连接子;氮上无取代的杂合体活性与含有取代苄基的杂合体活性相当,且均优于烷基取代杂合体;对R3位而言,吸电子基如硝基或卤素的引入对活性不利;对取代苄基而言,二取代优于单取代。活性最强的杂合体23a~d不仅对MRSA (MIC: 0.125 μg/mL)的活性优于对金葡球菌(MIC: 0.25~8 μg/mL)的活性,而且对MRSA的活性是诺氟沙星、环丙沙星和克林沙星(MIC: 8, 2和1 μg/mL)的8~64倍。其中,杂合体23d (IC50: 106 μg/mL)对正常人胚胎肾细胞的毒性极低,且可与DNA结合形成稳定的23d-DNA复合物,进而发挥抗菌功效。
对环丙沙星-1,2,4-三氮唑-5(4H)-硫酮杂合体24的体外抗菌活性评价结果表明,这类杂合体对MRSA具有良好的活性(MIC: 0.046~23.66 μmol/L),且大多数杂合体活性优于万古霉素(MIC: 0.68 μmol/L)和环丙沙星(MIC: 1.48 μmol/L)。SAR显示,1,2,4-三氮唑-5(4H)-硫酮C-3位的取代苯基是高活性所必需,且苯基时连有供电子基如羟基是活性进一步提高;N-4位的取代苯基并非高活性所必需;如N-4位连接烷基,则短链烷基优于长链烷基。其中,杂合体24a~c不仅对HEK-293细胞系的毒性较低(EC50: 50.47-62.89 μmol/L),而且抗MRSA活性(MIC: 0.046 μmol/L)是万古霉素和环丙沙星的15和32倍,值得深入研究。
2-氨基噻唑是抗菌药如头孢菌素(头孢地嗪、头孢噻利和头孢甲肟)的常见药效团,且基于2-氨基噻唑的药物具有能克服严重耐药性和安全性高等诸多优点,故有必要将其与喹诺酮杂合。
值得注意的是,将2-氨基噻唑嵌入至喹诺酮的C-3位所得的杂合体25 (MIC: 0.8~128 μg/mL,见图8)对MRSA具有潜在的活性。SAR显示,喹诺酮C-3位的2-氨基噻唑片段是高活性所必需的基团;喹诺酮的C-6位为吡咯烷基时,杂合体的活性最高;C-7位为氯时优于氟;C-8位含有氯或氟等卤素时对活性不利。其中,杂合体25a (MIC: 0.8 μg/mL)不仅抗MRSA活性最高,而且还具有对肝细胞毒性低、抑DNA促旋酶活性强和耐药性产生慢等诸多优点。分子模拟与实验研究结果显示,杂合体25a可与MRSA的DNA通过形成25a-Cu2+-DNA三元络合物发挥功效。然而,将 2-氨基噻唑与喹诺酮通过酰胺键合(26),将导致抗MRSA活性(MIC: >201 μg/mL)的大幅降低。
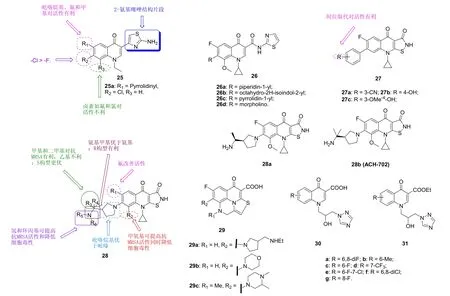
图8 4-喹诺酮-唑杂合体25~31的化学结构
异噻唑[5,4-b]喹诺酮杂合体27和28对MRSA和同时耐甲氧西林和喹诺酮的金葡球菌(MQRSA)具有极为优异的活性,大多数杂合体的MIC<1 μg/mL。对杂合体27而言,苯环上的取代基所处的位置对活性有明显影响,且间位最优。杂合体27a~c (MIC: 0.125 μg/mL)的抗MRSA活性最高,是对照药环丙沙星、加替沙星、吉米沙星和莫西沙星(MIC: 2~32 μg/mL)的16~128倍。细胞毒性试验结果表明,杂合体27a(CC50>100 μmol/L)对人喉癌Hep-2细胞无毒。对杂合体28而言,对抗MRSA活性有利的因素有:1) C-6位为氟原子取代; 2) C-7位为取代吡咯烷基; 3) R3和R4位为甲基或二甲基; 4) R5和R6位为小体积烷基取代基;5) C-8位为甲氧基。其中,杂合体28a和28b (ACH-702) (MIC: 0.06 μg/mL)的抗MRSA和MQRSA活性远优于环丙沙星、莫西沙星、左氧氟沙星、利奈唑胺和万古霉素(MIC: 32, 4, 16, 1和1 μg/mL)。进一步研究显示,与传统的喹诺酮相比,喹诺酮抗性决定区域(QRDRs)的突变对28a和28b的影响较小,提示这类杂合体可能具有全新的左右机制,在对付耐喹诺酮致病菌领域可能大有作为。
噻唑[3,2-a]喹诺酮杂合体29a~c (MIC: 0.05~3.13 μg/mL)对所测的9株MRSA临床分离株具有良好的活性,与培氟沙星、氧氟沙星和左氧氟沙星(MIC:1.56~25 μg/mL)相当或更优。
将1,2,4-三氮唑引入至喹诺酮的N-1位所得的杂合体30和31对革兰阳性菌、阴性菌和真菌具有潜在的活性。有趣的是,乙酯31的抗MRSA活性与羧酸30相当。其中,杂合体30c,d和31f抗MRSA的MIC为1.0 μg/mL,是诺氟沙星(MIC: 8.0 μg/mL)的8倍。
3.1.3 4-喹诺酮-6-氨基尿嘧啶杂合体
干扰DNA复制所必需的聚合酶IIIC可抑制革兰阳性菌染色体复制,进而杀灭细菌,故聚合酶IIIC是良好的抗菌药作用靶点。6-氨基尿嘧啶可特异性地作用于聚合酶IIIC,故将6-氨基尿嘧啶与氟喹诺酮杂合可能会获得具有双重作用机制的新型候选物。
4-喹诺酮-6-氨基尿嘧啶杂合体32 (MIC: 0.625~5 μg/mL,见图9)对MRSA具有良好的活性,优于诺氟沙星(MIC: 40 μg/mL)、环丙沙星(MIC: 20 μg/mL)和司帕沙星 (MIC: 10 μg/mL)。SAR显示,R位的取代基对抗MRSA活性有一定的影响,且甲基>氢>羟甲基;C-8位连有氟、氯和甲氧基时可提高活性;用八氢-1H-吡唑并[3,4-b]吡啶(33a,b, MIC: >80 μg/mL)或八氢吡咯并[3,4-b][1,4]噁嗪(33c, MIC: 5 μg/mL)代替哌啶基时将导致活性大幅下降;苯环C-3’的乙基和C-4’的甲基对抗MRSA活性至关重要,如杂合体32a (251D)的活性明显优于34a,b (MIC: 5和>40 μg/mL)。杂合体32a (251D)对所测的4株MRSA的MIC为0.625~2.5 μg/mL,且即便在浓度为80 μg/mL对MRC-5细胞仍未显示出毒性。不仅如此,杂合体32a(251D)的体内活性和PK性质良好,具有治疗MRSA引起的感染的潜力。
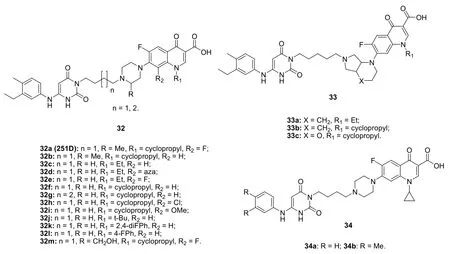
图9 4-喹诺酮-6-氨基尿嘧啶杂合体32~34的化学结构
3.1.4 其它4-喹诺酮杂合体
呋喃、噻吩和香豆素是常见的药效团,其衍生物具有潜在的抗菌活性。SAR显示,对4-喹诺酮-呋喃/噻吩杂合体35(见图10)而言,Y位取代基与杂合体的抗MRSA活性息息相关,且NOH > NOMe > O>> NOBn;环丙沙星杂合体的活性优于诺氟沙星。其中,代表物35a~c (MIC: 0.19 μg/mL,见图10)对所测2株MRSA菌株的活性是环丙沙星和诺氟沙星(MIC: 0.39和0.78 μg/mL)的2和4倍。香豆素-诺氟沙星/环丙沙星杂合体36也具有类似的结果,但总体而言香豆素杂合体36的活性弱于相应的呋喃/噻吩杂合体35。
喹诺酮-头孢菌素杂合体Ro-23-9424具有良好的抗MRSA活性,目前正处于临床评价阶段,故有必要对喹诺酮-头孢菌素杂合体进行深入研究。Hershberger 等研究表明,某些喹诺酮-头孢菌素杂合体如37a,b (PGE-42816和PGE-9464192, MIC:≤0.06~128 μg/mL)具有潜在的抗MRSA活性。其中,PGE-42816对所测2株MRSA的MIC分别为≤0.06和4 μg/mL,是环丙沙星(MIC: 0.25和32 μg/mL)的≥4倍,可作为先导物进一步优化。
利福霉素-喹诺酮杂合体38 (CBR-2092)对包括MRSA在内的革兰阳性菌和阴性菌具有良好的体内外活性,且作用机制异于传统的氟喹诺酮,具有对付耐氟喹诺酮致病菌的潜力。CBR-2092 (MIC: 0.015 μg/mL)对临床分离 MRSA的活性极高,远优于环丙沙星(MIC: >4 μg/mL)。目前,CBR-2092正处于II期临床评价阶段,结果值得期待。
环丙沙星-氨基糖苷杂合体39 (MIC: 3~48 μg/mL)具有中等强度的抗MRSA活性,优于新霉素(MIC:384 μg/mL),但弱于环丙沙星(MIC: 0.2 μg/mL)。
通过C-7位哌嗪基连接的双喹诺酮衍生物对包括耐药菌在内的多种致病菌具有潜在的活性,且大多数该类化合物对MRSA的活性极高,MIC ≤ 1 μg/mL。SAR显示,哌嗪基之间的连接子对抗MRSA活性有显著影响,且顺序为间苯二次甲基>吡啶-2,6-二次甲基>对苯二次甲基≈反式-2-丁烯-1,4-二基>>对二苯基。双环丙沙星衍生物40的抗MRSA活性最高,MIC<0.03 μg/mL,是环丙沙星(MIC: 0.5 μg/mL)的>16倍。
环丙沙星-、加替沙星-和莫西沙星-羟基二磷酸酯41 (MIC: 4~16 μg/mL)具有潜在的抗MRSA活性,但弱于相应的母药(MIC: 1~2 μg/mL)。有趣的是,含有三氮唑的杂合体41的抗MRSA活性优于相应的不含三氮唑的杂合体42。
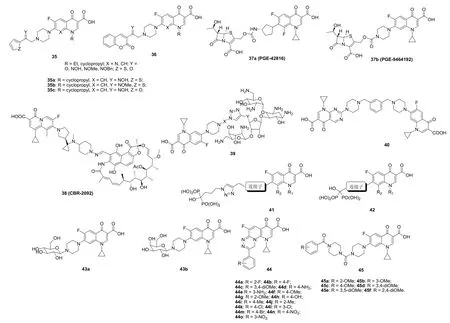
图10 4-喹诺酮杂合体35~45的化学结构
环丙沙星-葡萄糖杂合体43a和环丙沙星-半乳糖杂合体43b对环丙沙星敏感型MRSA的MIC为0.5~8 μg/mL,对耐环丙沙星MRSA无活性,提示这类杂合体的作用机制与环丙沙星相同。
1,2,4-三嗪-喹诺酮杂合体44 (MIC: 0.25~8.0 μg/mL)的体外抗MSRA不次于环丙沙星(MIC: 8.0 μg/mL),SAR显示向苯环上引入氨基或氟可提高活性,而强吸电子基硝基则对活性不利。其中,杂合体44a,b (MIC: 0.25 μg/mL)对MRSA的活性最高,是环丙沙星的32倍。
环丙沙星-脲杂合体45 (MIC: <0.016 μg/mL)的抗MRSA与诺氟沙星和环丙沙星(MIC: <0.016 μg/mL)相当,但对MRSA的杀菌活性(最低杀菌浓度/MBC:≥128 μg/mL)弱于诺氟沙星和环丙沙星(MBC: 4和0.031 μg/mL)。
对环丙沙星-柠檬酸杂合体、氟喹诺酮-铁载体杂合体、喹诺酮-腙杂合体、喹诺酮-环肽杂合体和喹诺酮-叠氮胸苷杂合体的体外抗MRSA活性测定结果表明,绝大多数所评价的杂合体无活性或活性较弱,无进一步研究价值。
3.2 其它4-喹诺酮衍生物
N-酰基化的环丙沙星6对临床分离株MRSA USA 100和MRSA ATCC43300具有潜在的活性,MIC为1~100 μg/mL。其中,化合物46c,g,k,r (MIC: 6 μg/mL)对MRSA USA 100的活性与环丙沙星(MIC: 6 μg/mL)相当,而化合物46d,l-n (MIC: 1 μg/mL,见图11)对MRSA ATCC43300的活性是环丙沙星(MIC: 6 μg/mL)的6倍。不仅如此,自发突变频率分析结果显示,这类化合物对MRSA的耐药突变频率低于现有的氟喹诺酮。
环丙沙星羧酸酯47a~c (Kp: 2.87×10-5, 3.83×10-4和7.01×10-4cm/h)的真皮渗透系数(Kp)随着酯基碳链的延长极速增大,提示长链酯基衍生物的生物利用度更高。所研究的3个羧酸酯衍生物均可在浓度为15.63 μg/mL时抑制80%以上的MRSA,具有治疗MRSA严重感染的潜力。
对喹诺酮衍生物48抗MRSA的SAR研究结果显示,喹诺酮N-1位的取代基对活性有显著影响,且N-1位为乙基的衍生物活性优于相应的N-1位为4-三氟甲基苯基衍生物;C-7位为杂环胺优于烷基胺;向烷基或苯基上引入杂环胺可提高这类化合物的抗MRSA活性。其中,衍生物48a~g (MIC: 0.022~0.78 μg/mL)对所测的2株MRSA具有良好的活性,与诺氟沙星(MIC: 0.78和1.56 μg/mL)相当或更优。其中,活性最高的化合物48a (MIC: 0.022和0.045 μg/mL)对所测的2株MRSA的活性是环丙沙星(MIC: 0.09和0.38 μg/mL)和诺氟沙星的≥4倍,值得深入研究。
7-(4,4-二甲基-3-氨甲基吡咯烷基)喹诺酮49对所测2株MRSA的 MIC为0.015~1 μg/mL,且R3无取代时优于甲基取代。化合物49c (MIC: 0.015和0.03 μg/mL)的活性最高,是环丙沙星和加替沙星(MIC:0.06~0.125 μg/mL)的≥4倍。含硫环丙沙星衍生物50的抗MRSA活性与环丙沙星相当,而2-烯基/炔基-4-喹诺酮51的活性弱于对照药。
7-氮杂环丁烷喹诺酮52对所测的4株临床分离MRSA的MIC为0.016~>64 μg/mL,其中的某些化合物活性甚至优于左氧氟沙星(MIC: 0.5~>128 μg/mL)。SAR显示氮杂环丁烷胺基取代基上的氢为这类化合物具有高活性所必需,如化合物52a~e的活性优于化合物52f;向苯基的C-4位引入供电子基如甲基或甲氧基对活性有利。其中,化合物52b (MIC: 0.16~16 μg/mL)的活性最高,可作为先导物进一步优化。进一步研究显示,用2,4-二氟苯胺(化合物53)代替N-1位的环丙基时将导致抗MRSA活性的略微降低。氮杂环丁烷喹诺酮WQ-3810 (54)的抗耐药菌包括CAMRSA (MIC90: 0.06 μg/mL)和HA-MRSA (MIC90: 4 μg/mL)活性优于环丙沙星、左氧氟沙星、莫西沙星和吉米沙星,这可能由于该化合物对突变酶的抑制活性较高所致。
新氟喹诺酮DK-507k (55a)具有良好的体内外抗菌活性和安全性,对MRSA临床分离株的活性与西他沙星、左氧氟沙星、环丙沙星、加替沙星、莫西沙星和加雷沙星相当或更优。DK-507k的二甲基衍生物55b,c也具有潜在的抗MRSA活性,且S-构型55b(DC-159a)的体外抗呼吸道病原体包括MRSA活性优于R-构型55c。不仅如此,DC-159a的体内活性、毒理学与非临床PK性质良好,值得深入研究。
6-去氟喹诺酮56 (DX-619)和57 (BMS-284756)对包括MRSA和耐氟喹诺酮在内的多种耐药菌株也具有良好的活性。其中,DX-619在0.5 μg/mL时可抑制90%的所测菌株。
氟喹诺酮JNJ-Q2 (58)具有广谱抗菌性,正处于治疗急性细菌性皮肤及皮肤结构感染的研究中。JNJ-Q2具有良好的体内外抗MRSA活性,且在MRSA的生物膜中未发现JNJ-Q2-抗性突变体。在 MRSA引起的皮肤脓肿模型中,MRSA对JNJ-Q2并未发生耐药性,这可能是由于其具有全新的作用机制所致。目前, JNJ-Q2正处于临床研究阶段,有希望于不久的将来用于治疗细菌感染尤其由MRSA引起的感染。某些JNJ-Q2 的衍生物59也具有潜在的抗MRSA活性,如化合物59a~c (MIC: 0.25, 0.5和1.0 μg/mL)的抗MRSA活性是环丙沙星的16~64倍。
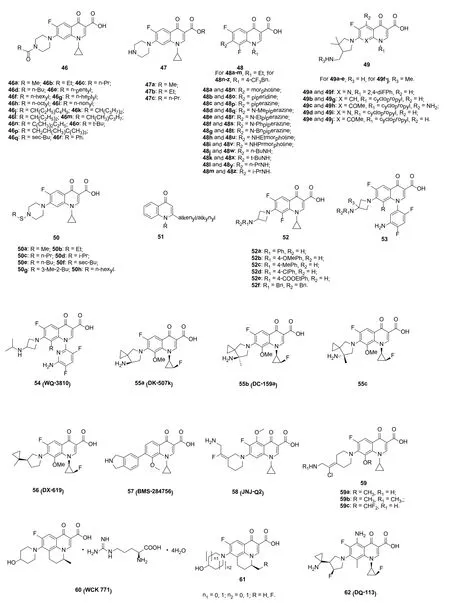
图11 喹诺酮衍生物46~62的化学结构
WCK 771 (60)是S-(-)-那氟沙星的精氨酸盐,其对所测的6株MRSA的MIC均为1.0 μg/mL,其活性高于万古霉素、替考拉宁、莫西沙星、曲氟沙星、左氧氟沙星和环丙沙星,而与克林沙星相当。特别值得一提的是,WCK 771对MRSA 和MSSA的MIC90相同,提示本品可能具有全新的作用机制。在小鼠蜂窝组织炎感染模型中,WCK 771对MSSA和MRSA的活性优于莫西沙星、万古霉素和利奈唑胺。与万古霉素和利奈唑胺一样,WCK 771可完全消除小鼠肝、脾、肾和肺组织的MRSA,极具进一步开发前景。WCK 771的衍生物61对药敏型和耐药菌如MRSA、MRSE和耐氟喹诺酮致病菌均显示出一定的活性,对MRSA的MIC为1~8 μg/mL,优于环丙沙星、左氧氟沙星和莫西沙星。
DQ-113 (D61-1113, 62)对包括MRSA在内的耐多药致病菌具有优秀的活性,对MRSA的活性(MIC:0.125 μg/mL)是万古霉素和替考拉宁(MIC: 1和0.5 μg/mL)的8和4倍。在MRSA感染的小鼠模型中,本品(6.33 log10CFU/lung)同样优于万古霉素、替考拉宁和安慰剂组(7.99, 7.36和8.47 log10CFU/lung)。在试验终点,DQ-113组免疫低下小鼠的存活率高达90%,而万古霉素、替考拉宁和安慰剂组的存活率仅为45%~55%。总之,DQ-113对MRSA引起的血源性肺部感染具有良好的疗效,具备进一步研究的潜质。
4 结束语
MRSA是最为常见的耐药致病菌之一,可引起严重甚至致命性感染。喹诺酮类化合物具有良好的体内外抗MRSA活性,其中的某些产品在临床上治疗MRSA引起的感染时发挥着重要作用。因此,研发对MRSA具有高活性的喹诺酮类药物是该领域的研究热点之一。
本文综述了近年来喹诺酮类化合物包括2-喹诺酮、4-喹诺酮杂合体和4-喹诺酮衍生物在抗MRSA领域的最新研究进展,并归纳了此类化合物的构-效关系,希望能启发研究人员设计活性更高、毒副作用更低和作用机制全新的喹诺酮类抗MRSA候选物。

