耐镉功能内生菌的筛选及其固定化处理含镉废水
杨 培, 石先阳
(安徽大学 资源与环境工程学院,合肥 230601)
镉(cadmium,Cd)可从细胞、组织、器官等层面对生物体产生毒害作用[1-4]。含镉废水处理方法如沉淀法、蒸发法、氧化法、萃取法等在处理低浓度含镉废水时存在费用高、易产生二次污染等缺点[5-7]。生物处理法因能有效避免类似问题而备受关注[8]。
近年来,国内外学者开展了固定化微生物技术处理含镉废水的研究。例如在Cd2+浓度为120 mg/L的条件下,利用海藻酸钠固定化酵母菌处理含镉废水,去除率为80.45%,较游离态酵母菌吸附Cd2+提高了12.5%[9]。以改性的Fe3O4结合海藻酸钠对Bacillusnealsonii固定化,对Cd2+的去除率达96%,并可循环使用[10]。固定化啤酒废酵母在不同吸附时间、pH、Cd2+初始浓度等因素下对Cd2+的去除率为79.82%,且微生物流失少,对环境无二次污染[11]。然而,能高效吸附废水中Cd2+的微生物及其固定化生物吸附剂鲜有报道[12]。植物内生菌为一类对植物生长无害的细菌、真菌或放线菌[13],对重金属具有较强的耐受性,目前主要是将其与各种植物联合修复受重金属污染的水体、土壤等,是一类在吸附重金属方面很有应用潜力的微生物[10]。
本文通过从芦苇根际组织中分离植物内生细菌ChryseobacteriumrhizosphaeraeSH-1,探究其对Cd2+的耐受性;经海藻酸钠固定化制成生物吸附剂,研究pH、溶液起始金属离子浓度等因素对镉吸附的影响,并采用动力学方法对结果进行分析,以期为含镉废水的处理提供理论依据。
1 材料与方法
1.1 菌株分离与鉴定
内生细菌的培养采用LB固体培养基,其成分为蛋白胨 10.0 g,酵母粉 5.0 g,NaCl 10.0 g,琼脂粉 16.0 g,pH 7.0,去离子水补至1000 mL,1×105Pa,灭菌20 min。Cd2+储备液的配置:5 g CdCl2溶解到50 mL去离子水中,0.22 μm滤膜过滤灭菌,-20 ℃保存。实验用水均由Milli-Q提供,所需Cd2+浓度从该储备液稀释。
内生菌的分离:清洗芦苇根部,75%(体积比)的无水乙醇浸泡1 min后转至5%的次氯酸钠中消毒,用无菌水冲洗。取100 μL无菌水涂布于LB平板中培养48 h,若无细菌生长则消毒成功,否则重新消毒。无菌条件下研磨芦苇根部,将研磨液逐级进行10倍系列(10-1~10-8)稀释,取100 μL研磨液涂布,30 ℃培养1~2 d后挑取单菌落,多次划线,将菌液与40%(体积比)的甘油以体积比1∶1的比例混合后于-20 ℃条件下保存。
为提取菌株的DNA,以16S rRNA基因通用合成引物27F (5′-GAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增[14]。PCR反应体系(15 μL)为:ddH2O 9.95 μL,10×Buffer 1.5 μL,dNTP 1.2 μL,27F 0.6 μL,1492R 0.6 μL,TaqDNA聚合酶 0.15 μL和模板 DNA 1 μL。PCR扩增程序: 94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,20个循环;72 ℃延伸1 min,72 ℃终延伸10 min,4 ℃保存。由上海生工生物有限公司完成测序,结果提交GenBank,进行BLAST比对分析[15]。
1.2 Cd2+对菌株的最小抑菌浓度(MIC)测定
将不同浓度的Cd2+加入LB中并混匀,倒平板。以不添加任何重金属的LB平板作为对照,挑取处于对数生长期的菌株于不同Cd2+浓度的培养基中划线,30 ℃培养3 d,若培养基中无单菌落出现,则可判定该浓度为最小抑菌浓度。
1.3 菌株的形态学分析
采用S-4800场发射扫描电子显微镜(Hitachi,日本)在工作电压3 kV 下观察菌株吸附Cd2+前后的微观结构,其中将未吸附Cd2+的菌株作为对照组;使用VERTEX 80/80v FTIR 型傅立叶红外光谱仪在 4000~400 cm-1内扫描菌株吸附Cd2+前后变化。
1.4 内生菌固定化
将菌株接种到LB固体培养基中,30 ℃培养48 h,3次分离纯化,挑取单菌落接种于液体LB中,30 ℃,150 r/min培养48 h后 10 000 r/min,10 min,弃上清,用无菌水洗涤,离心得湿菌体,将其以5%体积比与4%的海藻酸钠混匀。将混合液倒入20 mL的注射器内,匀速滴入0.3 mol/L CaCl2溶液中,注射器头与液面的距离保持在20 cm左右,至形成4 mm的固定化凝胶小球,搅拌1 h,用无菌水冲洗凝胶小球表面3次,于4 ℃保存作为实验组备用。不添加菌体,按上述同样方法制备空白小球作为对照组。
1.5 Cd2+吸附实验设计
探究时间、pH值、Cd2+初始浓度对固定化微生物吸附Cd2+的影响。分别加入固定化SH-1小球(实验组)和海藻酸钠小球(对照组,干重0.022 g)于相同规格的锥形瓶中,在30 ℃,200 r/min条件下于不同时间间隔(15、30、60、120、240、360、480和600 min)取样;相同条件下用1 mol/L HCI和1 mol/L NaOH调节溶液pH为2、3、4、5、6和7,于480 min时取样;其他因素不变,Cd2+初始浓度调为100、200、300、400、500和600 mg/L,pH 5,于480 min时取样。上清液经0.22 μm的滤膜过滤,使用ICP (iCAP 7400 Duo) 测定Cd2+浓度。每组实验设置3组平行,结果取其平均值。
1.5.1 Cd2+吸附模型
以单位小球吸附率和吸附量表征Cd2+的吸附效率,计算公式如下[16]:
(1)
(2)
式中:a为单位小球吸附率;C0为重金属离子起始浓度(mg/L);qe为单位小球吸附量(mg/g);Ce为吸附平衡后重金属离子浓度(mg/L);Vt为溶液的总体积(L);M为吸附剂的干重(g)。采用准一级吸附动力学(式3)和准二级吸附动力学模型(式4)描述固体吸附剂与液相吸附质的动力学关系[17]。
式中:qe为平衡吸附量(mg/g);qt为t时刻吸附量(mg/g);k1为准一级动力学速率常数;k2为准二级动力学速率常数。通过Langmuir(式5)和Freundlich模型(式6)来拟合固定化微生物的物理吸附和化学吸附过程[18]。
(3)
(4)
(5)
(6)
式中:qmax为单分子层饱和时的吸附容量(mg/g);KL为Langmuir常数;qe为平衡吸附量(mg/g);KF为异相吸附剂的Freundlich常数;Ce为金属离子初始浓度(mg/L);n为与吸附位能量分布相关的Freundlich常数。
1.5.2 固定化小球解吸附实验
为了探究固定化小球的重复利用率,本实验用0.1 mol/L HCl对小球进行解吸附研究。将吸附后的小球用ddH2O冲洗后,250 r/min解吸2 h,通过0.22 μm的滤膜过滤取上清,用ICP测溶液中的Cd2+浓度,并计算解吸率。每次实验的小球用ddH2O重悬于4 ℃保存,待下次使用。
(7)
式中:mdes为解吸附Cd2+的量(mg/g);mads为吸附Cd2+的量(mg/g)。
1.6 实际废水应用
从校园内某教学楼一楼废水排放口采集一定量废水,按照2.5中探讨的固定化菌株吸附Cd2+的最佳条件,在30 ℃,200 r/min条件下培养,随时间测定废水中剩余Cd2+浓度。
2 结果与讨论
2.1 菌株的鉴定
将菌株的16S rRNA序列与数据库中的序列进行BLAST比对,由菌株的系统发育树(图1)分析可知菌株与ChryseobacteriumrhizosphaeraeRSB3-1T的同源性为99.3%,将得到的基因序列提交到GenBank,得登录号为MH014969, 长度为1480 bp的基因序列,因此确定该菌株为根际金黄杆菌属,命名为SH-1。
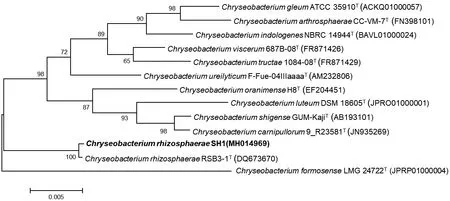
图1 SH-1 系统发育树分析
2.2 Cd2+对菌株的MIC测定
如表1所示,菌株SH-1对Cd2+表现出很强的抗性。对该菌株在不同浓度重金属离子的固体培养基中生长情况可知,其最小抑菌浓度(MIC)值为450 mg/L,表明菌株对重金属Cd的高抗性预示着它在实际应用中有很大的潜力。
2.3 菌株吸附Cd2+的形态学分析
菌株SH-1(图2-a)为杆状,无荚膜,且表面光滑饱满。添加100 mg/L的Cd2+(图2-b)后,菌株表面附有白色颗粒,与李学龙等[19]研究结果相比,进而推测出细胞表面可能有特定的结构吸附金属,且在Cd2+胁迫下,菌株SH-1通过产生该结构去除Cd2+带来的不利影响。
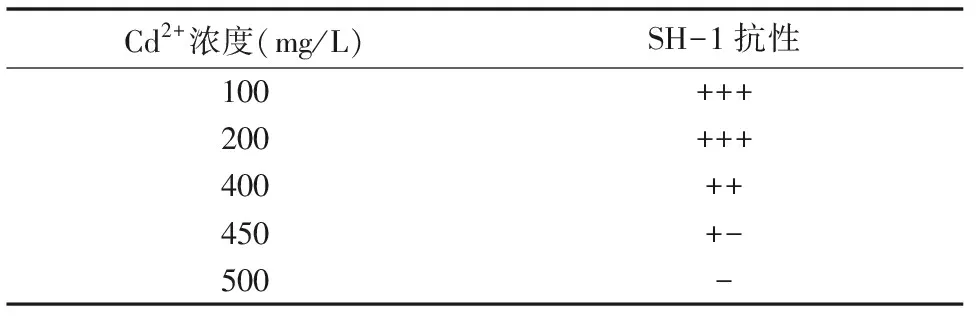
表1 菌株SH-1最小抑菌浓度测定结果
注: “+++”良好抗性;“++”较好抗性;“+-”有抗性,但生长不好,“-”无抗性

a: 对照组(标尺1 μm);b: 100 mg/L Cd2+(标尺 1 μm)
图2SH-1吸附Cd2+前后扫描电镜图
Figure 2 SEM of SH-1
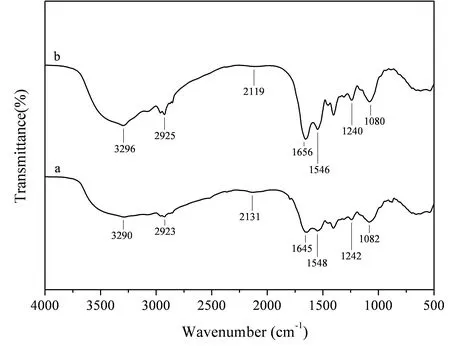
图3 SH-1吸附Cd2+ FTIR光谱分析
傅里叶红外(FTIR)分析(图3)显示菌株SH-1未吸附Cd2+前(a曲线)在3290 cm-1处具有强而宽的特征吸收峰,为典型的羟基吸收带,这是由O-H的伸缩振动和N-H的伸缩振动发生耦合作用而增宽的吸收峰;2923 cm-1处的吸收峰是由C-H的伸缩振动造成的;2131 cm-1处有N≡C-吸收峰;1645 cm-1处出现尖而短的蛋白质酰胺I带吸收峰;1548 cm-1处吸收峰是由-NO2的振动引起的;1242 cm-1处的吸收峰主要由C=S 和 P=O 键的伸缩振动引起的;1082 cm-1处的吸收峰是S-O反对称伸缩振动形成的吸收峰;菌株SH-1吸附Cd2+后的光谱图较吸附前峰形基本保持不变。3290、2923、2131、1645、1548、1242、1082 cm-1处的吸收峰分别移动到3296、2925、2119、1656、1546、1240、1080 cm-1处,菌株吸附Cd2+后(b曲线)3290、2923、1645 cm-1处的吸收强度增加,刘杨眉等[20]认为这可能是在吸附Cd2+后,菌株本身的结构未破坏,也无新的物质生成,而O-H、N-H、C-H、N≡C-、-NO2、C=S、P=O、S-O等基团可能参与了吸附作用。
2.4 不同因素对固定化SH-1吸附Cd2+的影响
由图4可知,实验组在前30 min吸附Cd2+速度快,30 min后速度变缓,480 min后达到平衡,此时吸附量为50.6385 mg/g,而对照组吸附量仅为46.9303 mg/g。
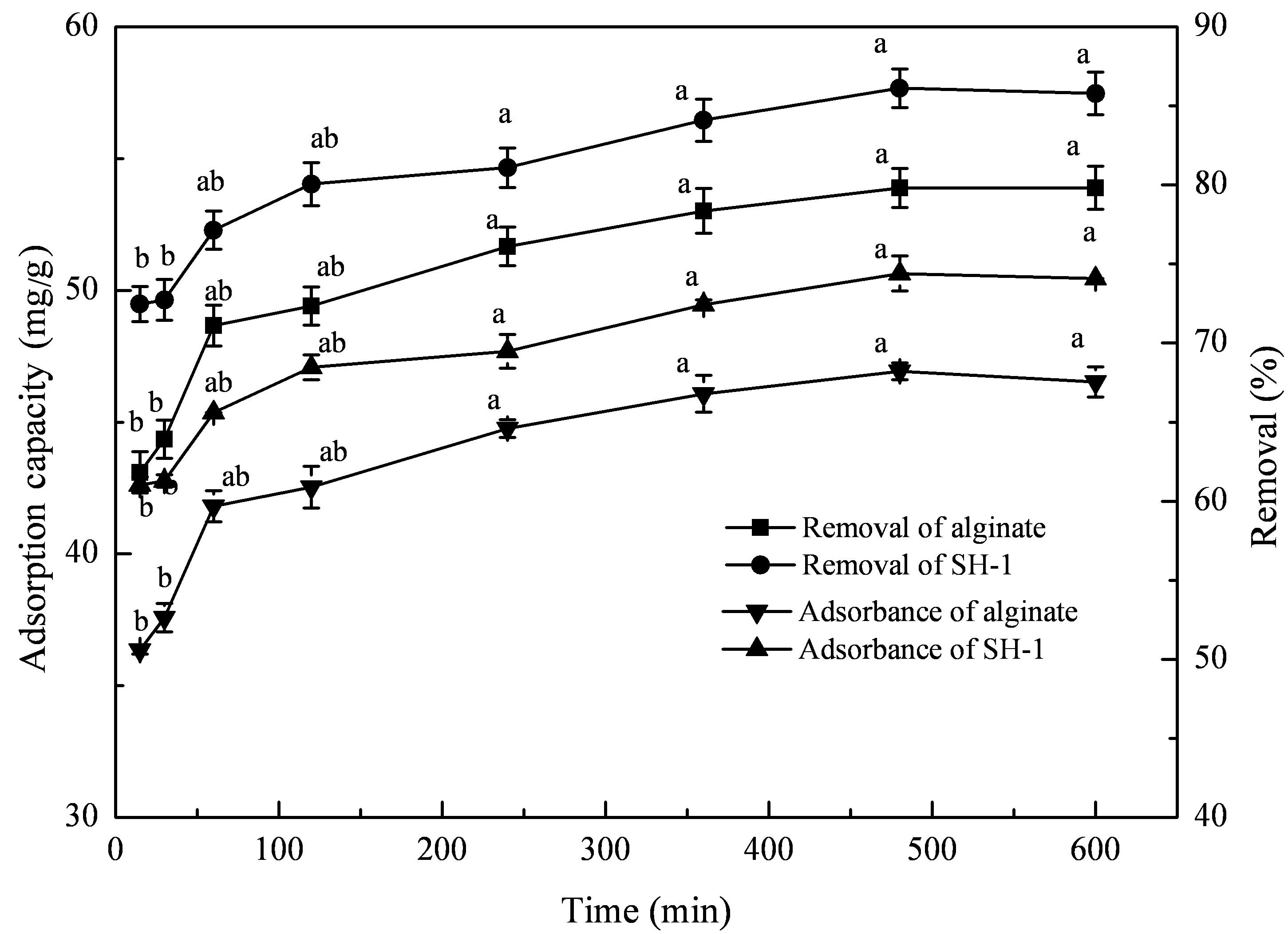
图4 吸附时间对固定化微生物吸附的影响
由图5所示,当溶液pH值由2增加到5时,实验组对Cd2+的吸附量和去除率逐渐增加,pH值由5增加到7时,吸附量和去除率则逐渐降低。由此可知,最适pH值为5。当pH值为5时,其对Cd2+的吸附量为55.238 mg/g,去除率为93.24%;对照组小球则分别为49.327 mg/g和85.14%,据文晓凤等[10]的研究可知,这可能是由于固定化微生物小球表面、孔隙均可供内生菌SH-1附着,且SH-1细胞表面的羟基能螯合转化吸附Cd2+,并对Cd2+有着一定的吸附、转化作用。
由图6可知,当Cd2+初始浓度为100 mg/L时,固定化SH-1小球对Cd2+的吸附量和去除率分别为51.485 mg/g、87.56%,而对照组小球则分别为43.667 mg/g、74.264%。当Cd2+初始浓度大于100 mg/L,SH-1小球对Cd2+的去除率逐渐下降。这与陈亚奎[21]的研究结果相一致,即随着Cd2+的浓度增加,固定化小球表面的吸附官能团与Cd2+的结合量增大,从而对其去除率降低。
综上,当反应时间为480 min,pH值为5,起始浓度为100 mg/L时,固定化SH-1小球对Cd2+的吸附率最佳,效率达93.24%,高于相关的文献报道[22]。以上结果通过t检验法证明且得出P<0.05,进而说明实验组小球相比对照组小球对Cd2+的吸附效率有显著提高。
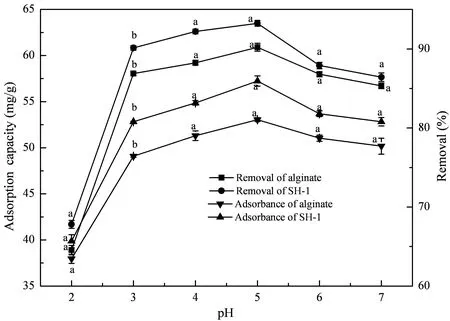
图5 pH值对固定化微生物吸附的影响
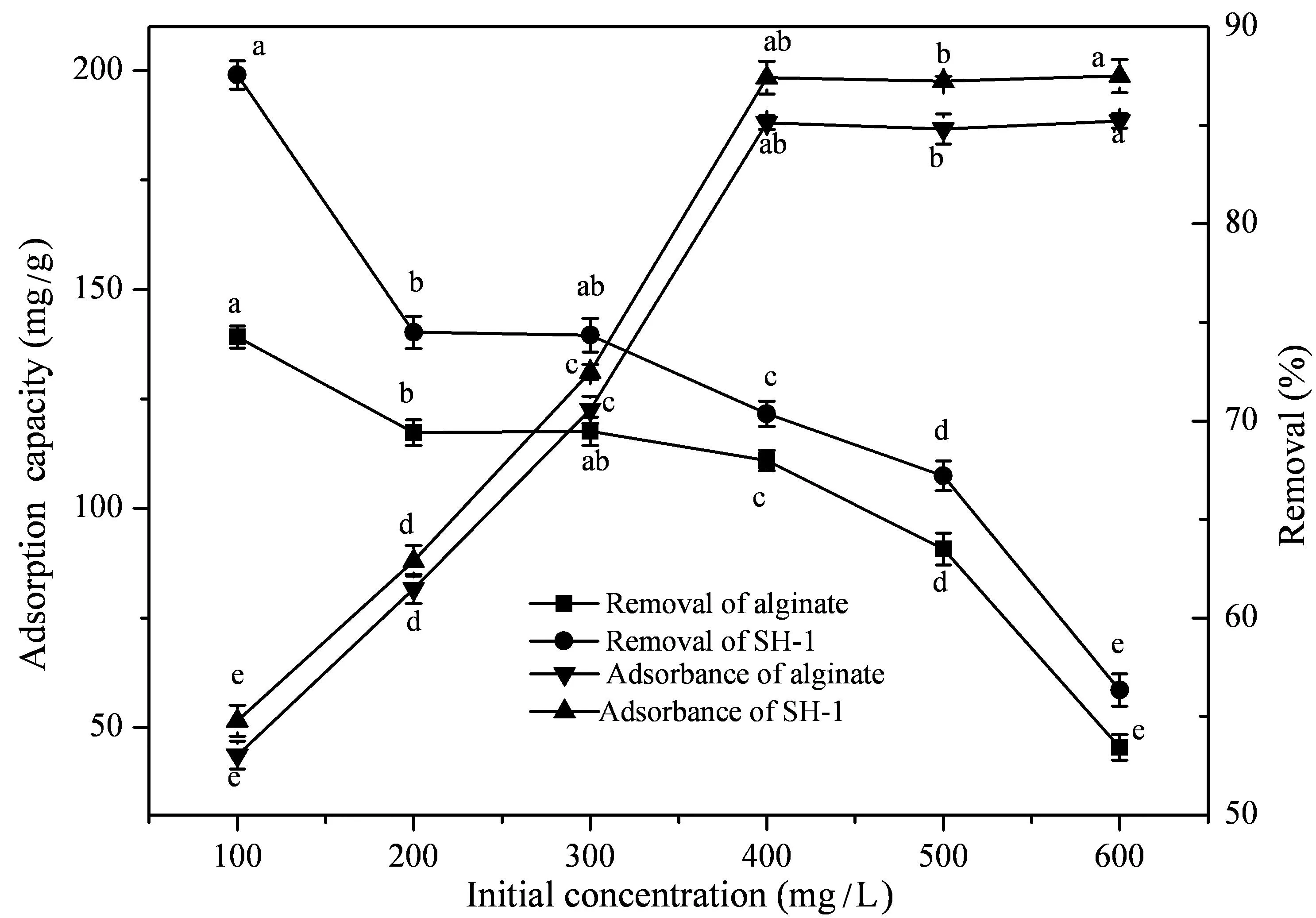
图6 Cd2+初始浓度对固定化微生物吸附的影响
2.5 固定化SH-1吸附模型
采用Langmuir和Freundlich吸附模型对Cd2+的吸附过程进行线性拟合,结果如图7-a、 b,拟合的相关参数计算见表1。固定化SH-1小球的Langmuir相关系数比Freundlich方程要高,超过了0.99。因此,Langmuir方程能更好地拟合其吸附Cd2+的过程,表明其吸附过程主要为单分子吸附。
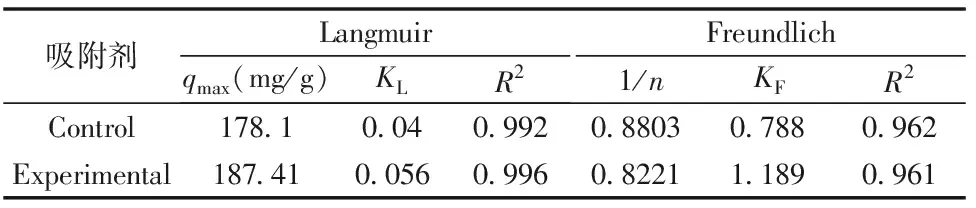
表2 固定化微生物吸附Cd2+等温参数
动力学模型分别如图7-c、 d,相关参数见表2。由表2可知,其准二级动力学系数高于准一级动力学。说明准二级动力学能更好地描述Cd2+的吸附过程,也就是化学键的形成对吸附起着重要的作用。从表2和表3看出,实验组小球的最大吸附量比对照组小球的高;进而说明实验组小球吸附Cd2+的能力要高于对照组小球。
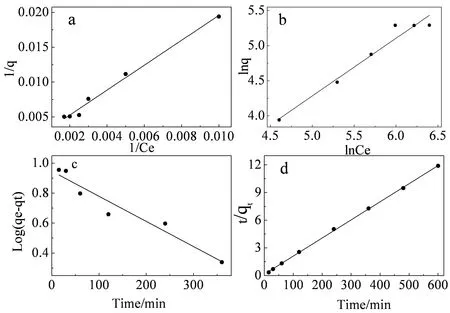
图7 固定化SH-1小球吸附Cd2+等温模型和动力学模型
2.6 固定化小球解吸附实验
此外,图8表明在3次循环之后,对照组和实验组对Cd2+的平均解吸附率分别为88.45%和95.15%;进一步说明固定化SH-1小球可高效反复地吸附水溶液中的Cd2+,能有效地循环利用;且实验组小球的解吸附能力要远高于对照组小球,实验结果与文晓凤等[10]结果一致。
2.7 实际废水应用
图9描述了固定化小球对废水中Cd2+的吸附情况。结果表明,在反应时间为480 min时,对照组和实验组对Cd2+的去除率分别为75.41%和85.95%,说固定化小球能有效去除实际废水中Cd2+,但去除率和吸附量均低于实验数值,这可能是由于实际废水中成分复杂,含有其他物质竞争吸附,进而影响吸附结果,该结果表明固定化SH-1小球在去除实际工业废水中Cd2+具有潜在的可能性。
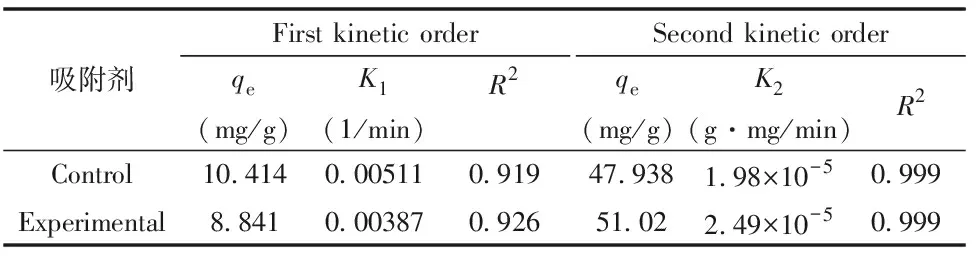
表3 固定化微生物吸附Cd2+的动力学参数
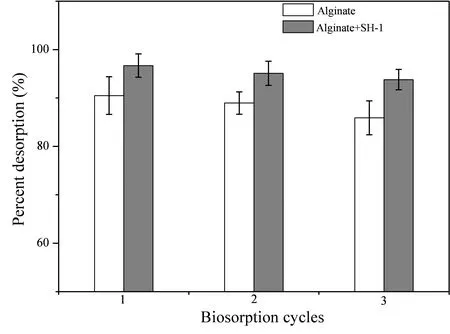
图8固定化小球对Cd2+的解吸附率
Figure 8 Percentage desorption of Cd2+by immobilized beads
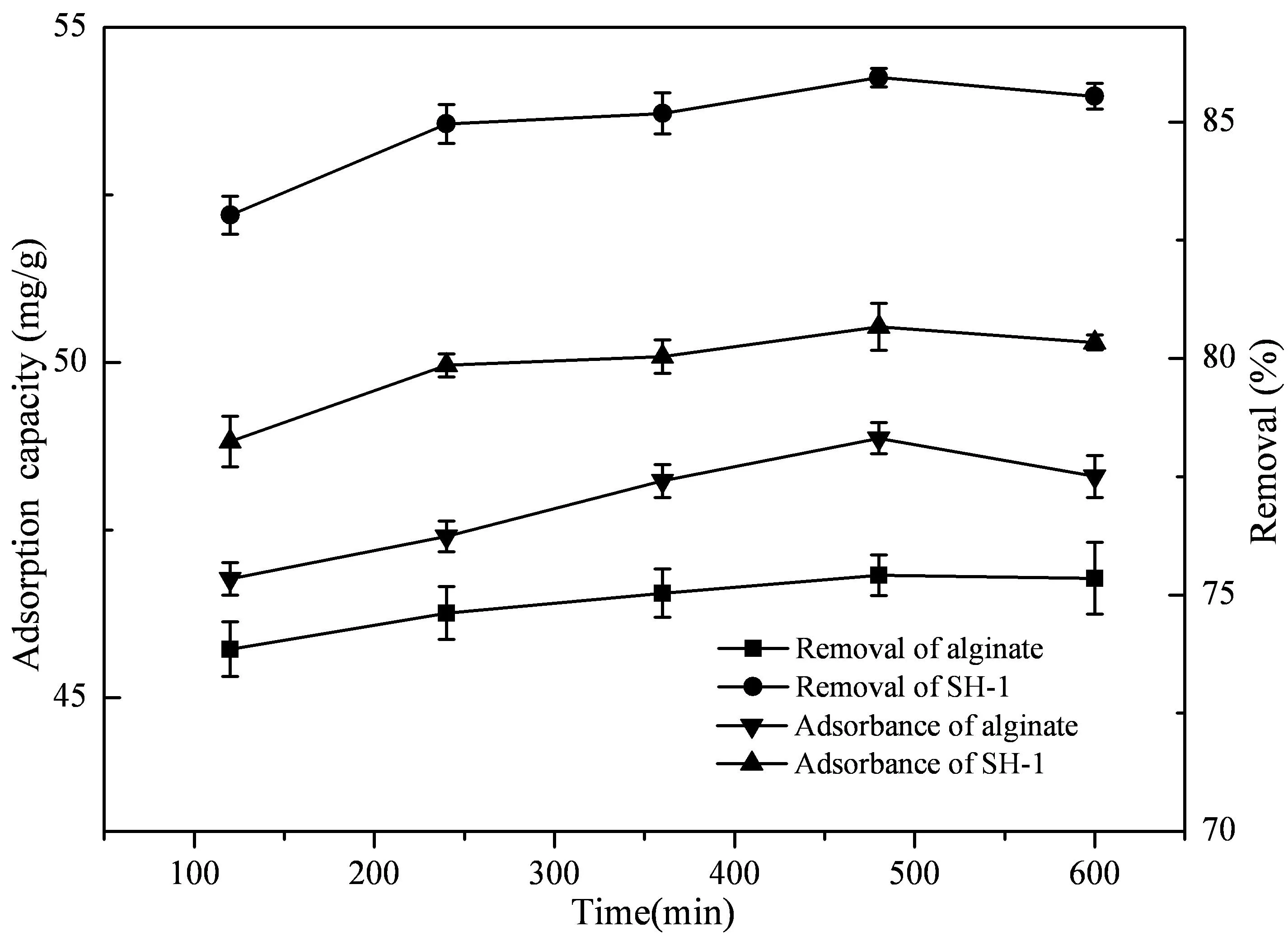
图9 固定化小球的实际废水应用
3 结论
1)在NCBI数据库中对SH-1菌株的16S rRNA基因进行BLAST同源性比对,发现其与C.rhizosphaeraeRSB3-1T的同源性为99.3%,证实该菌株为根际金黄杆菌属,将其命为C.rhizosphaeraeSH-1。
2)固定化的内生菌SH-1在Cd2+初始浓度为100 mg/L,吸附时间为480 min,溶液pH 5条件下,对Cd2+的去除率高达93.24%。
3)吸附动力学拟合结果表明,准二级动力学能较好地拟合固定化SH-1小球对重金属Cd2+的吸附过程。吸附等温模型结果表明,Langmuir模型更能准确地描述小球对Cd2+的吸附过程,其吸附过程主要为单分子吸附。
4)解吸结果表明,固定化SH-1小球可高效反复的吸附溶液中重金属离子,在3次循环之后其解吸附率仍在90%以上,且小球完好无损便于回收利用。

