细胞间隧道纳米管介导的线粒体转运诱导急性单核细胞白血病细胞抵抗凋亡的研究
徐前飞,刘亚蒙,周 震,田志祥,王丽红,胡 艳,李 静,刘晓颖,葛 健
急性髓系白血病(acute myeloid leukemia,AML)的特点是白血病细胞浸润骨髓、异常增殖和分化受阻。有50%~75%的患者对诱导化疗敏感而达到缓解,但大多数会复发,只有30%~40%的患者能实现长期生存[1],白血病细胞不能完全被药物杀灭可能与高水平的药物外排泵、有效的DNA修复以及环境介导耐药等有关[2]。肿瘤微环境中细胞间生物信息交换存在多种方式,主要通过缝隙连接、整合素蛋白、四硫蛋白、钙粘素、细胞因子、胞外囊泡等介导[3-4]。最近研究[5]发现一种新的细胞间相互作用方式—隧道纳米管(tunneling nanotubes,TNTs)或者叫膜纳米管,这些长管状结构主要由肌动蛋白和微管、微丝组成,直径在50~1 500 nm,长度可以跨越几十到数百微米,将不同细胞的质膜和胞质连接在一起,从而实现将不同细胞成分从一个细胞转运到另一个细胞,完成生物信息的直接交换。进一步研究发现细胞间TNTs能够传递包括细胞器、病原体、膜结合蛋白等[6-9]多种物质。该研究通过模拟骨髓微环境,建立体外共培养体系鉴定骨髓间充质干细胞(bone marrow mesenchymal stem cell,BM-MSCs)与急性单核细胞白血病细胞系THP-1细胞间TNTs结构,观察TNTs中线粒体的转运及其对THP-1细胞凋亡的影响,并探索细胞间线粒体转运的分子机制。
1 材料与方法
1.1 材料
1.1.1标本来源 骨髓均来自安徽医科大学第一附属医院血液内科,征得患者同意,所有实验者均签署知情同意书,骨髓结果明确诊断非白血病及其他血液系统恶性疾病。THP-1细胞购自上海中国科学院细胞库。
1.1.2主要试剂及仪器 纤连蛋白(北京索莱宝公司);MitoTracker Red CMXRos(美国Invitrogen公司);Transwell小室3 μm(美国Corning公司);Latrunculin B(美国APExBIO公司);流式细胞仪(美国Beckman Coulter公司);Annexin V-FITC/PI试剂盒(上海贝博公司);共聚焦显微镜LEICA.APA_DMI6000_DIC(德国徕卡公司);DMEM培养基、RPMI-1640培养基、FBS、胰蛋白酶(美国Gibco公司);Ficoll细胞分离液(天津TBD公司);Actin-Tracker Green 、BCA蛋白浓度测定试剂盒(上海碧云天公司);CD45-APC抗体(美国Biolegend公司);山羊抗兔生物素二抗(北京中杉金桥有限公司);KIF5B单克隆抗体(美国Abcam公司)。
1.2 方法
1.2.1细胞培养 THP-1细胞用含10%胎牛血清、100 U/ml青霉素链霉素的RMPI-1640培养基于37 ℃、5%CO2饱和湿度的培养箱中培养。
1.2.2BM-MSCs的分离、培养 肝素化骨髓取50 U/ml肝素抗凝的骨髓5 ml,加入等体积PBS细胞吹打混匀,室温1 500 r/min离心10 min,去掉脂肪层,用PBS重悬细胞,缓慢注入等体积的1.073 g/ml Percoll分离液,2 000 r/min离心20 min,吸取中间的单个核细胞层,PBS清洗2次,重悬于含10%胎牛血清的DMEM培养液中,将细胞按1×106/ml接种于培养瓶中,37 ℃培养箱培养,24 h后首次换液,以后2~3 d换液1次。待原代细胞增殖至铺满瓶底时,在0.25%胰蛋白酶消化以后以1×104/cm2接种在培养瓶中,实验中所用的间充质干细胞均为第3~5代。
1.2.3细胞爬片的制备 取干净的盖玻片清洗干净,浸泡在硫酸重铬酸钾溶液48 h后取出,自来水冲洗干净,双蒸水冲洗3次,高压灭菌备用。准备浓度为10 μg/ml纤维连接蛋白浸泡的盖玻片,于超净台中晾干后置于6孔板中;线粒体特异性探针MitoTracker Red CMXRos用无血清培养基稀释至250 nmol/L,37 ℃、5%CO2培养箱中孵育BM-MSCs(THP-1)30 min,PBS洗3次,用含10%胎牛血清的DMEM(1640)培养24 h,BM-MSCs配制成5×104/ml细胞悬液接种到有盖玻片的孔中,待贴壁后吸去培养基,用5%FBS的1640将处于对数生长期的 THP-1细胞浓度调至1×106/ml加入到接种了BM-MSCs的孔中,共培养24 h。
1.2.4细胞爬片的染色与荧光成像 将细胞爬片从培养皿中取出,用PBS溶液洗涤3次,滴加4%甲醛溶液于细胞爬片上,剂量为覆盖爬片为准,室温固定细胞10 min,PBS溶液洗涤3次,每次5 min;滴加稀释度为1 ∶100的Actin Tracker Green(Ex 496 nm,Em 516 nm)溶液于爬片上,每片200 μl,室温避光孵育40 min,PBS溶液洗涤同上;滴加200 μl DAPI(Ex 405 nm,Em 420 nm)于爬片上对细胞核复染,室温避光约2 min,封片剂DAKO封片;MitoTracker Red CMXRos(Ex 579 nm,Em 599 nm),于共聚焦显微镜下观察荧光信号分布并采集图像。
1.2.5THP-1细胞凋亡的Annexin V/PI荧光标记法检测 将P3-P5代BM-MSCs以5×104/孔接种于24孔板中,待细胞完全贴壁后,弃去培养液,取对数生长期的THP-1细胞,用10%FBS的1640重悬,以细胞密度为1×106接种于相应的孔中,共培养体系包括BM-MSCs与THP-1细胞直接共培养(SC组)、间隔Transwell透膜(物理阻断TNTs)共培养(TC组)、直接共培养体系中加入细胞松弛素Latrunculin B(TNTs抑制剂)1.25 μmol/L(LC组)、无BM-MSCs而仅有培养液(MC组)四组,共培养5 d。SC、LC组用0.25%胰蛋白酶(不含EDTA)消化、收集细胞,离心弃上清液,PBS清洗两次,用95 μl PBS重悬,加入CD45-APC抗体5 μl,避光孵20 min,离心弃上清液,再用400 μl Annexin V结合液悬浮细胞,先后加入Annexin V-FITC 5 μl、Propidium lodide10 μl,分别避光孵育15 min、5 min,进行流式细胞仪检测。采用Flowjo 7.6软件分析。
1.2.6Western blot检测蛋白的表达 用100 nmol/L Rotenone(线粒体特异性抑制剂)处理BM-MSCs 24 h或48 h;各组细胞加入蛋白酶抑制剂和裂解液的混合物,在冰上裂解30 min,4 ℃、10 000 r/min离心20 min,用BCA法检测蛋白浓度。制备SDS-PAGE凝胶,80 V(浓缩胶)/120 V(分离胶)电压对蛋白质进行分离,在100 V恒压条件下转移1.5 h。PVDF膜用TBST冲洗并浸入5%脱脂牛奶中封闭,震荡1 h。TBST洗膜3次,每次5 min,一抗(1 ∶5 000)4 ℃孵育过夜,二抗(1 ∶2 500)室温孵育1 h,ECL化学发光显像。
2 结果
2.1 鉴定BM-MSCs和THP-1细胞之间TNTs共聚焦显微镜下观察到BM-MSCs与THP-1细胞间有长管状结构形成,用荧光染料Actin-Tracker Green特异性染色,显微镜下发现这些长管状结构表达细胞骨架蛋白F-actin,提示这些管状结构即为TNTs,见图1。

图1 共聚焦显微镜下BM-MSCs与THP-1细胞间形成TNTs ×400
A:F-actin;B:细胞核;C:叠加效果; 白色箭头指的是细胞间TNTs结构
2.2 观察BM-MSCs和THP-1细胞间线粒体通过TNTs转运用Mitotracker Red CMXRos特异性标记线粒体,实验分为两组:BMSCs(MitoTracker)+THP-1、BMSCs+THP-1(MitoTracker),在标准条件下共培养24 h后制片,并用共聚焦显微镜观察。在显微镜下观察到被荧光标记的BM-MSCs线粒体通过TNTs转运到THP-1细胞中,见图2A;并未观察到THP-1细胞线粒体通过TNTs向BM-MSCs转运,见图 2B;说明线粒体是从BM-MSCs向THP-1细胞单向转运的。
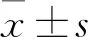
2.3 流式细胞术检测各组THP-1细胞凋亡率THP-1细胞与BM-MSCs共培养5 d后各组凋亡率比较,SC组、LC组、TC组及MC组凋亡率分别为(7.45±2.62)%、(24.03±2.3%)%、(58.34±5.73)%、(61.37±2.78)%,SC组及LC组凋亡率较MC组明显减低(P<0.01),且LC组较SC组凋亡率增高(P<0.01),提示直接共培养后THP-1细胞凋亡率减低;与SC组比较,加入TNTs抑制剂Latrunculin B(破坏部分TNTs结构,阻碍线粒体传递)后THP-1细胞凋亡率有所增高,提示直接共培养后THP-1细胞凋亡率下降可能与TNTs形成有关;TC组凋亡率较SC组及LC组明显增高(P<0.01),TC组与MC组凋亡率无差异(P>0.05);Transwell透膜物理阻断TNTs后(TC组)THP-1细胞凋亡率增高,而与THP-1细胞单独培养凋亡率无明显差异,进一步提示THP-1细胞凋亡率下降可能是由TNTs介导,而TNTs中线粒体的转运可能是其重要的组成部分。各组间差异有统计学意义(F=69.97,P<0.01),见图3。
2.4 Western blot检测KIF5B的表达水平BM-MSCs经鱼藤酮(Rotenone)分别处理24、48 h后,与对照组比较,KIF5B蛋白表达量显著降低(P<0.01),且BM-MSCs中KIF5B表达水平明显高于THP-1细胞(P<0.001),见图4。

图2 共聚焦显微镜下各组细胞间TNTs中线粒体的转运 ×400
A:BMSCs(MitoTracker)+THP-1;B:BMSCs+THP-1(MitoTracker);Actin-Tracker Green:细胞骨架F-actin;Mitotracker Red CMXRos:线粒体;DAPI:细胞核;Merge:叠加效果及局部放大后图片;白色箭头指的是沿TNTs转运的线粒体

图3 流式细胞术检测THP-1细胞凋亡
A:各组细胞流式细胞术检测结果;B:各组细胞凋亡率;与MC组比较:**P<0.01;与TC组比较:##P<0.01;与SC组比较:▽▽P<0.01

图4 Western blot法检测KIF5B蛋白表达情况
A:KIF5B(BM-MSCs);1:Control组;2:Rotenone处理24 h组;3:Rotenone 处理48 h组;与Control组比较:**P<0.01;B:KIF5B(BM-MSCs-THP-1);4:BM-MSCs组;5:THP-1组;与BM-MSCs组比较:###P<0.001
3 讨论
通过模拟骨髓微环境建立共培养体系,本研究表明BM-MSCs与THP-1细胞间能够远距离形成TNTs。以往研究[10]认为F-actin的表达是TNTs的特异性标志,本研究通过Actin-Tracker Green特异性标记F-actin,共聚焦显微镜下观察到BM-MSCs与THP-1细胞间TNTs中存在F-actin。有研究[11]证实亲脂性染料DiO、DiI可以通过TNTs双向传递。线粒体是调节细胞能量水平、代谢和凋亡的重要细胞器,可影响细胞增殖和分化。近年来,研究[12]证明线粒体产生的ATP和线粒体局部代谢途径在AML的进展中起着重要作用。本研究使用荧光标记追踪线粒体的方法证明线粒体可以通过TNTs转运,并且发现线粒体只能由BM-MSCs向THP-1细胞单向转运,而没有观察到线粒体从THP-1细胞延着TNTs向BM-MSCs转运。线粒体只能单向传递的机制尚不明确,Brickley et al[13]研究认为神经元内线粒体转运可能与Miro1、Miro2、TRAK1、KHC等蛋白相关;Babenko et al[14]研究表明Miro1可以促进线粒体从MSCs向神经细胞转运。Ahmad et al[15]研究发现Rotenone是一种特异性线粒体抑制剂,可以有效抑制BM-MSCs线粒体向内皮细胞传递。本研究用Rotenone诱导BM-MSCs,检测Rotenone诱导前、后BM-MSCs马达蛋白KIF5B的表达水平,发现Rotenone处理后KIF5B表达显著下降。并发现KIF5B在BM-MSCs中表达明显高于THP-1细胞,这符合浓度梯度动力学模型[15],这提示 KIF5B可能参与细胞间线粒体转运。
本实验同时研究了共培养系统中线粒体单向传递对THP-1细胞凋亡的影响,Transwell透膜组THP-1细胞凋亡率较直接共培养组明显增高,而与THP-1单独培养组凋亡率无明显差异;Transwell透膜通过物理阻断细胞间TNTs,切断线粒体传递,而不影响细胞因子及胞外囊泡的作用,这提示直接共培养组THP-1细胞凋亡下降可能主要受细胞间TNTs中线粒体转运影响;加入TNTs抑制剂Latrunculin B可以破坏一部分TNTs结构,阻碍部分线粒体传递,这可能与加入Latrunculin B组THP-1细胞凋亡率较直接共培养组增高有关。

