枸杞多糖对糖尿病大鼠视网膜caspase-3、Bcl-2和Bax表达的影响
王海彬 董志军 郭立涛 石晶 董微丽
(承德医学院附属医院眼科,河北 承德 067000)
糖尿病视网膜病变(DR)是糖尿病的一种严重的慢性并发症,是造成患者失明的主要原因之一〔1〕。DR的病变范围包括黄斑水肿,玻璃体腔出血与视网膜新生血管性青光眼,严重影响患者的视力。视网膜神经细胞不可逆凋亡是DR发病的直接原因。研究表明,糖尿病因高血糖激活机体的信号通路,导致体内活性氧增加,导致患者视网膜组织损伤与神经细胞凋亡〔2〕。枸杞多糖为茄科植物宁夏枸杞Lycium barbarum L.干燥成熟果实枸杞子的活性成分,具有抗氧化、抗肿瘤、调节神经、增强免疫等药理作用〔3~7〕。研究表明,枸杞多糖能够抑制糖尿病视网膜血管新生、减轻氧化应激反应及炎症反应,从而减轻线粒体病理性变化,阻止神经细胞凋亡,对视网膜病变具有一定疗效〔8~10〕。目前对枸杞多糖保护视网膜的作用机制尚未明确,对此,本研究通过观察枸杞多糖对糖尿病视网膜病变大鼠模型视网膜细胞凋亡情况、视网膜含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3、Bcl-2、Bax mRNA与蛋白表达的影响,探讨枸杞多糖对糖尿病视网膜病变的保护作用及其相关机制。
1 材料与方法
1.1动物 2月龄清洁级雄性健康SD大鼠60只,体重(180±20)g,购于河北省实验动物中心,许可证号SCXK(冀)2013-0026,适应性喂养2 w。
1.2药物 链脲佐菌素(STZ,Sigma 公司),枸杞多糖(宁夏润德枸杞产业有限公司),葡萄糖测定试剂盒(北京北化康泰临床试剂有限公司),caspase-3、Bcl-2、Bax mRNA与蛋白质测定试剂盒(上海江莱生物科技有限公司),细胞凋亡TUNEL检测试剂盒(美国Roche公司)。
1.3仪器 血糖仪(美国Roche 公司),荧光定量PCR 仪(美国赛默飞世尔科技有限公司),电泳仪(北京六一仪器厂),光学显微镜(日本Nikon公司)。
1.4实验分组及糖尿病大鼠模型的建立 根据文献方法〔11〕建立STZ糖尿病模型,大鼠禁食12 h后腹腔注射STZ 60 mg/kg。72 h后,取尾静脉血测血糖,以血糖≥16.7 mmol/L为糖尿病模型成功标准〔12〕。取造模成功大鼠随机分为模型组、枸杞多糖低、中、高剂量组,未造模大鼠作为对照组,每组12只。枸杞多糖低、中、高浓度组大鼠分别灌胃给予50 mg/kg、100 mg/kg、200 mg/kg枸杞多糖干预,对照组与模型组大鼠给予等体积的生理盐水,连续给药12 w。
1.5苏木素-伊红(HE)染色 各组大鼠处死后取眼球,置于多聚甲醛固定,梯度乙醇脱水,采用二甲苯30 min透明,置于石蜡中包埋,采用连续切片,切片厚4 μm。脱蜡后,苏木素染色3 min,冲洗后,采用1%盐酸酒精分化2 s,自来水冲洗,分别至于梯度乙醇脱水,伊红染色2 min,95%酒精分色,无水酒精脱水,二甲苯15 min透明,中性树胶封片。置于光学显微镜下观察。
1.6TUNEL染色检测神经节细胞凋亡 取大鼠眼球石蜡切片,对切片进行TUNEL染色,60℃恒温烤片120 min,脱蜡后,Proteinase K工作液37℃消化处理30 min,加入TUNEL反应混合物50 μl孵育处理60 min,过氧化物酶转化剂37℃孵育处理30 min,二氨基联苯胺(DAB)显色,苏木素复染,梯度乙醇脱水,二甲苯15 min透明,中性树胶封片。置于光学显微镜下观察,凋亡细胞的阳性细胞核呈棕褐色。计算凋亡指数(AI),AI=阳性细胞数/神经细胞总数。
1.7RT-PCR检测视网膜caspase-3、Bcl-2、Bax mRNA表达水平 取各组大鼠眼球,剥离视网膜,采用TRIzol法抽提总RNA,通过逆转录制备cDNA,聚合酶链反应(PCR)扩增cDNA。反应条件:95℃预变性2 min,95℃变性15 s,60℃退火30 s,72℃延伸45 s。caspase-3、Bcl-2、Bax引物序列:caspase-3上游5′-AATTCAAGGGACGGGTCATG-3′,下游5′-GCTTGTGCGCGTACAGTTTC-3′(164 bp);Bcl-2上游5′-CAAGAATGCAAAGCACATCC-3′,下游5′-ATCCCAGCCTCCGTTATCC-3′(255 bp);Bax上游5′-TGGAGCTGCAGAGGATGATT-3′,下游5′-CAGGGCCTTGAGCACCACTT-3′(231 bp);内参β-actin上游5′-CCTGCTTGCTGATCCACA-3′,下游5′-CTGACCGAGCGTGGCTAC-3′(115 bp)。采用琼脂糖凝胶电泳,Bio-Rad凝胶成像系统进行灰度扫描,分别记录caspase-3、Bcl-2、Bax及相应β-actin的光密度值(A),以β-actin为内参进行半定量分析caspase-3、Bcl-2、Bax mRNA表达。
1.8Western印迹法检测视网膜caspase-3、Bcl-2、Bax蛋白表达 取各组大鼠眼球,剥离视网膜组织。对视网膜组织细胞总蛋白进行RIPA裂解提取,并进行蛋白定量检测,变性,上样,电泳,转至聚偏氟乙烯膜,采用质量分数5%的脱脂奶粉封闭,加入相应抗体(1%脱脂奶粉稀释作为一抗和二抗,一抗效价比1:300,二抗效价比1∶1 000)。Ipwin 32图像分析软件分析,测定波长为450 nm,分别计算caspase-3、Bcl-2、Bax条带与β-actin条带的灰度比值,以caspase-3/β-actin、Bcl-2/β-actin、Bax/β-actin比值代表相应蛋白的表达水平。
1.9统计学方法 采用SPSS17.0软件进行单因素方差分析、t检验。
2 结 果
2.1HE染色结果 对照组大鼠视网膜膜盘结构清晰,各层细胞排列整齐;模型组大鼠视网膜部分细胞出现水肿,层次模糊,排列稀疏紊乱,膜盘间隙出现空泡样,核染色质密集,视网膜神经节细胞丰富;枸杞多糖低、中、高浓度组大鼠视网膜细胞水肿与模型组比较减轻,细胞层次清晰,排列整齐,神经节细胞数量明显减少,高浓度组大鼠视网膜改善情况显著优于中、低浓度组。见图1。
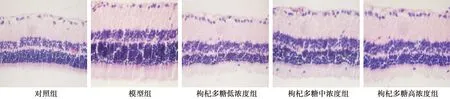
图1 各组视网膜HE染色结果(×400)
2.2各组视网膜神经细胞凋亡检测结果 对照组视网膜未发现阳性细胞;模型组视网膜大量细胞呈棕褐色,细胞AI明显高于对照组(P<0.05);枸杞多糖低浓度组视网膜发现部分阳性细胞;枸杞多糖中、高浓度组视网膜阳性细胞数和细胞AI明显低于模型组(P<0.05)。枸杞多糖中、高浓度组视网膜细胞AI明显低于枸杞多糖低浓度组(P<0.05);枸杞多糖高浓度组大鼠视网膜阳性细胞数显著低于枸杞多糖中浓度组(P<0.05)。见图2、表1。
2.3各组视网膜caspase-3、Bcl-2、Bax mRNA表达检测结果 与对照组比较,模型组视网膜caspase-3、Bax mRNA表达水平均明显升高,Bcl-2 mRNA表达水平明显降低,Bcl-2/Bax明显降低(P<0.05)。与模型组比较,枸杞多糖低、中、高浓度组caspase-3、Bax mRNA表达水平明显降低,Bcl-2 mRNA表达水平明显升高,Bcl-2/Bax明显上调(P<0.05)。枸杞多糖高、中浓度组caspase-3、Bax mRNA表达水平显著低于枸杞多糖低浓度组(P<0.05),Bcl-2 mRNA表达水平及Bcl-2/Bax显著高于枸杞多糖低浓度组(P<0.05)。见表1。

图2 各组视网膜TUNEL染色结果(×400)
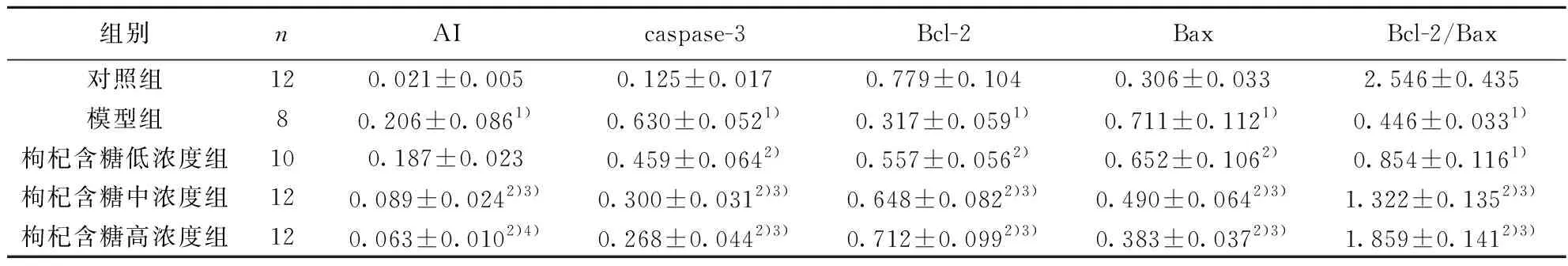
组别nAIcaspase-3Bcl-2BaxBcl-2/Bax对照组120.021±0.0050.125±0.0170.779±0.1040.306±0.0332.546±0.435模型组80.206±0.0861)0.630±0.0521)0.317±0.0591)0.711±0.1121)0.446±0.0331)枸杞含糖低浓度组100.187±0.0230.459±0.0642)0.557±0.0562)0.652±0.1062)0.854±0.1161)枸杞含糖中浓度组120.089±0.0242)3)0.300±0.0312)3)0.648±0.0822)3)0.490±0.0642)3)1.322±0.1352)3)枸杞含糖高浓度组120.063±0.0102)4)0.268±0.0442)3)0.712±0.0992)3)0.383±0.0372)3)1.859±0.1412)3)
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05;与枸杞多糖低浓度组比较:3)P<0.05;枸杞多糖中浓度组比较:4)P<0.05;下表同
2.4各组视网膜caspase-3、Bcl-2、Bax蛋白表达检测结果 与对照组比较,模型组视网膜caspase-3、Bax蛋白表达水平明显升高,Bcl-2蛋白表达水平、Bcl-2/Bax明显降低(P<0.05)。与模型组比较,枸杞多糖低、中、高浓度组caspase-3、Bax蛋白表达水平明显降低,Bcl-2蛋白表达水平明显升高,Bcl-2/Bax显著上调(P<0.05)。枸杞多糖高、中浓度组caspase-3和Bax蛋白表达较枸杞多糖低浓度组明显降低,Bcl-2蛋白表达水平及Bcl-2/Bax明显高于枸杞多糖低浓度组(P<0.05)。见表2、图3。
表2 各组视网膜caspase-3、Bcl-2、Bax蛋白表达水平

1~5:对照组、模型组、枸杞多糖低浓度组、枸杞多糖中浓度组、枸杞多糖高浓度组图3 各组视网膜caspase-3、Bcl-2、Bax蛋白表达
3 讨 论
随着糖尿病的发病率不断提高,DR作为糖尿病最常见并发症之一,是引起人类致盲的眼病,其发病率也伴随着糖尿病发病率的增高不断上升〔13〕。DR主要发生机制包括多元醇通路激活、晚期糖基化终末产物(AGEs)增加、蛋白激酶(PK)C激活与氮基己糖四条经典通路途径,最终导致视网膜神经细胞凋亡〔14〕。Caspase-3是Caspase家族目前已知的最重要的凋亡执行蛋白〔15〕。Bcl-2与Bax在视网膜病变神经细胞凋亡的过程中起重要作用,Bcl-2是目前已知的最强凋亡抑制因子,具有阻碍促凋亡基因信号传递的作用,Bax则属于促凋亡因子,二者形成异源二聚体Bcl-2/Bax抑制细胞凋亡,Bcl-2/Bax降低时更容易导致机体内细胞死亡〔16〕。
枸杞子性甘味平,归肝肾经,具有滋补肝肾、益精抗衰、润肺明目、强筋健骨的功效,枸杞多糖为枸杞子的主要活性成分。药理学研究表明,枸杞多糖能够提高机体超氧化物歧化酶(SOD)等抗氧化因子表达,降低机体丙二醛(MDA)含量水平,增强机体抗氧化能力及清除氧化产物的能力,防止氧化应激损伤胰岛细胞并促进其再生,起降糖作用〔17〕。枸杞多糖对DR具有改善作用,能够通过延迟整流钾电流的幅度防止神经细胞凋亡,并且可通过拮抗糖基化终产物的增殖毒性,降低视网膜细胞因子的表达,减少细胞损伤〔18,19〕。通过本研究病理学检测发现,糖尿病视网膜病变导致细胞水肿、膜盘间隙增大等,并且会引起神经细胞凋亡的发生。枸杞多糖具有改善视网膜细胞水肿,保护视网膜神经细胞凋亡的作用。枸杞多糖通过降低糖尿病大鼠视网膜caspase-3、Bax mRNA与蛋白的表达水平,提高凋亡抑制因子Bcl-2 mRNA和蛋白的表达水平,上调Bcl-2/Bax,防止视网膜神经细胞凋亡,这可能是枸杞多糖对DR的保护作用机制。

