水芹总酚酸体外抗HBV作用及其机制探讨
刘青川 王盼丽 杨新波 王仁杰 王蒙蒙 黄正明
[摘要] 目的 觀察水芹总酚酸体外对乙型肝炎病毒(HBV)的抑制作用并探讨其作用机制。 方法 水芹总酚酸对Hep AD38细胞的毒性实验分为水芹总酚酸组(细分为1600、800、400、200、100 μg/mL浓度组)和空白对照组。体外培养Hep AD38细胞,用MTT法检测水芹总酚酸的毒性范围。水芹总酚酸体外抗HBV作用实验分为水芹总酚酸组(细分为200、100、50、25 μg/mL浓度组)、阳性对照组[恩替卡韦(ETV) 10 μmol/L]和病毒对照组。用无毒浓度以下的水芹总酚酸药液处理Hep AD38细胞,连续6 d,收取上清和细胞,酶联免疫吸附测定(ELISA)法检测上清中HBsAg、HBeAg滴度;实时荧光定量PCR方法检测细胞内HBV DNA载量。水芹总酚酸对鸭乙型肝炎病毒(DHBV)DNA聚合酶的影响实验分为水芹总酚酸组(细分为400、200、100、50、25 μg/mL浓度组)、阴性对照组和DHBV DNA聚合酶对照组。从感染鸭乙肝病毒的鸭肝中提取DHBV DNA聚合酶,分别给予不同浓度水芹总酚酸药液,采用ELISA法检测水芹总酚酸对DHBV DNA聚合酶活性的影响。 结果 水芹总酚酸对Hep AD38细胞的无毒浓度为400 μg/mL。与病毒对照组比较,水芹总酚酸组中的200、100、50 μg/mL浓度组的HBsAg、HBeAg滴度和HBV DNA载量均明显降低,差异有高度统计学意义(P < 0.01);与DHBV DNA聚合酶对照组比较,水芹总酚酸组中的400、200、100 μg/mL浓度组可抑制DHBV DNA聚合酶活性,差异有高度统计学意义(P < 0.01)。 结论 水芹总酚酸体外具有良好的抗HBV作用,其作用机制包括抑制HBV DNA聚合酶的活性。
[关键词] 水芹总酚酸;Hep AD38细胞;乙型肝炎病毒;乙肝病毒DNA聚合酶
[中图分类号] R965 [文献标识码] A [文章编号] 1673-7210(2019)10(a)-0012-06
Study on anti-HBV effect of total phenolics acid from Oenanthe Javanica in vitro and its mechanism
LIU Qingchuan1 WANG Panli2 YANG Xinbo1 WANG Renjie1 WANG Mengmeng1 HUANG Zhengming1
1.Beijing Weijian Jiye Institute of Biotechnology, Beijing 100039, China; 2.Department of Pharmacy, People′s Hospital of Shigatse, Tibet Autonomous Region, Xigaze 857000, China
[Abstract] Objective To observe the inhibitory effect of total phenolics acid from Oenanthe Javanica on hepatitis B virus (HBV) in vitro and explore its mechanism. Methods The toxicity of total phenolics acid from Oenanthe Javanica to Hep AD38 cells was divided into the total phenolics acid from Oenanthe Javanica group (subdivided into 1600, 800, 400, 200, 100 μg/mL concentration groups) and the blank control group. Hep AD38 cells were cultured in vitro and the toxicity range of total phenolics acid from Oenanthe Javanica was determined by MTT assay. In vitro anti-HBV effects of total phenolics acid from Oenanthe Javanica were divided into the total phenolics acid from Oenanthe Javanica group (subdivided into 200, 100, 50 and 25 μg/mL concentration groups), the positive control group [Entecavir (ETV) 10 μmol/L] and the virus control group. Hep AD38 cells were treated with total phenolics acid from Oenanthe Javanica solution with a concentration below the non-toxic concentration for 6 consecutive days. The supernatant and cells were collected. The titer of HBsAg and HBeAg in the supernatant was detected by enzyme linked immune sorbent assay (ELISA). The intracellular HBV DNA load was detected by real-time fluorescent quantitative PCR. The effects of total phenolics acid from Oenanthe Javanica on duck hepatitis B virus (DHBV) DNA polymerase were divided into the total phenolics acid from Oenanthe Javanica group (subdivided into 400, 200, 100, 50 and 25 μg/mL concentration groups), the negative control group and the DHBV DNA polymerase control group. DHBV DNA polymerase was extracted from duck liver infected with duck hepatitis B virus, different concentrations of total phenolics acid from Oenanthe Javanica solution were given, and the effects of total phenolics acid from Oenanthe Javanica on DHBV DNA polymerase activity were detected by ELISA. Results The non-toxic concentration of total phenolics acid from Oenanthe Javanica in Hep AD38 cells was 400 μg/mL. Compared with the virus control group, HBsAg, HBeAg titer and HBV DNA load were significantly decreased in the 200, 100 and 50 μg/mL concentration groups of the total phenolics acid from Oenanthe Javanica group, the differences were highly statistically significant (P < 0.01). Compared with the DHBV DNA polymerase control group, DHBV DNA polymerase activity was inhibited in the 400, 200, and 100 μg/mL concentration groups of the total phenolics acid from Oenanthe Javanica group, the differences were highly statistically significant (P < 0.01). Conclusion Total phenolics acid from Oenanthe Javanicahas a good anti-HBV effect in vitro, and its mechanism includes inhibition of HBV DNA polymerase activity.
[Key words] Total phenolics acid from Oenanthe Javanica; Hep AD38 cells; Hepatitis B viral; Hepatitis B viral DNA polymerase
乙型肝炎是由乙型肝炎病毒(HBV)引起的可能威胁生命的肝脏感染,可分为急性乙型肝炎和慢性乙型肝炎,是全世界引起肝炎性死亡人数最多的疾病。据2017年WHO发布的《全球肝炎报告》数据显示,2015年全球有2.57亿乙肝病毒感染者,占世界人口的3.5%,其中乙型肝炎导致88.7万人死亡,大多死于并发症(包括肝硬化和肝细胞癌)。虽然这一系列数字较往年有下降趋势,但乙型肝炎仍是一个严重的全球卫生问题。
作为传统医学,中药用于治疗乙型肝炎有着两千多年的历史,多部著名医药典籍中均有收录对于治疗乙型肝炎效果确切的中草药,其中水芹就出自《本草纲目》,近代药理学研究也发现其具有很好的抗肝炎作用[1]。水芹总酚酸是从水芹全草中提取,经过多年的研究发现,水芹总酚酸对乙肝病毒具有稳定的抑制作用,可降低Hep G2.2.15细胞上清中乙肝表面抗原(HBsAg)、乙型肝炎病毒e抗原(HBeAg)的滴度,抑制细胞内HBV DNA的复制[2-3]。体内实验发现水芹总酚酸可有效抑制鸭血清中鸭乙型肝炎病毒(DHBV)DNA的复制,且停药后无反跳现象[4]。此外,水芹总酚酸还具有保肝降酶和退黄的作用[5]。由此可见,水芹总酚酸治疗乙型肝炎的临床开发前景可观。本研究采用Hep AD38细胞模型来验证水芹总酚酸抗HBV活性,建立DHBV DNA聚合酶活性的检测方法,并通过检测DHBV DNA聚合酶的活性探讨其抗HBV的作用机制。
1 材料与方法
1.1 实验细胞和动物
Hep AD38细胞是人肝细胞肿瘤细胞系,在四环素的调控下产生HBV。北京麻鸭,1~2日龄,购自北京前进种鸭场,饲养于解放军总医院第五医学中心SPF级实验动物中心,清洁级别为普通级,笼具用过氧乙酸溶液消毒,饮用水为消毒水,室溫恒为25℃,相对湿度为40%~70%。
1.2 主要试剂和仪器
水芹总酚酸,北京卫健基业生物技术研究所提取精制(批号:20180312);恩替卡韦(ETV),解放军总医院第五医学中心肝衰竭研究室馈赠;DME/F-12(HyClone,货号:SH30023.01);FBS(Corning,货号:35-010-CVR);MTT(AMRESCO,货号:0793);QuickExtract DNA Extraction Soln 1.0提取液(美国Epicentre);HBV DNA TaqMan荧光定量检测试剂盒(北京巴奥瑞生物科技有限公司,批号:20180512);HBsAg、HBeAg酶联免疫试剂盒(北京科华生物技术有限公司,批号:201708151);牛血清白蛋白(BSA)(AMRESCO,货号:0332);Bio-dUTP,上海生工合成;dTTP,Oligo(dT)15及其他相关引物,大连宝生物合成;碱磷酶标记链亲合素(APS)(北京中杉金桥生物技术有限公司);BCA蛋白含量测定试剂盒(Pierce公司,货号:23228);EDC(J&K公司);DTT、poly A、PNPP(Sigma)。二氧化碳培养箱,美国Thermo公司;96孔细胞培养板,美国Corning公司;倒置显微镜,日本Olympus公司;低温高速离心机,美国Thermo公司;实时电子分析天平,上海天平仪器厂;酶联仪,美国Bio-RAD公司;生物安全柜,美国Thermo公司;实时荧光定量PCR仪 SLAN 8.0,上海宏石医疗科技有限公司;NH微孔板,Nunc公司;漩涡混匀器,海门市其林贝尔仪器制造有限公司;恒温水浴锅,Grant公司;智能超速离心机,美国Beckham公司。
1.3 实验分组及处理
①水芹总酚酸对Hep AD38细胞的毒性实验分为水芹总酚酸组(细分为1600、800、400、200、100 μg/mL浓度组,同时由于水芹总酚酸本身呈褐色,每个浓度药液设1个本底对照孔)和空白对照组;②水芹总酚酸体外抗HBV作用实验分为水芹总酚酸组(细分为200、100、50、25 μg/mL浓度组),阳性对照组(ETV 10 μmol/L)和病毒对照组;③水芹总酚酸对DHBV DNA聚合酶的影响实验分为水芹总酚酸组(细分为400、200、100、50、25 μg/mL浓度组),阴性对照组和DHBV DNA聚合酶对照组。
1.4 观察指标及检测方法
1.4.1 水芹总酚酸对Hep AD38细胞毒性的影响
Hep AD38细胞接种至96孔板中,分别给予各浓度组别的药液,每孔0.2 mL,每浓度3孔,同法设置培养液空白对照组。给药3 d,每孔加入5 mg/mL MTT 20 μL,孵育6 h后,吸出培养液,沉淀用二甲基亚矾(DMSO)溶解,于490 nm处检测吸光度。
1.4.2 水芹总酚酸对Hep AD38细胞内HBV-DNA及上清分泌HBsAg、HBeAg含量的影响
Hep AD38细胞计数达到2×105个细胞/mL时,接种至96孔板中,待细胞贴壁后分别给予各浓度组别的药液,每孔0.2 mL,每浓度3孔,同法设置阳性对照组(ETV 10 μmol/L)和病毒对照组(培养液)。给药第3天换同浓度药液;给药第6天收集细胞和上清。上清液用酶联免疫吸附测定(ELISA)实验检测试剂盒检测HBsAg和HBeAg的含量;细胞用DNA快速提取液抽提总DNA,采用HBV DNA TaqMan荧光定量检测试剂盒检测细胞内HBV-DNA表达量。PCR体系:待测样本3 μL,HBV-PCR反应液(OT)30 μL,HBV酶混合物1.5 μL。PCR反应程序:尿嘧啶-DNA糖基化酶(UDG酶)反应37℃ 2 min→95℃ 3 min→[95℃ 10 s→60℃ 35 s(45个循环)]→25℃ 10 s。
1.4.3 水芹总酚酸对DHBV DNA聚合酶活性的影响
1.4.3.1 DHBV DNA聚合酶的提取 雏鸭注射DHBV病毒强阳性血清,7 d后取肝,肝匀浆之后利用蔗糖浓度梯度法纯化获得DHBV DNA聚合酶,提取流程如下:取感染DHBV的鸭肝,匀浆;11 000 r/min,4℃离心30 min后取上清;上清45 000 r/min,4℃,离心3 h得到沉淀物;沉淀物用蔗糖浓度梯度离心,按不同的蔗糖浓度分层取出液体;各部分45 000 r/min,4℃,离心10 h得到沉淀,提取物放入-80℃保存。
1.4.3.2 DHBV DNA聚合酶活性检测 将通用引物Oligo(dT)15溶于100 mmol/L的1-甲基-咪唑的盐酸缓冲液中,加入96孔NH酶标板中,与水溶性碳化二亚胺混匀,于50℃水浴中反应4 h,反应结束后用洗液(50 mmol/L Tris-HCl,pH 7.5)洗三遍,除去未结合的Oligo(dT)15,将包被后的96孔板置于4℃保存。实验设水芹总酚酸各浓度药液、DHBV DNA聚合酶对照组和阴性对照液。水芹总酚酸各浓度药液分别加入到用磷酸缓冲盐液(PBS)洗过的96孔培养板中,每孔10 μL(DHBV DNA聚合酶对照组和阴性对照液组以PBS代替),每浓度3孔,然后加入每孔70 μL的RT Buffer[含poly(A)、dTTP、bio-dUTP],每孔20 μL的含DHBV聚合酶的PBS溶液(阴性对照液组以PBS代替),使反应系统总体积为100 μL。37℃水浴反应1 h,Washing buffer洗板3次,除去未结合的游离底物,再每孔加入100 μL 1% BSA,室温封闭1 h,Washing buffer洗板3次。每孔加入50 μL的SA-ALP稀释液(100 ng/mL),37℃水浴1 h,洗板后,每孔再加入100 μL PNPP(1 mg/mL),37℃水浴30 min;每孔50 μL加入1 mol/L的NaOH终止反应,酶标仪测定405 nm波长处吸光度(OD)值,计算化合物在该浓度的抑制率,以确定化合物对DHBV聚合酶的抑制活性。用Reed-Meuench公式计算半抑制浓度(IC50)。
1.5 统计学方法
采用SPSS 17.0对所得数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多組间比较采用单因素方差分析,组间两两比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 水芹总酚酸对Hep AD38细胞的毒性作用
本实验中,由于水芹总酚酸给药浓度过高会出现析出现象,故将最高给药浓度定为1600 μg/mL。检测结果发现,水芹总酚酸各浓度组扣除本底后,与空白对照组比较,1600 μg/mL浓度组对细胞生长有一定的抑制作用,抑制率为35.62%,其余各浓度组未发现明显的抑制作用,抑制效果呈现量效关系。结果表明,水芹总酚酸对Hep AD38细胞的毒性较低,半数毒性浓度(TC50)>1600 μg/mL,最大无毒浓度(TC0)为400 μg/mL。见表1、图1。
2.2 水芹总酚酸对Hep AD38细胞抗HBV的影响
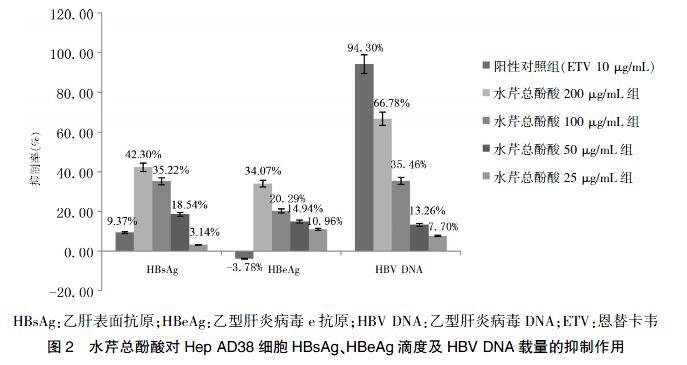
根据水芹总酚酸对Hep AD38细胞的毒性结果,将其药效学实验的最高浓度设为200 μg/mL。试验结果发现,水芹总酚酸给药第6天时,可以降低Hep AD38细胞上清中HBsAg、HBeAg滴度,200、100、50 μg/mL水芹总酚酸组与病毒对照组比较,差异有高度统计学意义(P < 0.01),25 μg/mL水芹总酚酸组与病毒对照组比较,差异有统计学意义(P < 0.05)。用标准品质粒PCP10作HBV-DNA扩增曲线和标准曲线,实时荧光定量PCR检测细胞内HBV-DNA载量。结果显示,水芹总酚酸各剂量组在给药6 d后,可以有效地抑制细胞HBV-DNA的复制,200、100、50 μg/mL浓度组与病毒对照组比较,差异有高度统计学意义(P < 0.01),量效关系明显。见表2、图2。
2.3 水芹总酚酸对DHBV DNA聚合酶活性的影响
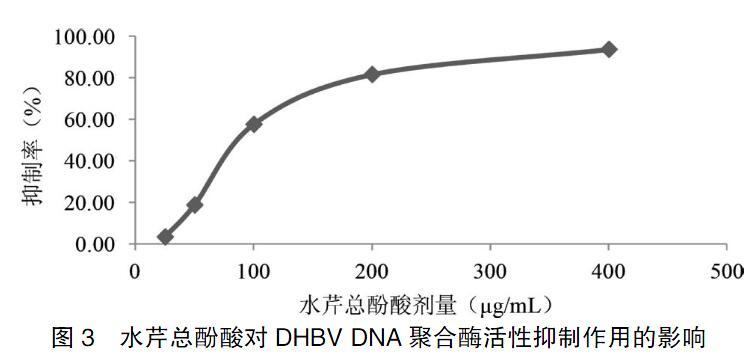
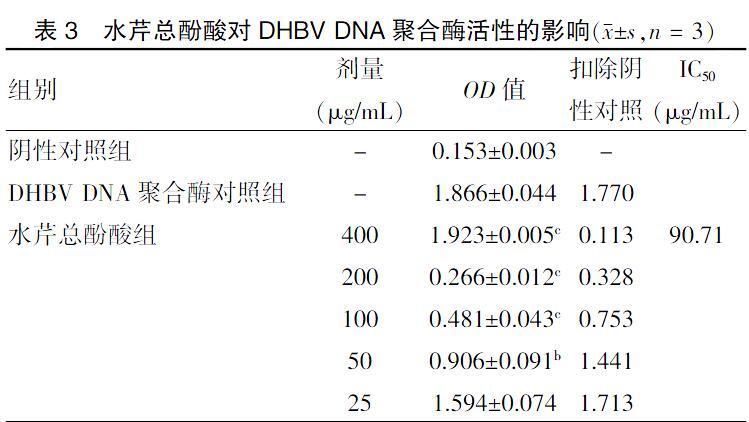
水芹总酚酸对DHBV聚合酶有显著的抑制作用。抑制率随着药物浓度的增大而升高,400、200、100 μg/mL水芹总酚酸组对DHBV聚合酶的平均抑制率分别为93.62%、81.51%、57.50%,呈现明显的量效关系,与DHBV DNA聚合酶对照组比较,差异有高度统计学意义(P < 0.01)。见表3、图3。
注:与DHBV DNA聚合酶对照组比较,bP < 0.05,cP < 0.01。DHBV DNA:鸭乙型肝炎病毒DNA;IC50:半抑制浓度。“-”表示无数据
3 讨论
水芹总酚酸作为水芹生药中提取的有效部位,具有稳定的提取工艺和质量控制方法。其粗略提取流程为:水芹全草经乙醇加热回流,放冷过滤,加压回收溶剂得浸膏,浸膏以热蒸馏水溶解过滤,得到的水溶液在聚酰胺柱上以乙醇洗脱,收集洗脱液并减压浓缩,真空干燥得水芹总酚酸提取物。用Folin-酚法[6]作为水芹总酚酸中总酚酸物质和其代表成分绿原酸的质量控制方法,测定结果发现总酚酸含量>50%,绿原酸含量约为7%。
病毒的生命周期包含吸附、穿入、脱壳、生物合成及装配分泌等阶段,每个阶段都有相应的药物阻断靶点[7]。近年来抗HBV药物机制研究较多的靶点有病毒侵入阶段的钠离子-牛磺胆酸协同转运蛋白(NTPC)[8],病毒合成阶段的共价闭合环状DNA(cccDNA)、HBV DNA聚合酶[9]、前基因组RNA(pgRNA)[10]、siRNA,病毒装配阶段的核心蛋白[11]以及一些调控蛋白等。水芹总酚酸在之前的研究中已经明确了其抗HBV的活性,但是没有对其作用机制进行研究。本试验选用Hep AD38细胞,可以在观察受试物抗HBV作用活性的同时间接反映出其抗HBV的作用位点,可能为抑制HBV复制周期中的特定步骤或是抑制负责pgRNA转录的诱导型启动子[12]。体外结果提示,水芹总酚酸具有良好的抗HBV活性,作用持久稳定,推测其作用靶点可能是抑制HBV复制周期中的特定步骤。本课题组在对水芹总酚酸抗艾滋病(HIV)的研究中发现其可通过抑制逆转录酶的活性阻止HIV复制,而现今临床常用抗HBV的核苷类似物,其最初的研究方向也是抗HIV,后因发现其可通过抑制HBV DNA聚合酶的活性阻止HBV的复制[13],将研发重点转到了HBV领域。此外,HBV DNA聚合酶具有多重功能域,在参与完成HBV DNA合成以及RNA模板降解过程中起重要作用,筛选靶向HBV DNA聚合物的药物可有效阻断HBV生命周期[14-16]。综上考虑,本课题组对水芹总酚酸抗HBV的作用机制重点放在对HBV DNA聚合酶活性的研究。
近年来,HBV DNA聚合酶的检测方法主要是用同位素标记,以液闪仪测定同位素放射性度(CPM)[17-19]。由于同位素具有很强的放射性,对人体产生很大的辐射作用,国家对其使用把控严格,且对实验室要求较高,不适用于一般科研单位,从而限制了广大科研工作者的相关研究。目前尚未有文献报道利用非同位素标记法测定DHBV DNA聚合酶活性。本研究所同北京大学医学部药学院共同研究,参考其对HIV-1逆转录酶的活性测定方法[20],建立了非同位素标记测定DHBV DNA聚合酶活性的方法[21](专利申请号:201810302359.2)。其测定原理为:利用NH微孔板,将Oligo(dT)15引物固定到模板上,通过DHBV DNA聚合酶的活性反应将dTTP和bio-dUTP连接到Oligo(dT)15相连的poly(A)上,利用免疫反应再将碱性磷酸酶连接上去,最后通过化学发光底物PNPP反应使体系显色。经验证该检测方法,检测灵敏度更高,方法稳定,且更加简单方便。本研究通过ELISA检测出水芹总酚酸对HBV DNA聚合酶的IC50为90.71 μg/mL,表明水芹总酚酸是一种作用较强的HBV DNA聚合酶抑制剂。
综上所述,水芹总酚酸作为一种抗病毒的中药五类新药,对乙型肝炎、艾滋病、白血病等病毒的抑制作用明确且稳定,结合其对HBV DNA聚合酶和HIV逆转录酶均具有较强的抑制作用[22-23],可推测水芹总酚酸是一种广谱抗病毒的酶抑制剂,具有较高抗病毒药物研究的价值。
[参考文献]
[1] 黄正明,杨新波,曹文斌.水芹的本草考证[J].中草药,2001,32(1):59-62.
[2] 王选举,黄正明,杨新波,等.水芹总酚酸对2.2.15细胞HBV DNA、cccDNA的抑制作用[J].中国药理学通报,2009, 25(8):1099-1102.
[3] 王选举,黄正明,杨新波,等.水芹总酚酸对2.2.15细胞分泌HBsAg与HBeAg的抑制作用[J].解放军药学学报,2009,25(2):148-151.
[4] 王选举,黄正明,杨新波,等.水芹总酚酸对鸭乙肝病毒DNA的抑制作用[J].解放军药学学报,2009,25(6):501-505.
[5] Ai G,Huang ZM,Liu QC,et al. The protective effect of total phenolics from Oenanthe Javanica on acute liver failure induced by D-galactosamine [J]. J Ethnopharmacol,2016,186:53-60.
[6] 田丹,陳劲春,杨新波,等.水芹总酚酸胶囊质量控制方法的研究[J].解放军药学学报,2010,26(4):328-331.
[7] 赫晓林,黄建炜,许瑞安,等.HBV病毒复制机制及慢性乙型肝炎药物靶点[J].中国药理学通报,2015,31(2):152-156.
[8] Fukano K,Tsukuda S,Watashi K,et al. ConceptofViralInhibitorsviaNTCP [J]. Semin Liver Dis,2019,39(1):78-85.
[9] Tang L,Sheraz M,McGrane M,et al. DNA Polymerase alpha is essential for intracellular amplification of hepatitis B virus covalently closed circular DNA [J]. PLoS Pathog,2019,15(4):e1007742.
[10] 叶雨笙,朱紫衣,刘晨霞,等.红景天苷对HepG2.2.15细胞HBV DNA复制的影响及机制研究[J].安徽医科大学学报,2019,54(4):539-543.
[11] Li Y,Sun Y,Sun F,et al. Mechanisms and Effects on HBV Replication of the Interaction between HBV Core Protein and Cellular Filamin B [J]. Virol Sin,2018,33(2):162-172.
[12] King RW,Ladner SK. Hep AD38 Assay:A High-Throughput, Cell-Based Screen for the Evaluation of Compounds Against Hepatitis B Virus [J]. Methods Mol Med,2000, 24:43-50.

