几种三叶青组织培养快繁体系的比较及其优化
洪春桃,沈登锋,魏斌,章建红
(宁波市农业科学研究院 林业研究所,浙江 宁波 315040)
三叶青(Tetrastigmahemsleyanum),中文学名为三叶崖爬藤,又名蛇附子、石抱子、金线吊葫芦、三叶对、小扁藤、三叶扁藤、拦山虎、雷胆子等,药名为三叶青,是葡萄科崖爬藤属多年生蔓生藤本植物,为中国特有珍稀中药植物[1-2]。临床上已逐步用于肝癌、肺癌、白血病与艾滋病等疾病的治疗,被称为安全无毒的“植物青霉素”[3]。由于人为过度采挖,三叶青野生资源锐减,已处于濒危状态[1, 4],因此,开展三叶青的组织快繁技术研究十分重要。许多研究人员进行了一定的初步研究,但是目前已报道的三叶青组织快繁体系中外植体选择、灭菌方式、培养基配方和预期效果等都各不相同,给种植户和研究人员在选择三叶青组织培养方法时带来较多不便。笔者通过文献检索筛选得到11种不同的三叶青的组织培养快繁技术体系,从外植体选择、灭菌、腋芽诱导、愈伤组织诱导、丛生芽增殖和不定根诱导等方面对这11种体系进行评价和优化,以期建立一种最佳的三叶青组织快繁的技术体系,为今后三叶青组织培养的快速繁殖体系提供科学依据。
1 材料与方法
1.1 材料和培养条件
实验材料为宁波市农业科学研究院在鄞州区横溪镇大岙村栽培的三叶青种苗,2017年5月采集嫩叶和腋芽茎段带回实验室组培室进行组织培养试验。组培室培养温度为(25±2)℃,光周期为12 h∶12 h(光/暗),光照强度为4 000 lx。
1.2 方法
1.2.1 外植体灭菌
综合归纳不同文献的试验方法,筛选出3种外植体灭菌方式进行三叶青外植体的灭菌试验,每组处理具体方法如下:处理1,选择剪成块状的叶片与1~2 cm带腋芽茎段作为外植体,流水冲洗3~4 h,75%乙醇浸泡1 min,含2~3滴吐温20的0.1% HgCl215 min(40~50 r·min-1摇床振荡消毒),MS培养基中加入1 mg·L-1氨苄、0.3 g·L-1真菌抑菌剂[5];处理2,选择剪成块状的叶片与1~2 cm带腋芽茎段作为外植体,流水冲洗30~60 min,70%乙醇浸泡1 min,含2~3滴吐温20的0.1% HgCl2浸泡15 min,期间轻摇晃,无菌水清洗5次,无菌滤纸吸干水分,切去处理后茎段的两端[6];处理3,选择剪成块状的叶片与1~2 cm带腋芽茎段作为外植体,再用5%洗衣粉水溶液漂洗5 min,再用自来水冲洗30 min,75%乙醇擦洗表面,0.1% HgCl2消毒5 min,2%次氯酸钠消毒20 min,无菌水冲洗4~6次,再将茎段切成0.5~1.0 cm的小段,叶片剪成0.5 cm×0.5 cm的块状[7]。每个处理叶片设5个重复,每个重复20片,共100片。每个处理茎段设3个重复,每个重复10个,共30个带腋芽茎段,接种7 d后统计污染情况。
1.2.2 腋芽诱导
筛选5种文献报道的腋芽诱导培养基,采用灭菌腋芽茎段进行腋芽诱导试验,具体培养基配方如下:S1,WPM+0.8 mg·L-16-BA[5];S2,1/2MS+0.5 mg·L-16-BA+0.05 mg·L-1NAA[6];S3,1/2MS+0.5 mg·L-16-BA[8];S4,MS+2.0 mg·L-16-BA+0.2 mg·L-1NAA[7];S5,1/2MS+0.8 mg·L-16-BA+1.0 mg·L-1氨苄+0.3 mg·L-1真菌抑菌剂+25%活性炭(笔者自配培养基)。每个处理设3个重复,每个重复接种5个带腋芽茎段,接种28 d后观察并统计腋芽生长情况。
1.2.3 不定芽增殖
筛选4种文献报道的不定芽增殖诱导的培养基,并对其进行不同组别试验,具体培养基配方如下:C1,MS+2.0 mg·L-16-BA+0.2 mg·L-1NAA[9];C2,MS+3.0 mg·L-16-BA+2.0 mg·L-1NAA+2 g·L-1蛋白胨[10];C3,2/3MS+2.0 mg·L-16-BA+2.0 mg·L-1NAA[11];C4,MS+2.0 mg·L-16-BA+0.2 mg·L-1IBA[12]。以诱导得到的腋芽作为材料,接种到不定芽增殖培养基上,每个处理设3个重复,每个重复至少接种3个,接种70 d后观察不定芽的愈伤生长与增殖情况。
1.2.4 不定根诱导试验
将获得的不定芽在节间处切下,进行不定根诱导实验。筛选6种文献报道的不定根诱导的培养基,具体配方如下:R1,WPM+1.0 mg·L-1NAA+1.0 mg·L-1IBA[5];R2,1/2MS+0.5 mg·L-1IBA[6];R3,MS+1.0 mg·L-1NAA[13];R4,1/2MS+1.0 mg·L-1NAA+0.5 mg·L-1IBA[7];R5,MS+0.5 mg·L-1IBA[14];R6,1/2MS+1.0 mg·L-1NAA+1.0 mg·L-16-BA[11]。每个处理设3个重复,每个重复接种5个腋芽,接种14 d后观察并统计不定根生长情况。
1.3 统计分析
所有数据的统计分析均使用SPSS 18.0软件完成。
2 结果与分析
2.1 外植体灭菌
用3种不同外植体灭菌方式对三叶青含腋芽茎段与叶片进行处理,7 d后统计污染情况。由表1可知,处理2中2种外植体灭菌后效果较佳,未污染率达到97%;其次是处理1,叶片未污染率为92%,腋芽茎段为83%;处理3的灭菌效果较差,对2种外植体的灭菌效果均未达到50%。由此可见,以含腋芽茎段与叶片为外植体时,在0.1% HgCl2中添加适量表面活性剂吐温20有助于增强灭菌效果。该方法也广泛应用于其他药用植物外植体的灭菌,如广豆根[15]、金线莲[16]等。

表1 灭菌方式对三叶青外植体的影响
2.2 腋芽诱导
用5种不同培养基配方进行腋芽的诱导培养,结果显示,S3培养基腋芽成活率最高,为96.7%;其次为S4、S1和S2培养基,其腋芽成活率分别为86.7%、83.3%和76.7%,S5培养基成活率最低(表2)。培养16 d后,S1~S4培养基出现不同程度的褐化,在S4培养基培养28 d后腋芽基部有愈伤组织生成(图1)。S5培养基腋芽的成活率低,可能与添加的氨苄霉素和真菌抑制剂有关。此外,S5培养基可以抑制后期腋芽的褐化,说明加入活性炭对防褐化具有明显的效果。综上,采用S1,S2和S4培养基获得的腋芽成活率基本与参考的文献结果一致,但这些文献没有涉及褐化问题[5, 6, 17]。钱丽华[8]的研究没有明确测定S3培养基中三叶青腋芽的成活率,本研究发现其成活率显著都高于其他培养基,因此,建议采用1/2MS+0.5 mg·L-16-BA+25%活性炭进行腋芽的诱导。

表2 5种培养基配方培养16 d后三叶青腋芽的诱导情况

图1 S3培养基和S4培养基上的腋芽
2.3 不定芽诱导增殖
用4种不同培养基进行不定芽诱导增殖培养,结果发现,C1培养基的愈伤组织生长形态较好,多表现为深绿色,结构比较致密,其腋芽的出愈率为100%,易分化产生不定芽,且不定芽的增殖倍数为3.1(表3,图2)。其次为C4培养基,腋芽的出愈率为93.3%,愈伤组织形态为浅绿色,结构致密,但不定芽诱导效果较C1培养基差。C2和C3培养基诱导的愈伤组织及其分化能力均较差,结构较为疏松,不定芽长势弱(表3)。表明高浓度的6-BA和低浓度的NAA有助于三叶青愈伤组织的诱导,该结果与大多数报道一致[8, 9,17]。因此,建议采用MS+2.0 mg·L-16-BA+0.2 mg·L-1NAA作为三叶青不定芽诱导增殖的较佳培养基。

表3 4种培养基培养70 d后不定芽的增殖情况

图2 4种培养基培养70 d后不定芽的诱导增殖情况
2.4 不定根诱导
用6种不同培养基配方进行三叶青不定根的诱导培养,结果如表4和图3所示。R2培养基诱导的不定根最多,平均为8.6个,平均根长为6.6 cm,有新叶长出,且长势茂盛,为最佳诱导培养基(图3中B)。R1、R3、R4均含有1.0 mg·L-1的NAA,诱导出的不定根有大量的根毛,R1培养基尽管有新叶长出,但长势一般,R3和R4培养基诱导的根数较少,生长也较为缓慢,且根部有愈伤组织长出,不适合做不定根的诱导。 R6培养基包含1.0 mg·L-1NAA和1.0 mg·L-16-BA,严重限制了不定根的诱导和腋芽的生长,不建议使用该培养基诱导不定根(图3中F)。以上培养基与前人研究结果有一定的差异,我们推测可能跟培养条件和药品纯度有关。R5培养基诱导的平均根个数为5.1个,根长达到7.8 cm,也有新叶长出,长势也比较茂盛(图3中E),其与R2培养基的区别在于采用MS为主培养基,而R2培养基采用1/2MS为主培养基,考虑到成本问题,建议采用R2培养基用于不定根的诱导。因此,最佳的三叶青不定根诱导培养基为1/2MS+0.5 mg·L-1IBA。
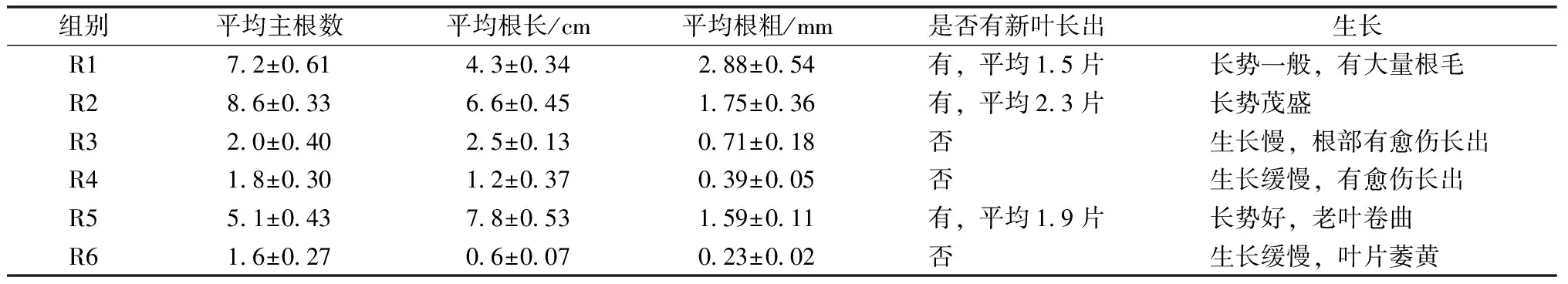
表4 三叶青不定根的诱导结果

图3 诱导不定根的形成
3 小结
该研究的试验结果大部分与文献报道一致,但是也有部分数据无法重复文献中的结果,这可能跟外植体选择、实验培养条件、操作人员的操作技巧,以及药品纯度都有直接的关系。经过比较试验,优化出一套三叶青高效组织快繁的技术体系:采用腋芽茎段为外植体,用75%乙醇消毒1 min,含3滴吐温20的0.1% HgCl2灭菌15 min,接种于1/2MS+0.5 mg·L-16-BA+25%活性炭培养基诱导腋芽,21 d后接种于MS+2.0 mg·L-16-BA+0.2 mg·L-1NAA培养基上进行不定芽增殖诱导,最后采用1/2MS+0.5 mg·L-1IBA培养基诱导,14 d后形成不定根。该研究可为研究人员进行三叶青组织快繁试验提供一定的科学依据,有助于缩短试验周期,节约成本。

