胃癌CT体积测量在预测其术后病理分期中的应用
王志聪, 饶圣祥
胃癌是世界上最常见的恶性肿瘤之一,位居恶性肿瘤死因顺位第2位,亚洲日本、韩国及我国是胃癌高发区,全球胃癌患者有一半以上来自东亚[1,2]。
手术切除是目前胃癌最主要的治疗方式,准确的术前临床分期对于选择合理的手术方式和指导治疗,以及评估预后都具有重要的价值和意义[3]。术前的临床分期包括肿瘤的浸润程度(T)、淋巴结的转移情况(N)和远处转移(M)。临床分期的主要影像学检查包括电子计算机断层扫描(CT)和内镜超声(EUS)以及磁共振(MRI)等。
Kwee等[4,5]对MDCT、EUS和MRI三者预测病理分期的准确性进行综述,三者预测T分期的准确度分别为77.1%~88.9%、65%~92.1%和71.4%~82.6%,MDCT预测N分期的敏感度为80.0%,特异度为77.8%,EUS分别为70.8%和80.6%,MRI分别为68.8%和75.0%。内镜超声从20世纪80年代开始投入使用,对T分期预测具有较高的准确率,但内镜超声作为一种创伤性检查,并非适用于所有患者;内镜超声是一项高技术水平检查,对医生要求较高;此外,胃癌的大小、位置和组织学类型也是影响内镜超声分期准确性的重要因素,这使其无法得到广泛运用[6-8]。螺旋CT广泛应用于胃癌的临床分期,被认为是目前最好评估临床分期的检查,具有非侵入性评估肿瘤的浸润程度,淋巴结转移和远处转移的能力。CT预测胃癌T1和T2期的准确率为42.86%,对于T3和T4期的准确率为89%[9]。
本研究运用螺旋CT测量胃癌肿瘤体积,回顾性分析胃癌患者CT肿瘤体积与术后病理分期的相关性,以期为临床分期提供参考价值。
材料与方法
1.临床资料
搜集2015年4月-2016年1月复旦大学附属中山医院胃癌患者105例,其中男69例,女36例,年龄34~84岁,平均年龄(60.96±9.95)岁。入选标准:病例术前均经胃镜病理活检证实为胃癌,无器官远处转移者(M0),既往未经术前新辅助放化疗。所有患者行CT增强扫描后1周内行手术切除肿瘤并取得病理结果。排除标准:严重的肝肾功能障碍等手术禁忌患者;受检者支气管哮喘或有碘对比剂使用禁忌;无完整病理资料。
2.扫描技术
79例应用美国GE Lightspeed 64层MSCT扫描仪,管电压120 kV,电流模式为Smart mA,准直器宽度64×0.625 mm,螺距0.984;26例应用德国Siemens Somatom Sensation 16层MSCT扫描仪,管电压120 kV,管电流200 mAs,准直器宽度为16×0.75 mm,螺距0.750。所有患者检查前禁食8 h,检查前20 min饮水800 mL,然后肌肉注射山莨菪碱10 mg,再饮水200 mL后立即检查。患者取仰卧位,扫描前进行呼吸训练。所有患者均行平扫和动态增强扫描,扫描范围自膈顶至两肾下极水平。增强扫描采用高压注射器自肘正中静脉注射对比剂碘普胺(300 mg I/mL)1.5~2.0 mL/kg,注射流率为3~5 mL/s,分别于注药后30~50 s和80 s行动脉期和门静脉期扫描。扫描层厚5 mm,层间距5 mm。
3.肿瘤体积
本研究使用GE公司的Centricity DICOM Viewer 3.1版本的软件进行数据搜集。由2名放射科医师(3年以上工作经验和7年以上工作经验)共同协作完成,在未知肿瘤病理分期的情况下分析患者图像,通过人工测量门脉期横断面每一层面的肿瘤面积,乘以层厚(5 mm)叠加获得CT肿瘤体积。公式:CT肿瘤体积=∑肿瘤面积×层厚(图1)。CT肿瘤体积避开胃腔内气体和液体,不包括肿瘤周围肿大淋巴结及受侵血管,若肿瘤与正常胃壁组织边界欠清,CT肿瘤体积包括周围厚度>5 mm的胃壁[10,11]。测量1例患者的CT肿瘤体积平均需要花费大约4 min时间。
4.病理分期
所有胃癌患者进行手术切除,切除标本由一名病理科医师(18年以上工作经验)在未知肿瘤CT表现情况下进行病理分期,术后病理分期参照AJCC胃癌TNM分期(第7版)[3]。
5.统计分析
数据采用MedCalc 12.1.4软件进行统计学分析,CT肿瘤体积与病理T分期和N分期的关联性分析使用Spearman秩相关检验(0.0~0.2 极弱相关或无相关;0.2~0.4 弱相关;0.4~0.6 中等程度相关;0.6~0.8 强相关;0.8~1.0 极强相关),不同的T分期和N分期CT肿瘤体积的中位数值和关系采用Kruskal-Wallis分析,将T分期分为T1-2组与T3-4组,N分期分为N0组和≥N1组,不同T分组和N分组的CT肿瘤体积使用Mann-Whitney U-检验进行比较。通过ROC曲线,进一步分析CT肿瘤体积预测术后病理T分期和N分期的应用价值。P<0.05为差异有统计学意义。
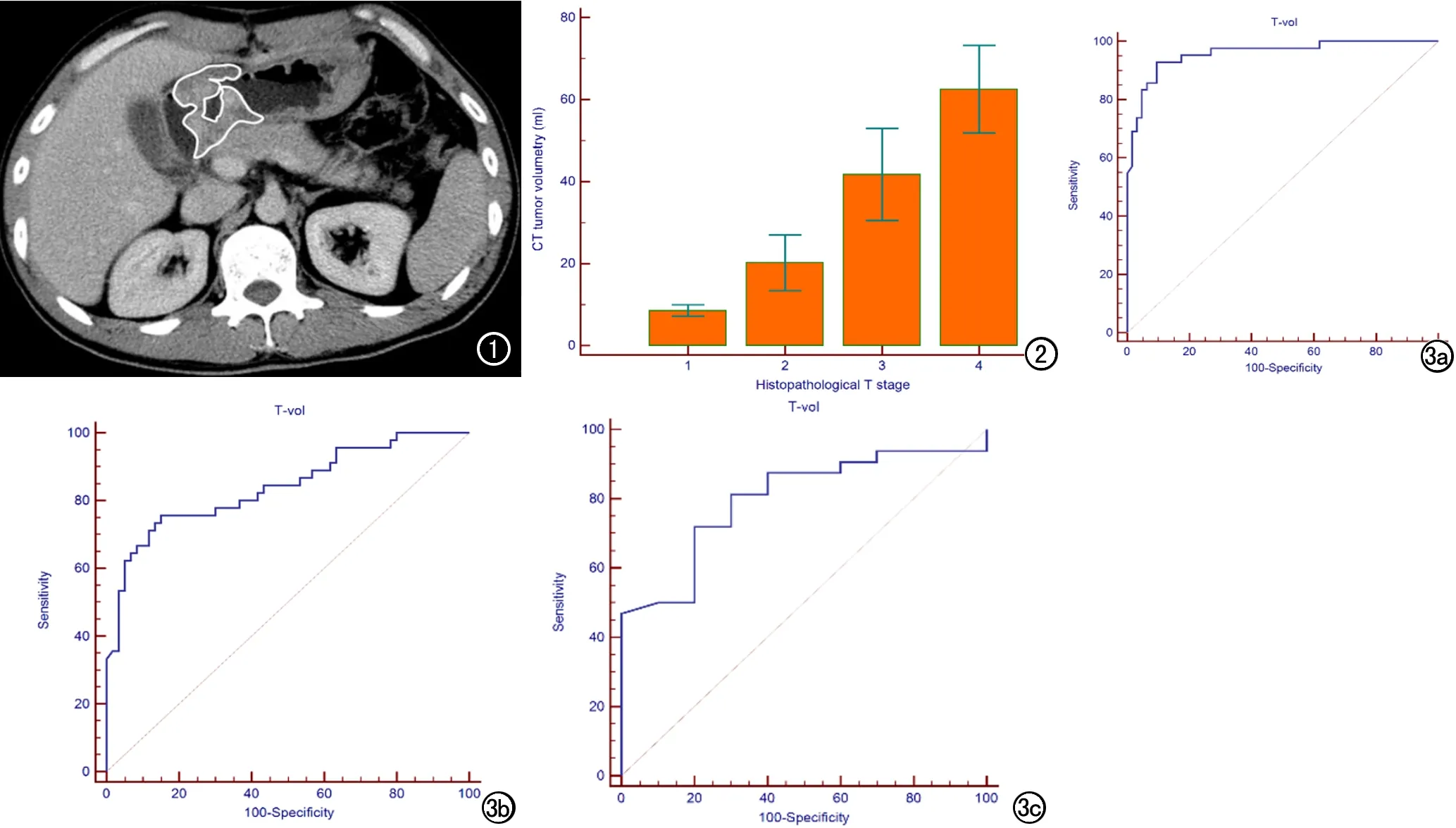
图1在门脉期每一层CT图像上圈定肿瘤范围,乘以层厚(5mm)叠加获得CT肿瘤体积。 图2箱线图显示CT肿瘤体积与术后病理T分期呈显著相关。 图3a) ROC曲线分析CT肿瘤体积(T-vol)预测术后病理T期的曲线下面积(AUC)为0.96; b) 预测N期的AUC为0.84;c) 预测T1-2N0期的AUC为0.80。
结 果
1.肿瘤部位及分期
胃癌部位位于贲门11例(11/105,10.5%),胃体40例(40/105,38.1%),胃窦45例(45/105,42.9%),幽门9例(9/105,8.6%)。对于T分期情况,T1分期26例(26/105,24.8%),T2分期16例(16/105,15.2%),T3分期16例(16/105,15.2%),T4分期47例(47/105,44.8%)。对于N分期情况,N0分期45例(45/105,42.9%),N1分期17例(17/105,16.2%),N2分期12例(12/105,11.4%),N3分期31例(31/105,29.5%)。
2.CT肿瘤体积与病理T分期
CT胃癌肿瘤体积与病理T分期有显著相关性,CT肿瘤体积与T分期的相关系数r=0.80(P<0.001),呈强相关(图2),不同T分期的CT肿瘤体积中位数值随着T分期的增加呈增长趋势,各组间差异均具有统计学意义(P<0.001,表1)。将T分期分为T1-2组和T3-4组,42例归为T1-2组,63例归为T3-4组。T1-2组的CT肿瘤体积明显>T3-4组(P<0.001)。运用ROC曲线进一步分析CT肿瘤体积预测T分期的诊断价值,ROC曲线下面积(AUC)为0.96,95%置信区间的相伴概率P<0.001(图3a)。如果将CT肿瘤体积≤24.5 mL作为预测T1-2期的阈值时,CT肿瘤体积预测T1-2期的敏感度为92.9%,特异度为90.5%,准确度为91.4%。如果将CT肿瘤体积≤19.9 mL作为阈值时,其预测T1-2的敏感度、特异度和准确度分别为83.3%、95.2%和90.5%。

表1 T分期及N分期CT肿瘤体积中位数值比较及相关分析结果
3.CT肿瘤体积与病理N分期
CT肿瘤体积与病理N分期的相关系数r=0.66(P<0.001),呈强相关。不同N分期的CT肿瘤体积中位数值的组间差异均具有统计学意义(P<0.001)。将N分期分为N0组和≥N1组,45例归为N0组,60例归为≥N1组,N0组与≥N1组CT肿瘤体积具有显著差异(P<0.001,表2)。ROC曲线下面积为0.84,95%置信区间的相伴概率P<0.001(图3b),如果将CT肿瘤体积≤23.4 mL作为预测N0期的阈值时,CT肿瘤体积预测N0期的敏感度为75.6%,特异度为85.0%,准确度为81.0%。
4.T1-2N0组 vs. T1-2Nx组
将T1-2且N0期患者归为一组,共32例,其余患者归为另一组,共73例,组间CT肿瘤体积具有显著差异(P<0.001),ROC曲线下面积为0.94,95%置信区间的相伴概率P<0.001。如果将CT肿瘤体积≤19.9 mL作为预测T1-2且N0期的阈值时,CT肿瘤体积预测T1-2且N0期的敏感度为90.7%,特异度为87.7%,准确度为88.6%。在T1-2组内细分≥N1亚组和N0亚组,10例归为≥N1亚组,32例归为N0亚组,≥N1亚组和N0亚组中位数的组间差异具有统计学意义(P=0.005),ROC曲线下面积为0.80,95%置信区间的相伴概率P<0.001(图3c)。如果将CT肿瘤体积≤10.8 mL作为预测T1-2N0期的阈值时,CT肿瘤体积预测T1-2N0期的敏感度为71.9%,特异度为80.0%,准确度为73.8%(表3)。
讨 论
我国的胃癌发病率和死亡率处于世界较高水平,近30年来总体呈上升趋势[12],提高胃癌的术前临床分期对于治疗方案和手术方式的选择至关重要。本研究显示胃癌最常见的好发部位为胃窦部,其次为胃体和贲门,这与之前研究结果相一致[13]。本研究表明通过人工测量CT扫描的肿瘤体积,与术后病理T分期和N分期有着显著的相关性,可为胃癌患者的术前临床分期提供参考价值。Kikuchi等[14]认为通过肿瘤体积评估临床分期优于传统评估方法。国外部分文献报道CT对于胃癌的临床分期准确度为65%~77%不等,预测早期胃癌(ECG)的准确度只有20%~53%[15,16]。本研究显示将CT肿瘤体积≤24.5 mL作为临界值时,其预测T1-2期的敏感度为92.9%,特异度为90.5%,准确度达到91.4%。传统的CT评估胃癌临床分期受肿瘤的形态学特征、胃壁的厚度、胃充盈程度和肿瘤的强化程度影响,部分容积效应和胃壁厚薄不均,使胃壁多层结构难以观察,T分期的评估更加困难[17]。CT肿瘤体积是通过圈定每一层面的肿瘤范围,计算面积,乘以层厚叠加获得肿瘤体积,所以CT肿瘤体积受胃壁厚度、胃膨胀程度和肿瘤大体形态影响较小,虽部分层面肿瘤边界难以界定,但CT肿瘤体积绝对值较大,边界部分的体积对其影响较小,故测量重复性好,文献表明通过CT测量胃癌肿瘤体积是可行和可重复的[18-20]。
本研究显示CT肿瘤体积预测淋巴结转移的准确度、敏感度和特异度分别为81.0%、85.0%和75.6%。Hasegawa等[21]研究表明MDCT预测淋巴结转移的准确度、敏感度和特异度分别为81.3%、46.4%和96.8%,两者研究结果的准确性相似,但是其预测淋巴结转移的敏感度为46.4%,容易出现假阴性的情况,即一半以上的病理≥N1期患者术前被误诊为N0期,这可能会影响临床医师的治疗方案选择,如术前的新辅助放化疗,以及影响手术方式,比如是否行淋巴结清扫术。CT肿瘤体积结合MDCT等形态学标准可能可以形成互补,进一步提高胃癌临床分期的准确性,这有待我们进一步的研究。
理论上,T1-2期的患者比T3-4期的患者有更良好的预后及更长的术后生存时间。Kikuchi等[22]认为相对于T3-4期,T1-2期的准确预测能够提供更有用的预后信息,但是对于T1-2期的胃癌患者来说,淋巴结的转移情况至关重要,淋巴结转移阳性的患者与不良预后密切相关[23],而扩大淋巴结清扫术可能会增加该类患者的术后并发症和死亡率[24],因此新辅助放化疗结合手术可能是该类患者的最佳治疗方案[25]。本研究显示在T1-2期的患者里,发生淋巴结转移的概率为23.8%(10/42),≥N1亚组与N0亚组的组间统计学差异可能表明即使肿瘤未突破深肌层,较大的肿瘤体积仍越容易发生淋巴结转移。CT肿瘤体积预测T1-2N0期患者的敏感度为71.9%,特异度为80.0%,准确度为73.8%。

表2 T1-2/N0组与T3-4/≥N1组患者CT肿瘤体积中位值(ml)及组间差异比较

表3 ROC曲线分析CT肿瘤体积预测T1-2期、N0期及T1-2N0期的诊断价值
Kim等[20]认为应用多排螺旋CT(MDCT)3D重建技术计算胃癌肿瘤体积,与传统CT临床分期比较,其预测术前临床T分期和N分期有显著的提高,3DCT与传统CT预测T分期的准确度分别为84%和77%,预测N分期的准确度分别为63%和61%。本研究显示CT肿瘤体积预测T1-2分期和N0分期的准确度分别为91.4%和81.0%。目前人工测量肿瘤体积可能比3D重建计算肿瘤体积更加准确,这需要进一步对比研究。
本研究存在一定的局限性。第一,作为回顾性研究,本研究虽有105例患者,但T1-2期的患者相对于T3-4期的患者较少,这是由于在同一时间段内,胃癌手术患者以T3-4期患者居多,而早期胃癌的病例数较少则跟我国早期胃癌筛查的普及程度和国人的重视程度相关;第二,CT肿瘤体积测量存在一定的误差,如肿瘤最上方和最下方层面的选择,肿瘤边界的选定,周围淋巴结的干扰等,CT肿瘤体积的测量也有一定的主观性。通过多人测量评估取平均值可能会减少这方面的误差。另外,Tirumani[26]最近研究显示使用三轴测量建立椭球近似体的体积可用于密切估计胃癌的肿瘤体积。随着3D技术的发展,全自动或半自动图像分割工具可能取代人工测量,获取肿瘤体积也会更加精确;第三,本研究的CT层厚为5 mm,可能会影响较小肿瘤的体积测量,然而,目前大部分体积测量相关的文献使用的CT层厚均为3~5 mm,对于其他检查,Lambregts等[27]也使用层厚为5 mm的MRI图像来测量直肠癌的肿瘤体积。因此,我们认为5 mm层厚的CT图像对肿瘤体积测量的影响不大。
总之,本研究得出CT肿瘤体积与术后病理T、N分期均具有显著的相关性,通过选取恰当的阈值,可为胃癌的术前临床分期提供良好的参考价值,从而指导临床医师选择合理的治疗方案及手术方式;另一方面,该方法有待更大样本量的研究,以得到进一步的验证,而CT肿瘤体积与患者的复发率及术后生存时间的相关性,则有待更长期的随访研究。