延龄草苷对脊髓损伤大鼠核因子E2相关因子2/抗氧化反应元件信号通路的影响
杜俊龙,陈显兵,,王凤杰,,覃晓莉,赵方毓,唐鲜娥
1.湖北民族大学附属民大医院,湖北恩施市 445000;2.湖北民族大学医学部,湖北恩施市 445000
脊髓损伤指不同方式外力使脊柱发生爆裂、移位,伤及椎管内脊髓组织,从而造成脊髓神经损伤性疾病[1]。脊髓损伤包括原发性损伤和继发性损伤[2]。继发性脊髓损伤有一定的可逆性和可干预性,已成为近年来的研究热点,其发生机制主要有氧化应激、细胞凋亡、炎症反应学说等,而氧化应激损伤在继发性损伤发生机制中起关键作用[3],亦是引起组织损伤和神经细胞死亡的主要原因之一[4]。近年来发现的机体内源性抗氧化核因子E2 相关因子2/抗氧化反应元件(nu‑clear factor E2‑related factor 2/antioxidant response ele‑ment,Nrf2/ARE)信号通路可抵御损伤所致的氧化应激反应,因而在脊髓损伤的防御中起重要作用[5];激活Nrf2/ARE 通路可促进抗氧化酶、抗炎蛋白、DNA 修复酶等下游分子表达,从多方面保护脊髓继发性损伤[6‑7],因此该通路可能成为治疗脊髓损伤的新靶点。
延龄草(Trillium tschonoskii Maxim)是百合科延龄草属多年生草本植物,在恩施土家族地区民间应用较多,有活血止血、镇静止痛、解毒等功效[8]。现代药理研究显示,延龄草有抗氧化[9]、抗衰老[10]等作用,且前期已证实延龄草可通过调节自噬、抑制细胞凋亡来达到保护脊髓损伤的作用[11]。本研究采用延龄草干预脊髓损伤模型大鼠,探讨延龄草能否通过Nrf2/ARE信号通路抑制体内氧化应激反应,从而发挥脊髓损伤保护作用。
1 材料与方法
1.1 实验动物
SPF 级健康雄性Sprague‑Dawley 大鼠108 只,10周龄,体质量200~220 g,由湖北省实验动物研究中心提供,许可证号SCXK(鄂)2015‑0018。实验动物正常进食和饮水,分笼饲养,自然光照周期,维持室温23 ℃,湿度56%左右。实验动物操作均符合动物伦理委员会制定的实验动物操作标准,接受湖北民族大学动物伦理委员会的监督与检查。
1.2 实验动物分组与处理
大鼠称重标记,随机数字表法分为假手术组、模型组和延龄草苷干预组,每组36只,每组再分为1 d、3 d和7 d三个亚组,每个亚组12只。假手术组只切开椎板,不打击脊髓;模型组和延龄草苷组切开椎板,并打击脊髓,建立脊髓损伤模型。术后待大鼠苏醒2 h 后进行灌胃,延龄草苷组给予200 mg/kg 延龄草苷,假手术组和模型组给予等量生理盐水,每天2 次,间隔12 h,连续给药7 d。
1.3 模型制备
实验动物称重,10%水合氯醛3 ml/kg腹腔注射麻醉后,采用改良Allen 重物打击法制备脊髓损伤模型[11]。大鼠俯卧位固定于手术台,备皮,碘伏消毒,铺巾,切除T9~T11棘突及椎板,暴露硬脊膜,用5.0 g重物从5 cm 高度自由落下撞击暴露区。造模成功标志:在脊髓打击器撞击脊髓时,大鼠发生身体抖动,双下肢迅速回缩及弹动,尾巴发生痉挛性摆动,打击局部脊髓表面红肿。撞击后以消毒温盐水、庆大霉素清洗,之后依次缝合肌肉、筋膜、皮肤,敷料覆盖伤口,加以固定并肌注青霉素。
1.4 实验药物、试剂及仪器
延龄草采于湖北神农架及巴东地区,经湖北民族大学中药实验室鉴定,并提取延龄草苷,总皂苷含量为14.72 mg/g。注射用青霉素钠:华北制药股份有限公司。水合氯醛、二甲苯、无水乙醇:天津市福晨化学试剂公司。苏木素染剂:福州迈新生物技术公司。ELISA 试剂盒:武汉博士德生物工程有限公司。Nrf2抗体、Kelch 样ECH 关联蛋白1 (Kelch like ECH asso‑ciated protein 1,Keap1)抗体:美国ABCAM 公司。An‑ti‑rabbit IgG、Anti‑mouse IgG:美 国CELL SIGNAL‑ING TECHNOLOGY 公司。Western blotting其余试剂:上海碧云天生物技术有限公司。自由落体脊髓损伤模型打击器:安徽正华生物仪器设备有限公司。TC‑120 型智能程控生物组织自动脱水机、TB‑718E 型生物组织自动包埋机:湖北泰维科技实业有限公司。全波长酶标仪:美国THERMO FISHER 公司。Western blotting 仪:美国BIO‑RAD 公司。移液器:德国EP‑PENDORF公司。
1.5 检测指标
1.5.1BBB评分
脊髓损伤模型制备成功后,各组分别于术后1 d、3 d、7 d 进行BBB 评分[12]。将大鼠放置于测试平台,采用盲法观察大鼠下肢运动功能状态,由熟悉实验评分标准的非本组实验人员评分,观察下肢关节活动、步态、躯干的稳定性、爪的精细活动、尾的位置以及身体的协调性等,观察时间不少于5 min,每只3 次,评分0~21 分。0 分:无可见后肢运动,完全瘫痪。21分:持续性掌面移动、协调步态、足趾抓地、躯干稳定、尾巴翘起,活动过程中主动爪位置与身体始终平行,完全正常活动。评分前检查大鼠膀胱充盈状态,协助排尿,以免影响评分结果。
1.5.2尼氏染色
术后7 d 每组随机取4 只,10%水合氯醛3 ml/kg腹腔注射后,固定于操作台,暴露心脏,先用250 ml生理盐水灌流,再用4%多聚甲醛灌注至四肢僵硬,取T9‑11段脊髓组织放于4%多聚甲醛液中浸泡保存,然后梯度脱水透明,常规石蜡浸蜡包埋,切片,片厚5 μm。切片热水烫平,再贴到载玻片上,45 ℃恒温箱中烘干。依次浸入二甲苯I10 min,二甲苯Ⅱ10 min,无水乙醇I3 min,无水乙醇Ⅱ3 min,90%乙醇3 min,80%乙醇3 min,70%乙醇3 min,水洗,蒸馏水洗,尼氏染液10 min,蒸馏水洗2 次,70%乙醇1 min,90%乙醇1 min,无水乙醇Ⅱ1 min,无水乙醇I1 min,二甲苯Ⅱ1 min,二甲苯I1 min,烤干,中性树脂封片,光学显微镜观察脊髓损伤区形态学改变。
1.5.3ELISA
术后7 d各组取4只大鼠,同法麻醉,心尖灌流生理盐水,无血后立即冰上取脊髓组织,将其剪碎匀浆研磨,根据ELISA 试剂盒说明书进行实验操作,用全自动酶标仪检测,根据检测结果计算丙二醛(malonal‑dehyde,MDA)含量和超氧化物歧化酶(superoxide dis‑mutase,SOD)活性。
1.5.4Western blotting
术后1 d、3 d、7 d,各组取4 只大鼠,与ELISA同法取脊髓组织蛋白,制备蛋白样品,BCA 蛋白定量,根据说明书制胶,将样品置于100 ℃水煮5 min,SDS‑PAGE 电泳,提前将PVDF 膜放甲醇中浸泡10 min,转膜,用5%脱脂牛奶室温摇床封闭3 h,TBST洗3 次,每 次5 min,加Nrf2 (1∶800)、Keap1 (1∶800)、NAD(P)H醌氧化还原酶‑1 (NAD(P)H quinone oxidoreductase,NQO1,1∶1000)、血红素加氧酶‑1(haem oxygenase 1,HO‑1,1∶1000)的一抗4 ℃孵育过夜,TBST 洗3 次,每次5 min,加相应二抗(1∶5000)室温摇床孵育2 h,TBST洗3次,每次5 min,ECL发光检测,Image J软件分析条带,以β‑actin为内参照。
剩余大鼠用于其他实验。
1.6 统计学分析
采用SPSS 22.0 软件对数据进行统计分析。计量资料数据结果以(xˉ±s)表示,符合正态分布采用多个样本均数比较的方差分析,组间比较采用单因素方差分析和SNK 检验,两两比较采用LSD‑t检验。显著性水平α=0.05。
2 结果
2.1 BBB评分
假手术组在术后1 d、3 d、7 d三个时间段BBB评分均为21分。与模型组相比,术后3 d和7 d,延龄草苷组BBB评分均增加(P<0.05)。见表1。
2.2 形态学变化
假手术组神经元结构完整清晰,胞质内尼氏小体丰富且分布均匀,呈虎斑状;模型组脊髓组织内神经元胞体缩小,细胞间隙增大,神经元数量减少,形态不规则,胞质内尼氏小体数量减少甚至消失,且分布不均匀;延龄草苷组脊髓结构较完整,尼氏小体数量增多,且分布比较均匀,神经元形态较正常。见图1。

表1 各组BBB评分比较
2.3 MDA含量和SOD变化
与假手术组比较,模型组脊髓组织内SOD活性降低(P<0.05),MDA 含量升高(P<0.05);与模型组比较,延龄草苷组脊髓组织SOD 活性提高(P<0.05),MDA含量降低(P<0.05)。见表2。
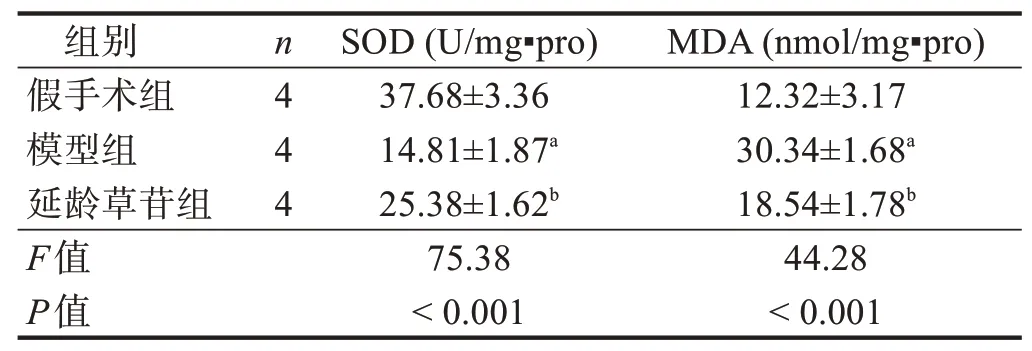
表2 各组脊髓组织中SOD和MDA的变化
2.4 Nrf2通路相关蛋白表达水平
术后1 d、3 d、7 d,与假手术组相比,模型组脊髓组织中Nrf2、Keap1、HO‑1 和NQO1 4 种蛋白表达均升高(P<0.05);与模型组相比,延龄草苷组均进一步升高(P<0.05)。见表3~表5、图2~图4。
3 讨论
脊髓损伤过程中活性氧诱发的氧化应激反应是其重要损伤机制之一。大量活性氧产生会导致蛋白、脂质及DNA 损伤,引起不可逆性细胞死亡[13];抑制氧化应激可减轻脊髓损伤程度,保护神经元,促进运动功能恢复[14‑16]。前期研究证实[11,17],头顶一颗珠提取液可以减轻脊髓内神经细胞损伤,对损伤神经元具有保护作用。本研究发现,延龄草干预3 d 和7 d 时大鼠BBB 评分均明显升高,表明脊髓运动功能得到改善;形态学检测亦可见脊髓结构较完整,损伤性改变减轻,且尼氏小体数量增多、分布均匀。延龄草是中药头顶一颗珠中的主要活性成分,可通过抗炎、抗氧化、提高免疫力等多种途径来保护损伤细胞,从而促进脊髓损伤后运动功能恢复。为进一步研究延龄草苷保护脊髓损伤的作用机制,本研究从抗氧化应激角度探讨延龄草的作用。

图1 各组脊髓组织神经元尼氏小体的变化(尼氏染色,×200)
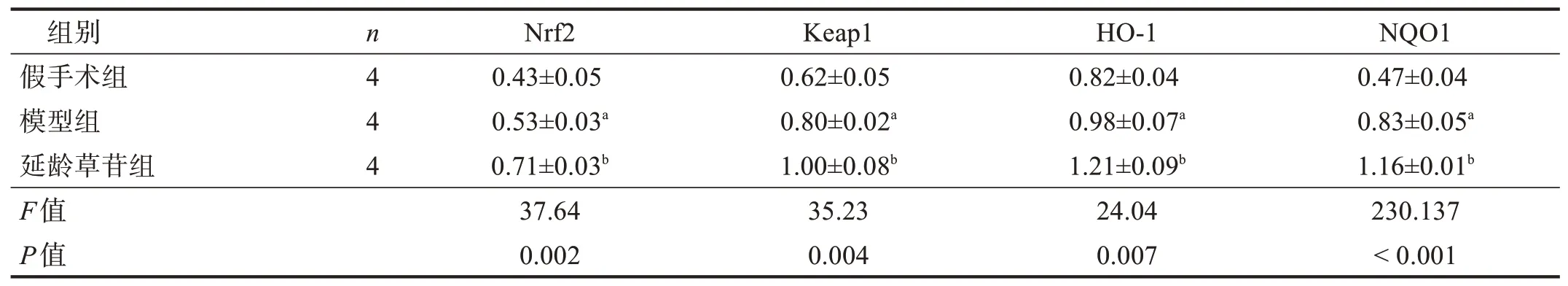
表3 各组术后1 d脊髓组织内Nrf2、Keap1、HO-1和NQO1的表达

表4 各组术后3 d脊髓组织内Nrf2、Keap1、HO-1和NQO1的表达

表5 各组术后7 d脊髓组织内Nrf2、Keap1、HO-1和NQO1的表达

图2 各组术后1 d脊髓组织内Nrf2、Keap1、HO-1和NQO1的表达

图3 各组术后3 d脊髓组织内Nrf2、Keap1、HO-1和NQO1的表达

图4 各组术后7 d脊髓组织内Nrf2、Keap1、HO-1和NQO1的表达
脊髓组织富含脂质,对脂质过氧化非常敏感。自由基介导的氧化应激在脊髓损伤中发挥重要作用,亦是继发性脊髓损伤的重要机制之一,抑制氧自由基产生可能是脊髓损伤潜在的治疗方法[18]。Nrf2/ARE信号通路是机体内重要的抗氧化应激通路,在氧化应激损伤中发挥重要作用[19‑20],Nrf2 可与多种抗氧化反应元件相结合,介导抗氧化蛋白/酶的表达。生理状态下Nrf2 结合到Keap1 上,Nrf2 活性抑制;而氧化应激情况下Nrf2 从Keap1 上解离并活化、转移到细胞核中,激活靶基因转录,调节下游抗氧化蛋白合成,增加细胞对氧化应激的抵抗性[21]。该通路调控的抗氧化蛋白/酶主要包括HO‑1、NQO1、SOD 和GSH‑Px 等[22]。我们发现延龄草苷干预可提高脊髓组织内SOD活性,降低脂质过氧化产物MDA 含量,减轻脊髓损伤后氧化应激反应,从而保护细胞氧化性损伤。
HO‑1 是血红素降解的限速酶,广泛分布于各组织中,在机体应激状态下发挥重要作用;诱导HO‑1的表达或激活,可明显抑制氧化应激反应,促进脊髓运动功能的恢复[23]。NQO1 是真核生物细胞中普遍存在的一种黄素蛋白酶,具备抗氧化能力[24],在氧化应激反应中起保护作用。Kaspar 等[25]的研究显示,NQO1 为Nrf2 的下游产物,Nrf2 的激活可刺激NQO1的表达。Keap1 是Nrf2/ARE 通路上的关键因子,NQO1、HO‑1 是该通路激活后细胞保护蛋白的转录因子。本研究通过Western blotting 分析检测脊髓组织内Nrf2 通路中相关蛋白的表达水平,发现脊髓损伤后Nrf2、Keap1、NQO1 和HO‑1 蛋白表达升高,可能是损伤使Nrf2 和Keap1 解离而活化,表达增加,进而激活下游靶蛋白NQO1 和HO‑1,表明脊髓内出现明显的抗氧化应激反应。而延龄草苷干预1 d、3 d和7 d时均可增加Nrf2 通路相关的4 种蛋白表达,进一步活化Nrf2/ARE通路,诱导抗氧化蛋白NQO1和HO‑1表达,增强机体自身抗氧化能力,从而减轻内源性损伤。本研究仅检测脊髓内总Nrf2表达水平,尚未进行Nrf2入核及核内表达水平检测,因此还需深入探讨其作用机制。
综上所述,延龄草苷干预促进脊髓损伤大鼠运动功能恢复,减轻组织损伤,可能是通过激活Nrf2/ARE信号通路来抑制组织内氧化应激反应来实现的。

