豆粕蛋白在小鼠胃肠道内的吸收与分布研究
童深广 ,郝红江 ,李洪波 ,陈红兵 ,曾 辛 ,吴志华 *
(1.食品科学与技术国家重点实验室,南昌大学,江西 南昌 330047;2.南昌大学 食品学院,江西 南昌 330047;3.北京振东光明药物研究院有限公司,北京100011;4.南昌大学 中德联合研究院,江西 南昌 330047;5.江西省儿童医院感染科,江西 南昌 330006)
豆粕是大豆提取油脂后的副产品,其蛋白质质量分数40%~48%、脂肪质量分数1%~2%、碳水化合物质量分数10%~15%,氨基酸比例均衡,因此豆粕是优良的植物性蛋白来源[1-3]。但由于豆粕中所含有的大豆过敏原蛋白、胰蛋白酶抑制剂、Kuniz蛋白酶抑制剂等多种抗营养因子,导致其营养利用率较低。目前,对于豆粕蛋白或其他食物蛋白的吸收利用研究,以体外模拟消化为主[4]。已有报道称[5],对几种蛋白含量较高的食物进行胃肠模拟消化后,仍可检测到稳定的过敏原蛋白[6-8]。赵元等[9-11]研究了大豆球蛋白和β-伴大豆球蛋白在不同龄乳猪胃肠道内的吸收和分布。但仅研究某一、两种蛋白并不能全面地了解豆粕蛋白在体内的吸收、分布情况。基于此,有必要探索一种追踪豆粕蛋白在胃肠道内吸收与分布的方法,进一步了解豆粕蛋白在机体胃肠道内的吸收、分布。
对于体内的示踪研究,总分为两类:一类是利用自身性质进行示踪,如利用电感耦合等离子体质谱 (Inductively coupled plasma mass spectrometry,ICP-MS)直接对颗粒性的金属及其氧化物在小鼠体内的吸收、分布进行研究[12];另一类为标记示踪,其中标记示踪又分为免疫标记和非免疫标记两种。在许多食品或药物纳米载运体的吸收、分布研究中,同位素标记通常是追踪目标分子的一个重要手段[13-14]。对于某一种蛋白在体内的示踪,主要利用稳定性同位素示踪技术来研究其代谢分布[15],但对成分复杂的食物蛋白均匀地进行标记比较困难,而免疫标记方法比较适合。
豆粕中含有多种过敏原蛋白,其作为生物大分子所拥有的抗原性,给豆粕蛋白在胃肠道内吸收、分布的免疫标记研究带来了新思路。由于豆粕中的过敏原蛋白进入机体消化后仍保持稳定,因此基于抗原-抗体反应即可对其定位,进而追踪豆粕在胃肠道内的分布。豆粕中的主要过敏原是β-伴大豆球蛋白,占总蛋白的l0%~12.7%[16-17],其稳定性强,耐酶解,不易消化[18]。β-伴大豆球蛋白的致敏原性往往在到达肠道时才显现,说明其在肠道中基本结构没有受到破坏。它的这一特性,使得β-伴大豆球蛋白可作为胃肠道内豆粕吸收数量的定量检测标记物。
本研究对小鼠进行一次性灌胃豆粕,经过不同时间段后,处死小鼠并解剖获得其胃肠道样品。以过敏原蛋白中β-伴大豆球蛋白作为定量检测标记物,定量检测经过不同时间段后豆粕在胃肠道内的吸收数量。并以豆粕蛋白中的全蛋白作为抗原,采用免疫金银染色技术定位,显微观察豆粕蛋白在胃肠道内的分布,探究豆粕在小鼠胃肠道内的吸收数量、分布位置。
1 材料与方法
1.1 材料与试剂
β-伴大豆球蛋白试剂盒:泉州科诺迪生物有限公司;胶体金标记羊抗兔(二抗):北京博奥技术有限公司;兔抗大豆蛋白(一抗):购于美国Sigma公司;yellow-green505/510荧光微球:美国Thermo公司;载玻片、盖玻片:购于江苏世泰实验器材有限公司;OCT包埋剂:泰州樱花医疗科技有限公司;其余试剂:均购于上海阿拉丁公司。
1.2 仪器与设备
Cryotome E冰冻切片机:美国Thermo公司;RM2016石蜡切片机:德国徕卡仪器有限公司;Zeiss-Axio Vert.A1倒置荧光显微镜:德国蔡司股份公司;微波炉:中国格兰仕电器有限公司;Mode1869酶联免疫测定仪:美国Bio-Rad公司。
1.3 试验动物及分组
Balb-c雌性小鼠:南昌大学动物实验中心。小鼠出生 4~5 周左右,体质量(25±5)g,将小鼠放于塑料笼中饲养,然后置于动物房,室温保持在(25±2)℃,相对湿度(60±10)%,光周期为 12 h 光/暗。 小鼠在灌胃前饲养两周,使小鼠适应环境,并饲养不含豆粕的饲料。清除豆类食物,减少实验误差。小鼠采用随机组设计,将鼠分为6组,实验一组(N=11)、实验二组(N=11)、实验三组(N=11)、实验四组均灌胃豆粕(N=11),阳性对照组灌胃荧光微球(N=11),空白对照组灌胃蒸馏水(N=11)。
1.4 灌胃和样品采集
实验组小鼠灌胃100 mg豆粕后,实验一组、实验二组、实验三组、实验四组分别于 0.5、1、2、4 h 后脱颈椎致死。阳性对照组灌胃1 mg荧光微球,空白对照组灌胃1 mL蒸馏水,此两组小鼠于灌胃1 h后脱颈椎致死。处死后的小鼠置于解剖盘上,将各胃肠道(胃、十二指肠、空肠、回肠、结肠、直肠)洗净,去除食糜,截分。用作定量检测的胃肠道样品准确称其鲜重,并迅速置于液氮中速冻,再置于-80℃冰箱内保存。用于苏木精-伊红染色和免疫金银染色的胃肠道样品,置于盛有4%多聚甲醛的离心管中进行固定。
1.5 胃肠道中豆粕吸收数量测定
1.5.1 胃肠道处理 胃肠道样品从-80℃冰箱中取出,常温解冻,采用组织匀浆法,按照质量比1∶10加入pH=8.0 Tris-HCl于冰上进行研磨破碎处理。研碎后取出样品离心,离心条件为3 000 r/min,离心10 min,取上清液分装备用。
1.5.2 定量检测 采用酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)方法进行,测定胃肠道内豆粕质量比。将胃肠道匀浆上清液利用β-伴大豆球蛋白ELISA试剂盒测定,根据标准曲线计算出的各胃肠道内β-伴大豆球蛋白质量浓度,提取各部分胃肠道所需的总提取液体积,小鼠体质量以及β-伴大豆球蛋白占豆粕中的质量分数[16,19],从而定量计算出各胃肠道中豆粕质量比。
小鼠各胃肠道部位内豆粕质量比(C1)由式(1)计算

式中:ρ1为β-伴大豆球蛋白质量浓度,V1为各胃肠道部位所对应的总提取液体积,w为豆粕中β-伴大豆球蛋白的质量分数,M为小鼠体质量。
荧光微球在小鼠各胃肠道内的吸收数量,通过制作标准曲线,利用酶标仪测定。根据标准曲线计算出的各胃肠道中荧光微球质量浓度,对应的各胃肠道总提取液体积以及小鼠体质量从而计算出各胃肠道内荧光微球的质量比。
小鼠各胃肠道部位内荧光微球质量比(C2)由式(2)计算

式中:ρ2为荧光微球的质量浓度,V2为各不同胃肠道部位所对应的总提取液体积,M为小鼠体质量。
其中所测得胃肠道内的豆粕与荧光微球的数据均扣除了空白对照组中所测得的数据。
1.6 苏木精-伊红染色
小鼠胃肠道内的病理组织学分析采用苏木精-伊红染色[20]。首先对固定好的胃肠道样品制成石蜡切片,常规脱蜡后,苏木精-伊红染色。具体操作步骤为:从4%多聚甲醛取出胃肠道样品后,经过梯度脱水,二甲苯透明,石蜡包埋后切成石蜡切片。常规脱蜡,苏木精染色5 min,盐酸、酒精分色,蒸馏水冲洗蓝化,梯度乙醇上行,0.5%的伊红乙醇染色30 s,梯度乙醇脱水,透明中性树胶封片,于倒置荧光显微镜下观察。
1.7 免疫金银染色
豆粕蛋白在小鼠胃肠道内的分布采用免疫金银染色法进行[21-23]。先对固定好的胃肠道样品制成8~10 μm的冰冻切片,再利用胶体金标记羊抗兔二抗对切片进行染色,显微观察豆粕在胃肠道内的分布。具体操作步骤为:将固定的样品置于包埋剂中,冷冻后于切片机切成8~10 μm冰冻切片;稍晾干后,置于冷丙酮中固定10 min,于PBS(pH 7.4的磷酸盐缓冲液)中晃动洗涤;洗涤后,组织切片浸泡在抗原修复液中,于微波炉内进行抗原修复,自然冷却后,洗涤;再于切片上滴加正常羊血清封闭液,室温20 min,甩去多余液体,不洗;在切片上滴加兔抗大豆蛋白(一抗)于湿盒内4℃孵育过夜,孵育后,洗涤;切片甩干后,滴加胶体金标记羊抗兔(二抗)覆盖组织,37℃避光孵育60 min后,洗涤;硝酸银显色液避光显色一定时间后,蒸馏水洗,常规梯度脱水,二甲苯透明,中性树胶封片,于倒置荧光显微镜下观察。
1.8 统计分析
采用Origin 8.0对数据作图,同时采用SPSS 19.0统计软件对试验数据进行one-way ANOVA分析,以P<0.05时差异具有统计学意义。
2 结果与分析
2.1 不同时间小鼠胃肠道内的豆粕质量比
小鼠经一次性灌胃豆粕(0.5、1、2、4 h)后,胃肠道内的豆粕吸收情况如图1所示。灌胃豆粕0.5~1 h后,各胃肠道内均可检测到豆粕(P<0.01),此时直肠内的豆粕吸收量最低(0.22±0.04 μg/g),回肠内最高(47.3±4.2 μg/g), 说明此时小鼠胃肠道内开始全面吸收豆粕。胃内豆粕吸收量在灌胃2 h后明显减少(P<0.01),这可能是由于经过胃初步消化的豆粕下移至小肠被吸收;灌胃4 h后,胃内的豆粕吸收量基本保持不变。小肠前段(十二指肠)内,豆粕吸收量在灌胃1 h后显著减少(P<0.01),这可能是由于随着时间的增加,一部分豆粕被十二指肠吸收,另一部分豆粕则经过十二指肠下移至小肠中、后段。小肠中、后段(空肠、回肠)内,豆粕的吸收量在灌胃2 h后均显著减少(P<0.05),原因是小肠中、后段的豆粕逐渐被消化吸收进入小鼠血液循环[24],而在灌胃2~4 h,空肠与回肠内豆粕吸收量的变化趋势与胃的相似,基本保持不变,这可能与空肠和回肠内未被消化的豆粕有关[25]。胃肠消化的最后一部分是大肠,大肠前段(结肠)内,在灌胃1 h后豆粕吸收量显著减少(P<0.01),并在4 h后结肠内的豆粕吸收量显著增加(P<0.05),这可能与未被消化的豆粕残渣有关[26]。大肠后段(直肠)内的豆粕吸收量在不同时间段内无显著变化。以上研究结果类似于大豆过敏原P34在小鼠体内的吸收研究[24],随着时间的推移,豆粕吸收量在小鼠胃肠道内的不同部位均出现先增高后降低再保持平稳的趋势。
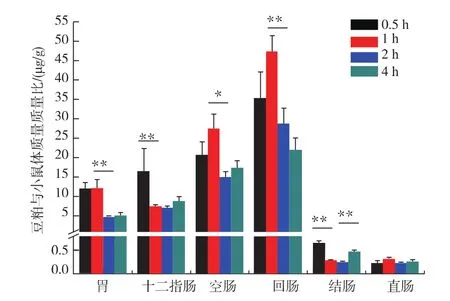
图1 不同时间段小鼠胃肠道内的豆粕质量比Fig.1 Time-dependence of gastrointestinal absorption of soybean meal in mice
2.2 胃肠道内不同部位的豆粕吸收量占比
将灌胃荧光微球组作为阳性对照组,小鼠经一次性灌胃豆粕(0.5、1、2、4 h)后,胃肠道内不同部位的豆粕吸收量占灌胃豆粕总量的比例如图2所示。小鼠在灌胃0.5 h后,胃肠道内不同部位的豆粕吸收量占比大小依次为:回肠>空肠>十二指肠>胃>结肠>直肠,胃肠道内检测到的豆粕总量为4.2%;灌胃1 h后,胃肠道内不同部位的豆粕吸收量占比大小依次为:回肠>空肠>胃>十二指肠>结肠>直肠,胃肠道内检测到的豆粕总量为4.4%;小鼠在灌胃2 h后,由于摄入的豆粕逐渐被小肠吸收进入血液循环[23],因此胃肠道内可检测到的豆粕吸收量明显减少,其豆粕总量降至2.14%,且此时胃肠道内不同部位的豆粕吸收量的变化趋势与灌胃0.5 h时相同;小鼠灌胃4 h后,胃肠道内总豆粕占比与灌胃2 h后的相差无几,为2.18%,胃肠道内不同部位的豆粕占比的变化趋势与灌胃1 h后的一致。阳性对照组的小鼠在灌胃1 h后,由于荧光微球具有耐消化性,胃肠道内可检测到的荧光微球占比为8%,高于胃肠道内检测到的豆粕总量占比,胃肠道内不同部位的荧光微球吸收量占比大小依次为:回肠>空肠>胃>十二指肠>结肠>直肠,其变化趋势与胃肠道内豆粕占比的变化趋势类似。由此可见,小鼠在灌胃后,豆粕在胃肠道内主要分布于小鼠的小肠内,也有一小部分豆粕分布于胃中,仅有少量未被吸收的豆粕残留于大肠内,这一分布规律与赵元等[11]对大豆球蛋白在仔猪胃肠道内分布情况的研究结果类似。
2.3 胃肠道内豆粕蛋白的分布
2.3.1 胃肠道的苏木精-伊红染色 灌胃豆粕1 h后,对小鼠胃和小肠进行病理组织学检查。图3(a)显示胃的组织形态完整,其中大部分细胞为胃底腺下半部的主细胞,蓝紫色一侧为黏膜层,粉红色为肌层,两者之间为黏膜下层。图3(b)显示小肠组织形态完整,小肠中固有层内的结缔组织形态正常[27],胞核与胞浆对比鲜明,近基底部被染成蓝紫色,表面一层可见的粉红色膜状结构为小肠绒毛,小肠绒毛下面覆有大量的柱状上皮细胞,在柱状上皮细胞之间夹有呈空泡状的杯细胞。由此可以推测,灌胃豆粕对小鼠的胃和小肠的组织形态不会产生破坏,也没有炎症发生的迹象。
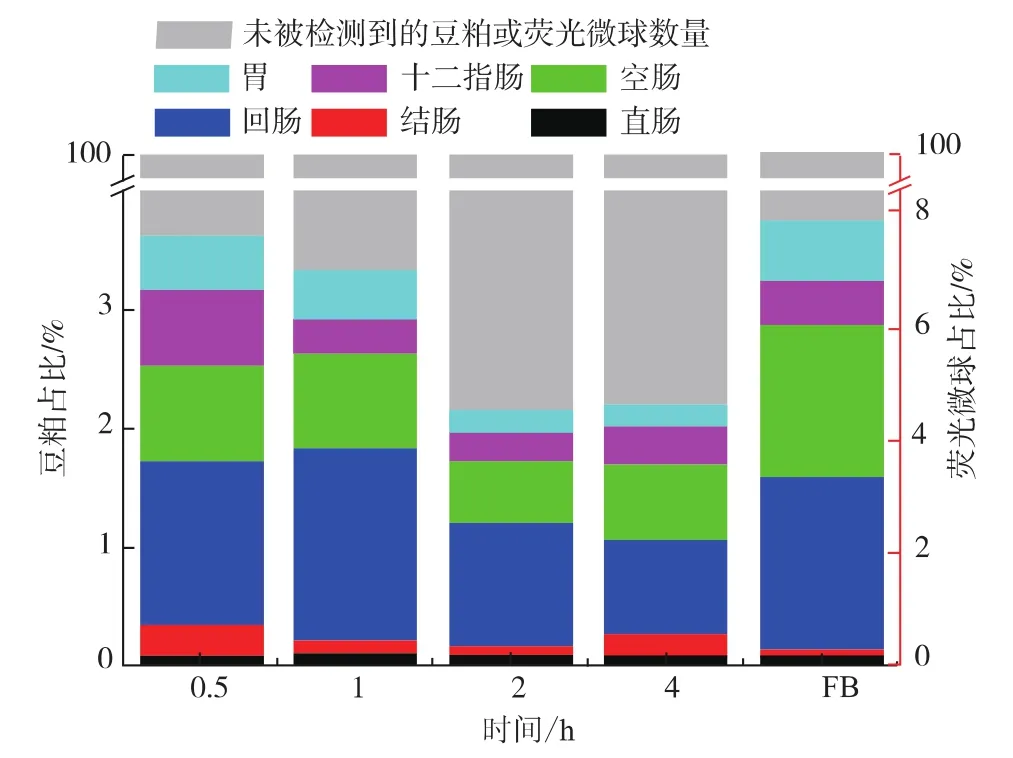
图2 不同时间段小鼠胃肠道内的豆粕占比Fig.2 Ratio of soybean meal in the gastrointestinal tract of mice after uptake
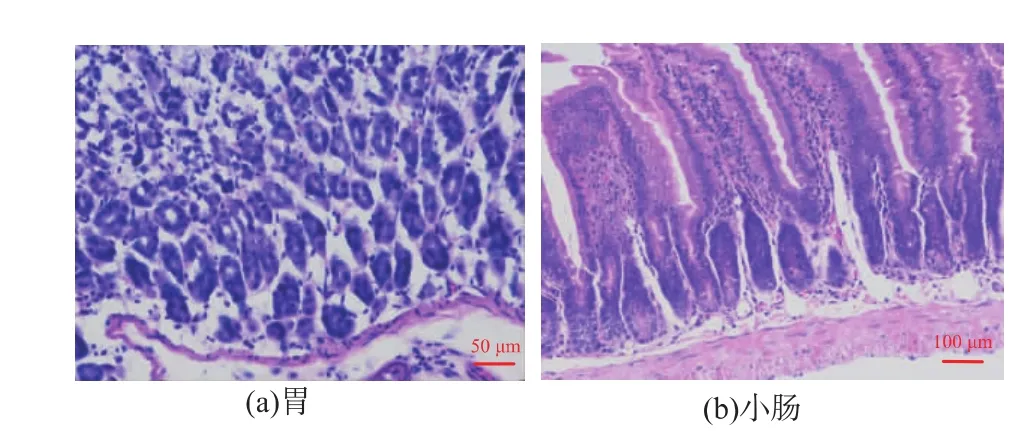
图3 胃肠道的苏木精-伊红染色Fig.3 Hematoxylin-eosin staining of gastrointestinal tract
2.3.2 胃肠道内荧光微球和豆粕蛋白的分布 由于荧光微球具有耐消化性,利用其在小鼠胃肠道内的分布,作为阳性对照。图4(a)中,在胃的内腔可以观察到大量的荧光微球,且主要分布于胃黏膜上皮。图4(b)为荧光微球在小肠内的分布情况,从图中可以看出,有一小部分荧光微球分布于小肠隐窝处,说明这部分荧光微球可能被小肠吸收,大部分荧光微球因不能被消化而聚集在小肠黏膜上皮处[28]。胃肠道中能检测到的荧光微球数量高达8%,而豆粕仅有4.4%左右,由此说明其余豆粕可能被消化降解了。图4(c,d)为可见光下的光镜图作为参照。

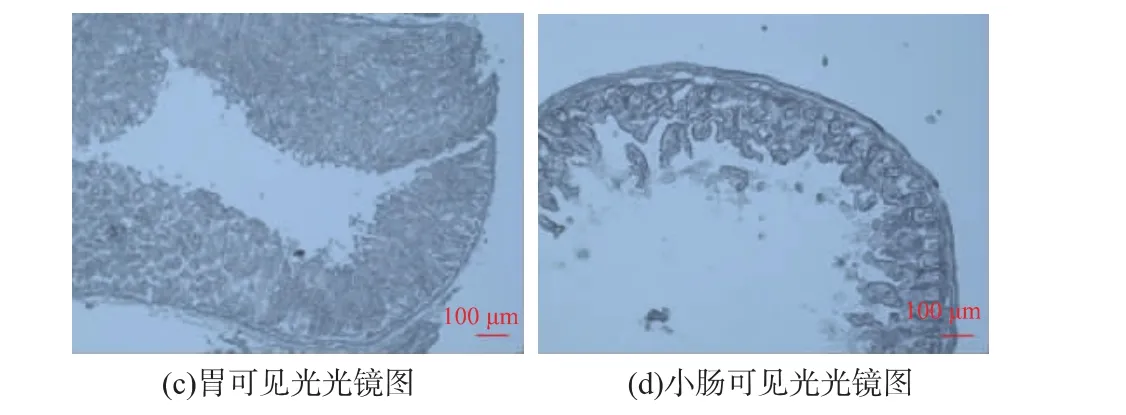
图4 灌胃1 h荧光微球在小鼠胃肠道内的分布Fig.4 Location offluorescentmicrospheresin the gastrointestinal tract of mice after 1h uptake
由小鼠胃肠道吸收豆粕量结果可知,灌胃豆粕1 h后,小鼠胃肠道内可检测到的豆粕质量比最高。因此灌胃1 h后,对豆粕中的主要成分豆粕蛋白在小鼠胃肠道不同部位的分布情况进行探究,其分布情况如图5所示。从灌胃豆粕组的图5(a-f)中可以看出,阳性信号多位于胃、十二指肠、空肠、回肠的黏膜上皮处,在小肠(十二指肠、空肠、回肠)的上皮细胞内发现了很强的阳性信号,同时在空肠、回肠的淋巴小结中也发现了阳性信号,而在大肠(结肠、直肠)中阳性信号较弱,在空白对照组(图5(g-f))中未发现阳性信号。黏膜上皮处的阳性信号表示,胃肠道内未被消化的豆粕蛋白可能黏附在胃小凹或小肠绒毛处。而能够在小肠上皮细胞内以及淋巴小结中观察到阳性信号,一是由于小肠吸收了大量具有抗原活性的豆粕蛋白(图1、图2),正如相关研究表明,β-伴大豆球蛋白在动物胃肠道内抗原活性无明显降低[29];二是可能与小肠淋巴滤泡中的M细胞和派尔集合淋巴结有关,M细胞能够吞噬胃肠道内的大分子、颗粒抗原及致病微生物并对其具有转胞吞作用[30],利用M细胞介导的转胞吞作用可以对肠腔内的豆粕蛋白进行吸收转运,进而将豆粕蛋白释放至淋巴组织;与此同时,单核吞噬细胞(Mononuclear phagocytes,MNP)可以将它们的树突直接延伸到M细胞的紧密连接处吸收小肠腔内的抗原[31],直接吞噬豆粕蛋白,进而转运释放至淋巴组织中。而在大肠(结肠和直肠)中的阳性信号较弱,可能是由于大肠主要吸收水分和无机盐,而对蛋白质的吸收较少,故分布也较少。
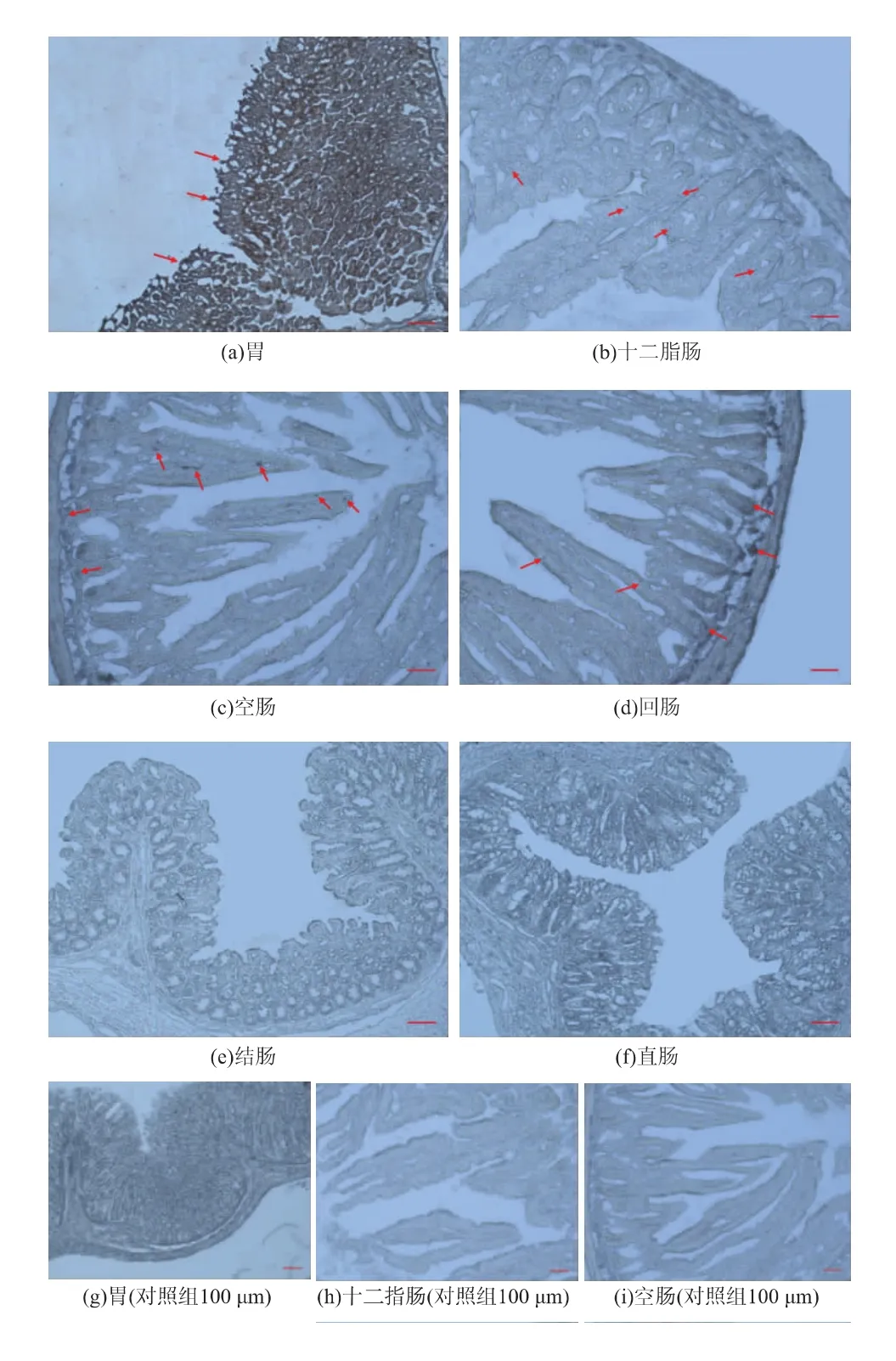

图5 灌胃1 h豆粕蛋白在小鼠胃肠道内的分布Fig.5 Location of the soybean meal protein in the gastrointestinal tract of mice after 1 h uptake
综上所述,灌胃豆粕1 h后,豆粕蛋白主要分布于小鼠的胃、十二指肠、空肠、回肠黏膜上皮处、小肠的肠上皮细胞内,以及空肠、回肠的淋巴组织中,而在结肠、直肠中几乎无豆粕蛋白分布,此分布结果与吸收定量结果一致。这说明,小鼠胃肠道对豆粕蛋白的吸收主要发生在小肠,与其他蛋白质的吸收位置相同[9,11]。
3 结 语
本研究利用豆粕中β-伴大豆球蛋白作为标记,对不同时间小鼠胃肠道内豆粕的分布进行示踪。结果表明,当小鼠摄食豆粕0.5~1 h后,豆粕蛋白主要于小肠内吸收分布,部分见于胃中,较少量残余豆粕蛋白分布于大肠内。摄食豆粕后2~4 h,豆粕蛋白在小鼠胃肠道内的吸收趋于稳定,其吸收位置和普通蛋白一致。本研究采用稳定的小鼠食物中蛋白质作为标记进行示踪,为了解食物在机体胃肠道内的吸收和分布情况提供新思路。

