利用PCR技术鉴定河豚鱼的探索
江瑞宁 万苾馨 苏新华 窦向梅
(北京市十一学校 北京 100039)
河豚鱼是我国沿海地区的传统美食,但是部分河豚鱼有剧毒,食用后会引起中毒甚至死亡[1]。我国水产品管理办法规定禁止销售野生捕捞的河豚鱼。但是我国沿海地区河豚鱼资源丰富,大量捕捞的河豚鱼通过各种非法途径混入市场,例如将野生捕捞的河豚鱼去除头和皮,作为其他的鱼种销售,或将河豚鱼制成烤鱼片等各种鱼类制品,进入市场销售。这些去除形态学特征的河豚鱼,使消费者无法辨认,致使部分消费者误食有毒河豚鱼,从而引起中毒甚至死亡。据不完全统计,2005—2016年间在我国福建、上海、浙江、山东、江苏等地即发生了8起因食用烤鱼片引起的TTX 中毒事件,造成14人中毒、5人死亡,死亡率高达36%,严重危害消费者的健康和生命安全。
传统的河豚鱼鉴定主要依赖鱼类样品外部的形态特征,不适用于鱼类制品中河豚鱼成分的鉴定。本研究利用PCR 技术,扩增河豚鱼特定靶基因DNA 片段,实现鱼类制品中河豚鱼成分的鉴定,防止消费者误食含有河豚鱼成分的鱼类样品,保护消费者身体健康。
1 材料与方法
1.1 材料
1.1.1 样品采集 河豚鱼样品由福建水产研究院提供,并经过专家鉴定。烤鱼片样品采自北京超市。
1.1.2 仪器与试剂 凝胶成像仪(美国Bio-Rad)、DNA 电泳仪(北京市六一仪器厂)、基因扩增仪(美国MJ Research)、高速离心机(德国Eppendorf)、微量可调移液器(德国Brand)、涡旋振荡器(德国IKA)、电子天平(瑞士Mettler)、微量核酸分析仪(美国NANO200)。
海洋动物组织基因组DNA 提取试剂盒、TAE缓冲液(50×TAE Buffer)、100bp DNA ladder、dNTP Mixture(10mM each)、Gene Red 核酸染料均购自天根生化公司;PCR Nucleotide Mix 和GoTaq Flexi DNA Polymerase 购自Promega 公司。
1.1.3 引物[2]:引物由北京英骏生物技术有限公司合成。
上游引物:5′-CCT ATG GCG TGA AAA ACC AC-3′
下游引物:5′-ACA AGA CCG ACG CTC TGA AT-3′
1.2 方法
1.2.1 河豚鱼基因组DNA 提取 按照海洋动物组织基因组DNA 提取试剂盒(DP324)说明书提取DNA。100μL TE 洗脱DNA,-20℃保存。
1.2.2 PCR 反应体系的优化
1)退火温度对PCR 反应结果的影响。采用温度梯度PCR 反应,选择PCR 反应的最佳退火温度。温度范围设定为42~68℃之间。PCR 反应体系的配制见表1。PCR 反应参数见表2。
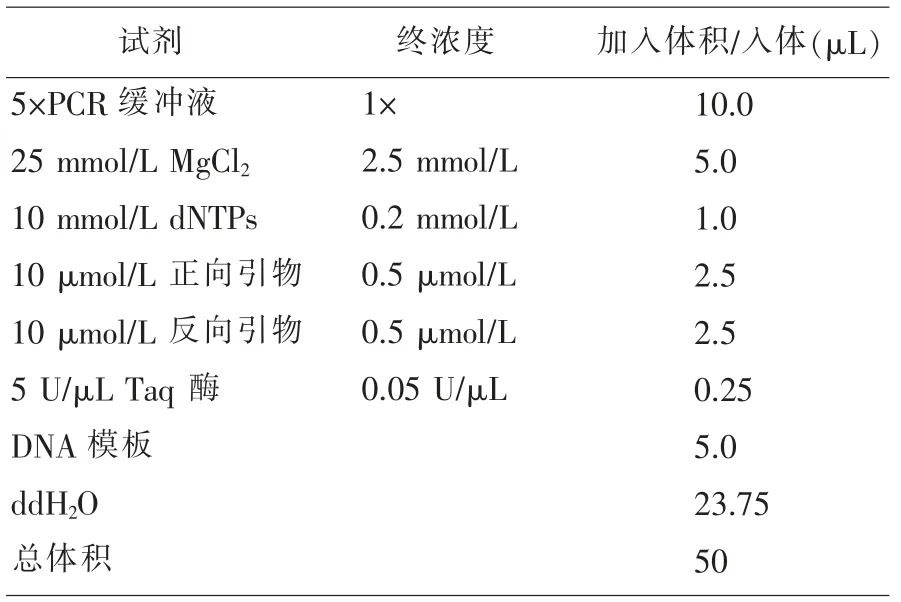
表1 PCR 检测的反应体系
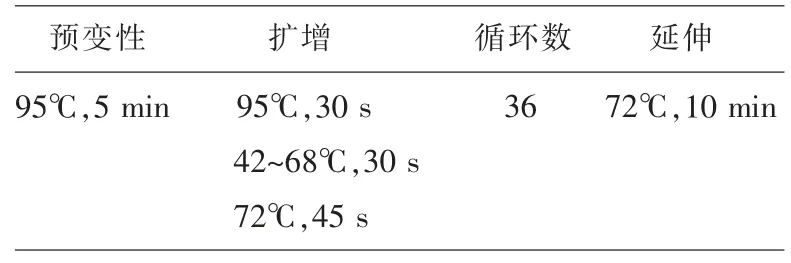
表2 PCR 检测反应参数
2)镁离子浓度对PCR 反应结果的影响。在确定了最佳退火温度后,改变PCR 反应体系(表1)中镁离子的浓度,使镁离子的终浓度分别为0mmol/L、0.5mmol/L、1.0mmol/L、1.5mmol/L、2.0mmol/L、2.5mmol/L、3.0mmol/L、3.5mmol/L、4.0mmol/L、4.5mmol/L、5.0mmol/L、5.5mmol/L,分别做PCR 反应,确定最佳镁离子的浓度。
3)DNA 模板对PCR 反应结果的影响。在确定了最佳退火温度和最佳镁离子浓度后,改变PCR反应体系(表1)中DNA 模板浓度,依次加入DNA模板量分别为0μg、0.1μg、0.2μg、0.3μg、0.4μg、0.5μg、0.6μg、0.7μg、0.8μg、0.9μg、1.0μg 和1.1μg,确定最佳的模板DNA 加入量。
1.2.3 河豚鱼成分PCR 鉴定方法与其他鱼种的交叉反应 提取市场上常见水产品鲤鱼、鲫鱼和草鱼的DNA,使用河豚鱼PCR 鉴定方法进行检测,观察河豚鱼特异性引物是否与这些鱼种有交叉反应。
1.2.4 烤鱼片样品中河豚鱼成分检测 检测从市场采集的烤鱼片样品中是否存在河豚鱼成分。
2 结果
2.1 样品中DNA 提取效果 按照试剂盒操作步骤,提取样品DNA,用NANO200仪器测定DNA的纯度和浓度(表3)。
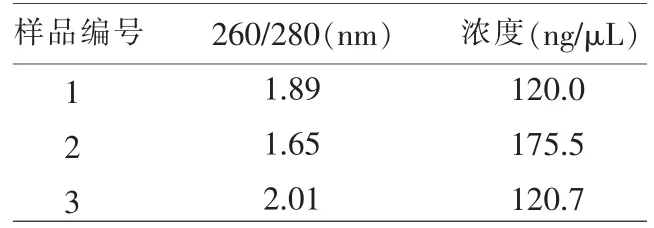
表3 河豚鱼样品DNA 提取结果
2.2 退火温度对PCR 反应结果的影响 从图1可见,随着退火温度的升高,PCR 反应的杂带逐渐减少,在退火温度为68℃时,几乎没有杂带出现,所以选择68℃为最佳退火温度。
2.3 镁离子浓度对PCR 反应结果的影响 从图2可见,当镁离子的浓度低于2.0mmol/L 时,PCR反应不能正常进行,所以选择镁离子的浓度为2.0mmol/L 作为PCR 反应的最佳镁离子浓度。
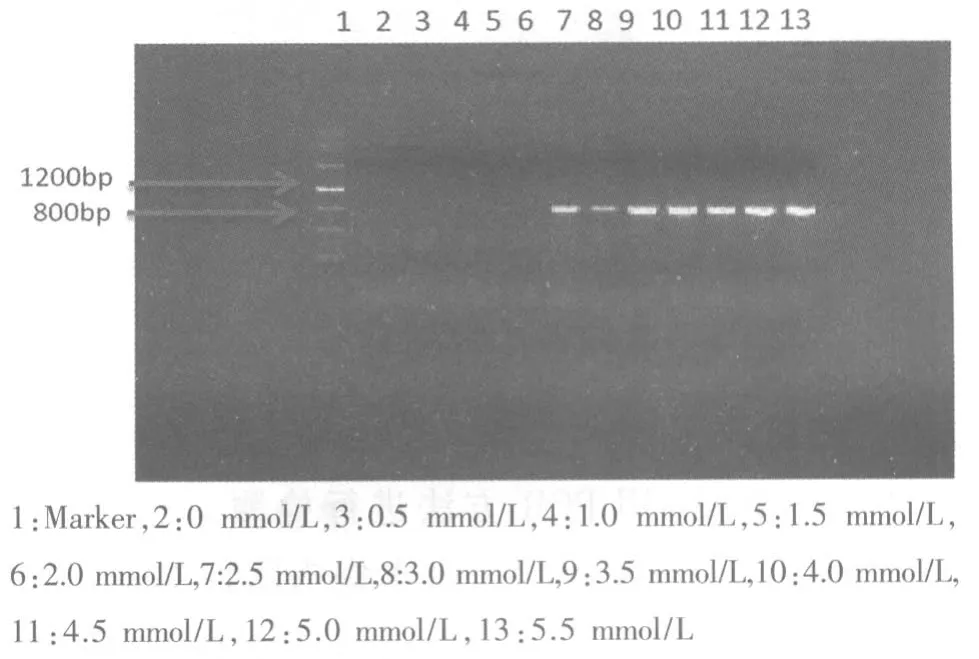
图2 镁离子浓度对PCR 结果的影响
2.4 DNA 模板浓度对PCR 反应结果的影响 从图3可见,河豚鱼DNA 的模板量达到0.1μg 时,就可以检测到河豚鱼成分。随着河豚鱼DNA 模板量逐渐增加,PCR 扩增出的条带也逐渐变粗和变亮。
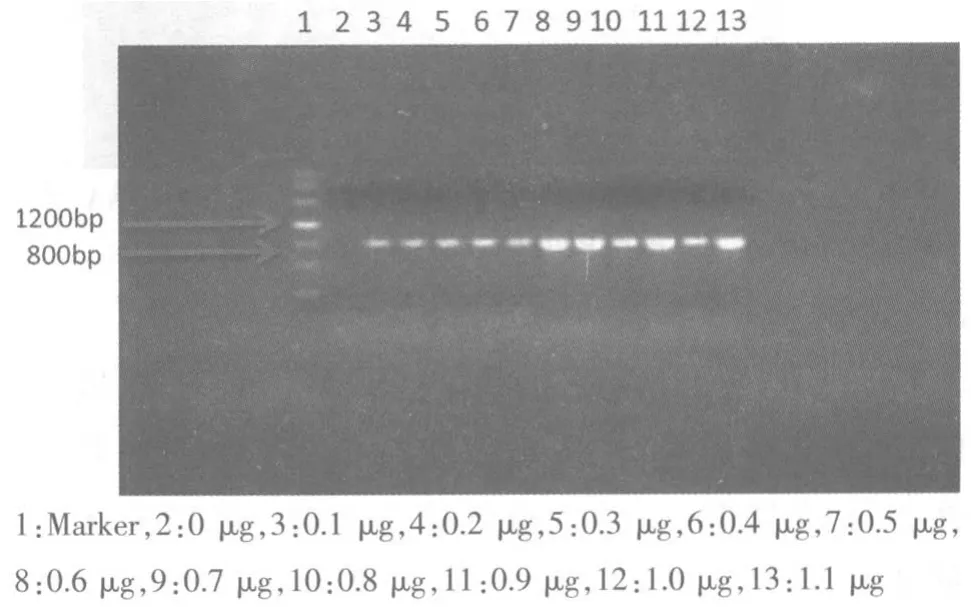
图3 DNA 模板对PCR 结果的影响
2.5 河豚鱼成分PCR 鉴定方法与其他鱼种的交叉反应 交叉反应是用本实验所建立的河豚鱼PCR 检测方法,仅能扩增出河豚鱼鱼种的DNA 条带,而不会扩增出其他常见鱼种,例如鲤鱼、鲫鱼等DNA 的条带,即通过PCR 检测,如果在800bp附近出现特异的DNA 条带,则说明一定有河豚鱼的DNA。在本实验中,提取市场上常见水产品鲤鱼、鲫鱼、青鱼和草鱼基因组DNA,进行PCR 反应,实验结果见图4。从图4可以看出,仅河豚鱼的DNA 在800bp 附近出现DNA 条带,鲤鱼、鲫鱼、青鱼和草鱼则无DNA 条带出现,说明本方法具有较好的特异性,与鲤鱼、鲫鱼、青鱼和草鱼没有交叉反应。
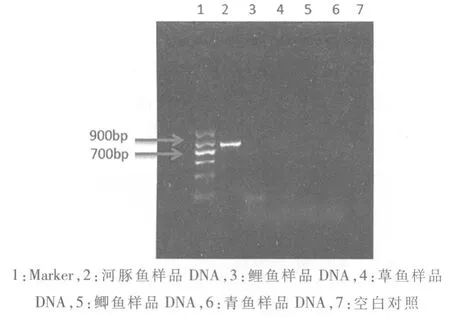
图4 河豚鱼鉴定PCR 方法特异性研究
2.6 烤鱼片样品的检测 从市场上随机购买烤鱼片样品3份,用PCR 方法进行检测,以河豚鱼样品DNA 作为阳性对照,以水作为阴性对照。电泳结果见图5。
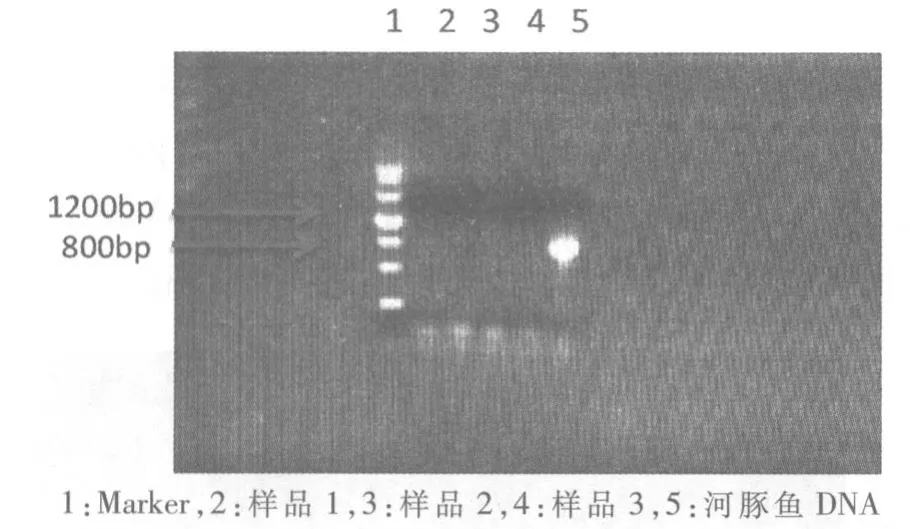
图5 烤鱼片样品中河豚鱼成分检测
3 讨论
3.1 PCR 最佳反应条件的选择 退火温度对PCR 结果有影响。退火温度越低,PCR 的非特异性扩增就越多,反之,提高退火温度,可以有效降低非特异性扩增条带的出现,结果的特异性就越好。在本实验中,为了保证较好的检测结果,选择PCR 的退火温度为68℃。
镁离子是PCR 反应必须的,低浓度的镁离子不能激活Taq 酶(DNA 聚合酶),PCR 反应不能正常进行,当镁离子达到一定浓度时,才能有效地催化Taq 酶,使PCR 反应顺利进行。本研究中,当镁离子浓度大于2.0mmol/L,才能使PCR 反应顺利进行。
模板DNA 的量对PCR 结果也有影响。适当增加模板DNA 的量,可以使电泳结果更加清晰。
本实验经过3批次重复,河豚鱼样品的DNA 均在800bp 左右出现相应电泳条带,实验结果稳定。
3.2 河豚鱼特异性靶基因的选择 应用分子标记和分子分类系统对物种进行研究的想法要追溯到1993年[3]。2002年Tautz 等首先提出DNA 分类的概念,即以DNA 为基础建立物种识别体系。2004年,Hebert 等提出利用线粒体细胞色素氧化酶亚基Ⅰ(COⅠ)的基因序列作为物种鉴定的靶基因[4-5]。随后Ward 等应用COⅠ基因序列对澳大利亚270种海洋鱼类进行研究,结果显示种内平均差异为0.39%,属内的种间平均差异9.93%,科内的种间平均差异15.5%,而目内的种间平均差异增加到22.2%~23.3%,实验证明COⅠ可以成功地对鱼类进行鉴定[6]。因此,本研究选择了河豚鱼线粒体细胞色素氧化酶亚单位Ⅰ(COⅠ)的一段长约810bp 的序列作为河豚鱼鉴定的靶基因。
3.3 关于样品检测 本研究检测的3份烤鱼片样品,没有检出河豚鱼成分。这次检测的样品数量较少,后续应检测更多的样品验证这种方法。由烤鱼片引起的河豚毒素中毒,在我国时有发生,主要是在制作烤鱼片的过程中混入了有毒的河豚鱼,致使消费者误食河豚鱼,引起中毒反应[7]。传统的形态学鉴定方法无法满足烤鱼片中河豚鱼成分的鉴定,因此,本研究尝试利用PCR 方法,针对河豚鱼特异性靶基因进行检测,鉴定烤鱼片中是否含有河豚鱼成分,防止消费者误食河豚鱼引起中毒反应,这种方法是可行的。

