HA标签的水稻水孔蛋白OsPIP2;7基因植物双元表达载体构建及转基因水稻的获得
王晓静,孙林静,孙 玥,张融雪,李军玲,闫双勇,苏京平
(天津市农作物研究所 天津市农作物遗传育种重点实验室,天津 300384)
水是植物生长发育所必需的物质,水孔蛋白(Aquaporins,AQPs)是一类可以通透水分和其他中性小分子的膜内在蛋白。根据氨基酸序列同源性比较,在大多数植物物种中,水孔蛋白被分成4类,分别是质膜内在蛋白(Plasma membrane intrinsic protein,PIP)、液泡膜内在蛋白(Tonoplast intrinsic protein,TIP)、NOD26类似内在蛋白(NOD26-like intrinsic protein,NIP)和小分子质量碱性内在蛋白SIP(Small and basic intrinsic protein,SIP)。根据文献报道,通常PIP和TIP具有较高的水分运输活性,而大部分NIP和SIP除运输少量水分子外,对中性小分子物质具有良好的通透能力[1]。
在植物中,首个被发现的水孔蛋白是液泡膜水孔蛋白γ-TIP,并通过爪蟾卵母细胞体系证明它是一个水通道蛋白[2]。水稻中共有4类水孔蛋白,其中PIP有11个,TIP有10个,NIP和SIP分别有10个和2个[3]。PIP是很重要的一类水孔蛋白,根据N-末端和C-末端的长度及活性不同,PIP又可以分为PIP1和PIP22个亚类,其中水稻中的PIP1有3个,PIP2有8个。相比PIP1,PIP2有较长的C末端与较短的N末端。PIP2个亚类通透水分和小分子的功能也有所差异,PIP1家族通透水分的能力较低,但PIP2家族有较强的水分运输效率[4]。
有研究证明,OsPIP2;7基因在水分快速转运、体内水分平衡、硼离子毒害的耐受性以及冷害耐受性有重要作用[5-7]。为了深入探索OsPIP2;7基因的生物学功能,需要利用OsPIP2;7的转基因水稻进行功能研究。本试验通过将3×HA标签连接在OsPIP2;7氨基酸的C端,得到pHB-OsPIP2;7-3×HA植物表达载体,并通过农杆菌介导的方法对中花11进行遗传转化,得到过表达OsPIP2;7转基因植株,将为研究OsPIP2;7的生物学新功能提供试验材料。
1 材料和方法
1.1 试验材料
水稻品种:中花11,由天津市农作物研究所提供。
菌株和质粒:克隆载体T-Vector pMD 19 (Simple)购自TaKaRa公司;大肠杆菌DH5α、农杆菌EHA105、质粒pHB由上海市植物生理生态研究所惠赠。
试剂和酶:Taq酶和各种内切酶购自TaKaRa公司;凝胶回收试剂盒及其他各种生化试剂购自上海生工生物工程有限公司;TRIzol购自Invitrogen公司;反转录试剂Rever Tra Ace α购自Toyobo公司;HA抗体购自Abmart公司。
1.2 试验方法
1.2.1OsPIP2;7-3×HA基因片段的克隆 根据NCBI在线数据库已公布的水稻OsPIP2;7的全长基因序列进行引物设计(表1,PIP2-F、PIP2-R),为了构建载体及鉴定载体的便利性,设计引物时分别引入Hind Ⅲ和PstⅠ酶切位点。采用嵌套PCR的方法,根据HA标签蛋白的基因序列设计引物(表1,HA-R1、HA-R2、HA-R3),同时最后一条引物引入XbaⅠ酶切位点。按照TRIzol(Invitrogen)使用说明书操作,从水稻的三叶龄叶片中提取植物总RNA,紫外分光光度计测定RNA的浓度和纯度。取2 μg提取的总RNA,根据Rever Tra Ace α(Toyobo)说明书操作,合成cDNA第一链。反应结束后,产物保存于-20 ℃。以反转录获得的cDNA第一链为模板,PIP2-F、PIP2-R为引物对OsPIP2;7进行扩增。将上一步的PCR产物稀释100倍后作为模板,PIP2-F、HA-R1为引物进行嵌套PCR的第1轮扩增反应。按照同样的方式,分别以PIP2-F和HA-R2、PIP2-F和HA-R3为引物进行嵌套PCR的第2轮和第3轮扩增反应。3轮反应结束后,将PCR产物切胶回收,连接到T-Vector pMD 19 (Simple)上,委托上海生物工程技术服务有限公司进行序列测定。
1.2.2 植物表达载体的构建 将pHB载体用Hind Ⅲ和XbaⅠ进行双酶切,电泳,切胶回收带酶切位点的pHB片段。将pMD19-T-OsPIP2;7-3×HA质粒用Hind Ⅲ和XbaⅠ进行双酶切,电泳,切胶回收带酶切位点的OsPIP2;7-3×HA目的条带。将带黏性末端的OsPIP2;7-3×HA与pHB载体连接,用热激法转化大肠杆菌DH5α感受态细胞,在含有50 mg/L卡那霉素的LB固体培养基上培养16 h后挑取单克隆振荡培养,提取的质粒用Hind Ⅲ和XbaⅠ进行双酶切检测阳性克隆。委托上海生物工程技术服务有限公司对阳性克隆进行确认,最后将正确质粒命名为pHB-OsPIP2;7-3×HA(图1)。
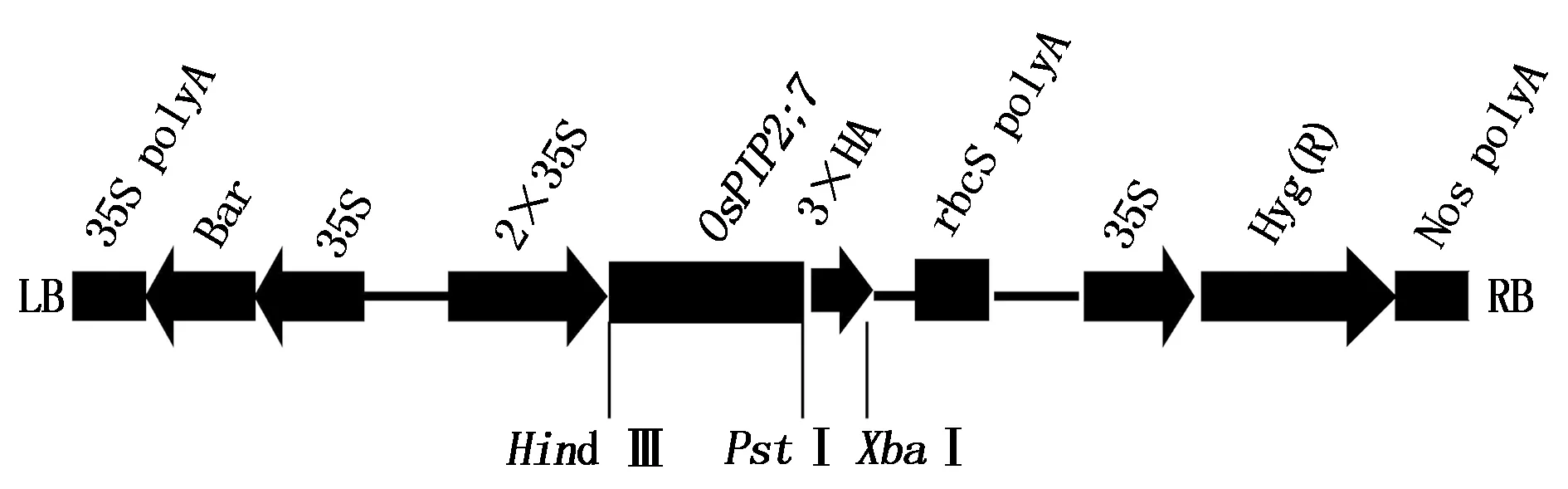
图1 植物表达载体pHB-OsPIP2;7-3×HA结构图Fig.1 Structure of plant expression vector pHB-OsPIP2;7-3×HA
1.2.3 转基因植株的获得及鉴定 将构建好的pHB-OsPIP2;7-3×HA载体用冻融交替法转化农杆菌菌株EHA 105感受态细胞,在含有50 mg/L卡那霉素和50 mg/L利福平的YEB固体培养基上培养48 h后,挑取单克隆振荡培养24~36 h,用引物PIP2-F和HA-R3进行菌液PCR扩增来检测阳性克隆。将得到的阳性农杆菌用添加乙酰丁香酮的AAM液体培养基重悬后,对粳稻品种中花11成熟胚诱导的愈伤组织进行侵染。将侵染后的愈伤组织进行不同抗生素筛选,筛选时用羧卞青霉素抑制农杆菌的生长,用潮霉素作为阳性愈伤组织的筛选剂,得到的阳性愈伤组织经过预分化与分化后生绿色芽,待芽长至2~3 cm后放入生根培养基中壮苗。选取发育良好的生根植株(以中花11为对照),用CTAB法提取植株的基因组DNA,潮霉素引物(表1,HYG-F、HYG-R)进行PCR扩增,1.0%琼脂糖进行凝胶电泳。

表1 扩增OsPIP2;7-3×HA与HYG基因的PCR特异引物序列Tab.1 The sequences of primers for amplification of OsPIP2;7-3×HA and HYG
注: 小写字母为酶切位点序列。
Note:Small case letters are the sequence of enzyme sites.
1.2.4 RNA水平上鉴定转基因植株 提取1.2.3中使用潮霉素引物筛选到的OsPIP2;7水稻转基因阳性植株的RNA,使用Rever Tra Ace α进行cDNA 反转录。将反转录的第一链cDNA为模板,目的基因OsPIP2;7的引物(P27RT-F和P27RT-R)与管家基因OsUBI的引物(UBIRT-F和UBIRT-R)进行PCR扩增,筛选RNA水平上过表达OsPIP2;7的水稻转基因植株。反应体系为20 μL,包括:ddH2O 12.5 μL、10×Buffer(含20 mmol/L Mg2+) 2 μL、引物(10 μmol/L)2 μL、dNTP(2.5 mmol/L) 1 μL、Tag DNA聚合酶(2 U/μL) 0.5 μL、DNA模板2 μL。反应条件为:94 ℃ 10 min;94 ℃ 30 s,60 ℃ 50 s,72 ℃ 1 min,28个循环或者32个循环;72 ℃ 10 min。PCR扩增产物用1%琼脂糖凝胶电泳检测,于凝胶成像分析系统下观察并拍照。
1.2.5 膜蛋白的提取 液氮冻存水稻叶片组织研成粉末,倒入加有0.5 mL 裂解缓冲液(150 mmol/L NaCl, 10 mmol/L Tris-HCl, pH 值7.4, 1%V/V10 mmol/L PMSF)的离心管内。将离心管放冰水浴,加入等体积预冷的稀释缓冲液(300 mmol/L NaCl, 20 mmol/L Tris-HCl, pH值 7.4, 4%V/VTriton X-114),总体积1 mL。振荡完毕后离心管放冰水浴10 min。4 ℃,12 000 r/min离心5 min,将上清液转移到新管,弃沉淀。将装有上清裂解液的小管置于37 ℃水浴,不时振荡,孵育20 min后,溶液分为两相。12 000 r/min离心5 min,吸取上层水相,弃去。加入0.5 mL预冷的稀释缓冲液与下层油状相混合,振荡后冰水浴10 min。将含膜蛋白的油状下层相转移到新管,加入9倍体积的预冷的丙酮,-20 ℃过夜。4 ℃,12 000 r/min离心10 min。弃上清,干燥沉淀,加入100 μL水后进行蛋白质定量。
1.2.6 蛋白免疫印迹 SDS-PAGE 采用Mini-PROTEAN Tetra Cell (Bio-Bad)垂直电泳系统。浓缩胶浓度为3%,分离胶浓度为12%,凝胶厚度为0.75 mm。将定量后的蛋白质溶液加入上样孔中,每孔加蛋白30 g进行电泳(电泳缓冲液为:3.03 g/L Tris, 14.4 g/L Gly, 1 g/L SDS)。电泳条件为:100 V电泳15 min,150 V至电泳结束,时间为1.0~1.5 h。
转膜:将电泳结束后的凝胶浸泡于转膜缓冲液(3.03 g/L Tris, 14.4 g/L Gly, 200 mL/L甲醇)中,期间准备转膜所用的3 M滤纸和PVDF膜。首先将PVDF膜在甲醇中浸泡数秒,再浸泡于转膜缓冲液中,3 M滤纸也浸泡于转膜缓冲液中。应用Mini-PROTEAN Ⅱ Cell (Bio-Bad)转印系统转膜。转膜条件为:100 V湿转1 h。
免疫印迹:脱脂奶粉封闭1 h,1∶3 000 anti-HA (Abmart)抗体孵育2 h,PBST溶液洗3遍,每遍10 min。二抗(HRP-conjugated secondary antibody, Santa Cruz)孵育1 h,PBST洗3遍,每遍10 min。使用增强化学发光法,将HRP底物ECL发光液(Pierce)1∶1等体积混合,将混合物覆盖在PVDF膜表面,摇晃均匀并反应1~2 min,保鲜膜将PVDF膜包好后,用化学发光成像系统Chemi DocTM XRS+(Bio-Rad)扫描并拍照。
2 结果与分析
2.1 OsPIP2;7-3×HA基因片段的克隆
以水稻全长cDNA第一链为模板,使用PIP2-F和PIP2-R为引物进行PCR反应,扩增产物经1%琼脂糖凝胶电泳结果显示,片段大小为882 bp(图2-A)。嵌套PCR的3轮扩增产物经1%琼脂糖凝胶电泳结果显示,片段大小分别为911,937,969 bp(图2-B),与预期片段大小一致。将嵌套PCR的终产物切胶回收后,与T-Vector pMD 19 (Simple)连接,转化大肠杆菌获得阳性克隆,测序后经与NCBI上公布的目的基因OsPIP2;7与HA标签蛋白的核酸序列进行比对分析,结果表明,OsPIP2;7-3×HA基因片段克隆正确。

A. 以PIP2-F和PIP2-R为引物的PCR扩增结果;B. 嵌套PCR的扩增结果。HA1. 以PIP2-F和HA-R1为引物的PCR扩增结果;HA2.以PIP2-F和HA-R2为引物的PCR扩增结果;HA3. 以PIP2-F和HA-R3为引物的PCR扩增结果。M. 分子质量标记DL2000。
A. PCR results ofOsPIP2;7when usingPIP2-F andPIP2-R as primers; B. PCR results of nested PCR. HA1. PCR results ofOsPIP2;7-3×HAwhen usingPIP2-F andHA-R1 as primers; HA2.PCR results ofOsPIP2;7-3×HAwhen usingPIP2-F andHA-R2 as primers; HA3. PCR results ofOsPIP2;7-3×HAwhen usingPIP2-F andHA-R3 as primers. M. Molecular Marker DL2000.
图2OsPIP2;7-3×HA基因片段的PCR扩增
Fig.2 PCR amplification ofOsPIP2;7-3×HAgene segment
2.2 植物表达载体的构建及转化农杆菌
含目的基因质粒pMD 19-TOsPIP2;7-3×HA及植物双元表达载体pHB经Hind Ⅲ和XbaⅠ进行双酶切(图3-A,B)、酶切产物切胶纯化后,于16 ℃连接3 h,产物经热激法转化大肠杆菌DH 5α感受态,挑取卡那抗生素平板上的单菌落进行阳性重组子的筛选及鉴定。Hind Ⅲ和XbaⅠ双酶切鉴定结果显示2条带,其中目的基因片段大小为969 bp(图3-C)。DNA测序结果显示,pHB-OsPIP2;7-3×HA植物表达载体构建成功。
将pHB-OsPIP2;7-3×HA质粒转化农杆菌菌株EHA 105后,用PIP2-F和HA-R3引物进行PCR扩增,凝胶结果显示目标条带与预期结果一致(图3-D),表明所构建的pHB-OsPIP2;7-3×HA载体已成功转入农杆菌中。

A. pMD 19-TOsPIP2;7-3×HA质粒用Hind Ⅲ和XbaⅠ酶切;B. pHB空载体用Hind Ⅲ和XbaⅠ酶切;C. pHB-OsPIP2;7-3×HA阳性克隆用Hind Ⅲ和XbaⅠ酶切;D. pHB-OsPIP2;7-3×HA质粒转化农杆菌EHA 105后,用引物PIP2-F和HA-R3扩增的PCR产物。1. pMD 19-TOsPIP2;7-3×HA质粒酶切结果;2.pHB空载体酶切结果;3. pHB-OsPIP2;7-3×HA阳性克隆酶切结果;4. 农杆菌中转入pHB空载体后的PCR扩增结果;5. 农杆菌中转入pHB-OsPIP2;7-3×HA载体的阳性克隆PCR扩增结果。M1. 分子质量标记DL2000;M2.分子质量标记DL5000。
A. Restriction enzyme identification ofHind Ⅲ andXbaⅠ;B. Restriction enzyme identification ofHind Ⅲ andXbaⅠ;C. Restriction enzyme identification ofHind Ⅲ andXbaⅠof a positive pHB-OsPIP2;7-3×HAclone; D. PCR results of the transformed pHB-OsPIP2;7-3×HAinto theAgrobacteriumstrains of EHA 105 when usingPIP2-F andHA-R3. 1. Enzyme identification of pMD 19-TOsPIP2;7-3×HA; 2.Enzyme identification of pHB empty vector;3.Enzyme identification of pHB-OsPIP2;7-3×HA; 4. PCR results of the transformed pHB into theAgrobacteriumstrain; 5. PCR results of the transformed pHB-OsPIP2;7-3×HAinto theAgrobacteriumstrain. M1. Molecular Marker DL2000. M2.Molecular Marker DL5000.
图3 植物表达载体pHB-OsPIP2;7-3×HA的构建
Fig.3 Construction of plant expression vector pHB-OsPIP2;7-3×HA
2.3 转基因植株的获得及检测
2.3.1 潮霉素筛选OsPIP2;7转基因水稻 提取23个转基因水稻植株的全基因组DNA,用潮霉素引物进行PCR扩增。结果显示,除了#1、#16单株没有条带,其余植株均扩增出550 bp的预期片段,对照植株中花11中没有出现电泳条带(图4),符合预期结果。说明pHB-OsPIP2;7-3×HA载体已经成功转入水稻的基因组中。
2.3.2 筛选OsPIP2;7转基因水稻在RNA水平表达上升的株系 提取12株潮霉素阳性的转基因水稻总mRNA,反转录成第一链的cDNA为模板,管家基因OsUBI的表达量为对照,通过半定量PCR的方法来检测OsPIP2;7转基因水稻不同植株的OsPIP2;7表达量。半定量PCR结果显示,#12、#13、#19、#20植株的OsPIP2;7的表达量比中花11高很多(图5),成功得到在RNA水平上过表达OsPIP2;7的转基因水稻。

ZH11. 阴性对照植株中花11;1-23. 转基因水稻不同株系;M. 分子质量标记DL500。ZH11. Zhonghua 11 as negative control; 1-23. Different lines of transgenic rice; M. Molecular marker DL500.

ZH11. 阴性对照植株中花11;11、12、13、15、17、19、20. 转基因水稻不同株系;M. 分子质量标记DL2000。ZH11. Zhonghua 11 as negative control; 11,12,13,15,17,19,20. Different lines of transgenic rice. M. Molecular marker DL2000.
2.3.3 筛选OsPIP2;7转基因水稻在蛋白质水平表达上升的植株 提取5株RNA水平上过表达OsPIP2;7转基因水稻植株的膜蛋白,由于HA与OsPIP2;7为融合蛋白,OsPIP2;7的单克隆抗体较难制备,并且费用昂贵,所以用HA抗体检测OsPIP2;7-HA的蛋白质表达量。Western-blot结果显示,HA标签蛋白在这5株转基因植株中都有表达(图6),说明在OsPIP2;7转基因水稻中,去除水稻中OsPIP2;7的本底表达,OsPIP2;7在蛋白质水平上过表达。

ZH11. 阴性对照植株中花11;1、12、13、19、20. 转基因水稻不同株系;M. 蛋白质分子质量标记。ZH11. Zhonghua 11 as negative control; 1,12,13,19,20. Different lines of transgenic rice; M. Protein molecular weight Marker.
3 结论与讨论
在水孔蛋白发现之前,人们一致认为水分是通过自由扩散的方式进出膜脂双层的,直至1992年第一个水孔蛋白的发现,人们才知道水孔蛋白是水分通过细胞膜的最主要方式[8]。水分参与了植物从种子萌发到衰老死亡的所有过程,维持体内的水分平衡是植物每时每刻都在进行的活动,水孔蛋白在其中起到重要的作用[9-13]。在植物的不同物种中克隆到水孔蛋白,并进行功能分析后发现,水孔蛋白除了具有水分选择性运输功能之外,还可以选择性的通透尿素[14]、甘油[15]、二氧化碳[16]等小分子和硅[17-18]、硼[6]等营养元素。植物的任何生命活动都离不开水,维持体内的水分平衡对于植物的生命活动至关重要,因此,水孔蛋白对于植物在正常或者胁迫生长条件下的生长发育发挥了重要的作用。
OsPIP2;7的生物学功能已有报道[5-7],为探索OsPIP2;7的新功能,需要利用OsPIP2;7的转基因水稻进行功能研究。由于水孔蛋白作为膜蛋白本身的特性,主要是低丰度、疏水性等原因,导致水孔蛋白抗体获得难度大,商业化的水孔蛋白抗体价格昂贵,并且水稻中的水孔蛋白家族成员多,与OsPIP2;7同源性较高的蛋白有很多,使用OsPIP2;7作为抗体检测不同转基因株系中OsPIP2;7的蛋白质表达量时,在Western-blot试验时,难以确定检测得到的蛋白量是否为OsPIP2;7的实际表达量,因此,很有必要使用标签蛋白系统。目前,市场上应用较广的标签系统包括myc、HA、Flag、His、GST等,其中HA标签系统利用一个HA(流感病毒血凝素,Influenza hemagglutinin epitope:YPYDVPDYA)短肽融合到目标蛋白。HA标签抗体能特异识别C末端或N末端带有HA标签的融合蛋白,也可以用于检测与HA标签融合表达蛋白的表达、细胞内定位,以及纯化、定性或定量检测HA标签融合表达蛋白等。因此,本试验在植物表达载体构建时,在OsPIP2;7氨基酸的C末端添加3个HA标签用于目的蛋白的检测,这对于研究OsPIP2;7的生物学新功能具有重要的意义。该载体的构建解决了使用水孔蛋白抗体检测OsPIP2;7的蛋白质表达量试验中,可以检测到大量同源蛋白,致使检测到的蛋白质表达量不准确的问题。
已有诸多研究表明,水分亏缺、高温、低温、盐胁迫、CO2浓度升高、养分缺乏等非生物逆境胁迫均可改变水孔蛋白的表达,进而影响水分通透活性[19-24],但通过转基因的方式将水孔蛋白在植株体内高表达,并进行基因功能研究的报道较少,本研究构建pHB-OsPIP2;7-3×HA载体并获得了转基因植株,对后续OsPIP2;7新功能的研究提供了试验基础。

