MDCK细胞悬浮驯化及对H9亚型禽流感病毒敏感性的研究
习 硕,赵 蕾,史爱华,章振华,李 林,沈 佳,崔丽娜,姜北宇,张建伟
(北京市农林科学院畜牧兽医研究所,北京 100097)
禽流感 (Avian influenza, AI) 是由禽流感病毒(Avian influenza virus, AIV)引起的禽流行性感冒。自1878年首先在意大利发现以来,全世界范围内都有禽流感毒株引起的流感的流行,不仅给养禽业造成巨大的经济损失,还给人类的公共卫生带来严重威胁[1]。接种由流行毒株制备的疫苗,是预防禽流感最有效的手段。目前,国内的禽流感病毒疫苗抗原主要采用鸡胚增殖的方法制备,然而使用鸡胚制苗存在以下缺点:首先,病毒在鸡胚中的连续传代易造成HA基因发生变异[2-3],从而导致病毒的免疫原性和病毒毒力的变化;其次,收获的尿囊液中存在的鸡胚杂质可造成被免疫鸡的过敏反应;第三,大规模生产时鸡胚来源不同,致使抗原批间一致性差;最后,收获毒液后残留的带毒鸡胚,处理不当也会造成潜在生物安全危害,为此急需寻求一种新的模式制备禽流感疫苗抗原[4]。
利用传代细胞制备疫苗抗原为解决以上问题提供了思路,该方法制备的抗原具有稳定、重复性高、变态反应少等优点,在流感疫苗抗原制备领域,很多学者对MDCK细胞制备禽流感疫苗抗原进行了研究,MDCK细胞是由Madin 和 Darby采用健康雄性英国小猎犬(cocker spaniel)的肾脏建立的细胞系[5],由于该细胞系对各种禽流感病毒均较敏感,已广泛应用于禽流感病毒的检测及培养领域,同时认为MDCK细胞最适合用于增殖禽流感病毒[6-7]。但多数研究以贴壁培养为主,本研究拟对MDCK贴壁细胞进行纯悬浮驯化,以简化将来用于大规模生物反应器培养时的培养工艺。
采用MDCK纯悬浮细胞连续传代培养增殖禽流感病毒制备禽流感疫苗抗原与采用鸡胚制备疫苗抗原相比,不仅疫苗抗原的纯度更高,而且还可以降低处理鸡胚废弃物的成本,减少生物安全危害,不仅有重要的实用价值还有社会意义。本试验进行了MDCK贴壁细胞的悬浮驯化研究,以之作为基质制备禽流感病毒疫苗抗原,为采用更安全、高效、质量可控的细胞培养方式生产禽流感疫苗抗原工艺奠定基础。
1 材料和方法
1.1 材 料
1.1.1 细胞株和病毒株 贴壁MDCK细胞株购自中国兽医药品监察所,传代至F71;H9亚型禽流感病毒BX13株由北京市农林科学院畜牧兽医研究所免疫预防研究室2013年从北京某鸡场分离、纯化及鉴定,毒株代号为A/Chicken/Beijing/BX/13(H9N2)株(BX13),HA效价为29,毒价为107.7EID50/0.1mL。
1.1.2 鸡胚 10日龄SPF鸡胚购自北京梅里亚维通实验动物科技有限公司。
1.1.3 主要试剂 DMEM培养液购自HyClone公司;无血清培养基MS01购自苏州市沃美生物技术有限公司;胎牛血清(FBS)购自PAN公司;台盼蓝染液购自Sigma公司;TPCK-Trypsin购自Gibco公司;1%鸡红血球由本研究室采集成年公鸡血液制备;T25、T175、T225细胞培养瓶购自Corning公司;250 mL三角瓶购自Corning公司。
1.1.4 仪器设备 细胞摇床购自上海一恒科技有限公司;倒置显微镜购自上海光学仪器厂;血球计数板购自上海市求精生化试剂仪器有限公司。
2 方 法
2.1 MDCK贴壁细胞无血清培养基适应驯化 MDCK贴壁细胞用含10% FBS高糖DMEM培养基37 ℃ 5% CO2静置培养至细胞状态良好。待细胞生长至90%,弃去培养液,加入含有5% FBS 的培养液,培养细胞直至细胞长满;逐渐减少培养基中FBS含量,直至细胞完全适应含1% FBS的DMEM,用无血清培养基MS01替代含有血清的DMEM。
2.2 MDCK贴壁细胞的悬浮驯化 将适应了无血清培养基的MDCK细胞消化转移至250 mL三角瓶,细胞初始接种密度为5×105/mL,培养体积为50 mL,将三角瓶置于摇床上,转速为100 r/min,37 ℃ 5% CO2培养。每48 h取出驯化的细胞,1000 r/min离心5 min,弃上清,取沉淀细胞用新鲜培养基重悬,继续培养直至细胞比生长速率稳定,进行分瓶传代,使细胞进一步适应,直至MDCK细胞完全失去贴壁的能力,以悬浮方式稳定增殖,悬浮细胞命名为MDCK-sus。
2.3 细胞计数及形态观察 以台盼蓝染色法,用血球计数板计活、死细胞数,绘制细胞生长曲线。
2.4 禽流感病毒在MDCK悬浮细胞中的增殖 取生长良好的MDCK-sus细胞分别稀释成密度为5×105/mL、1.0×106/mL、1.5×106/mL、2.0×106/mL,置于三角瓶中,每瓶的培养体积为50 mL,以感染复数(MOI)=0.01接种H9亚型禽流感病毒BX13株,同时加入TPCK-Trypsin使其终浓度为3.5 μg/mL,接种完毕后将三角培养瓶放置在细胞摇床上,转速为100 r/min, 35 ℃ 5% CO2进行振荡培养;每24 h取样测定培养液上清的HA价。
2.5 病毒HA效价的测定 测定方法为在96孔血凝板中每孔加入50 μL生理盐水,第1孔加入50 μL待检细胞培养上清,充分混匀后取50 μL加入第2孔,依次进行倍比稀释至第10孔,并设阳性、阴性和空白对照孔,稀释完毕后每孔中加入50 μL 1%鸡红细胞悬液,振荡混合,室温静置20~30 min,观察记录结果,测定结果取以log2为底的倍数表示。
2.6 病毒EID50的测定 接毒后72 h,收获培养的4个细胞密度制备的病毒液,放入-20 ℃冰箱冻融2次,取2.0×106/mL细胞密度制备的病毒液用灭菌生理盐水作10倍系列稀释,取10-6、10-7、10-8、10-94个稀释度,各尿囊腔内接种10日龄SPF鸡胚5枚,每胚0.1 mL,置于37 ℃孵育120 h,每24 h照蛋一次,弃去24 h内死亡鸡胚,逐个收获48~120 h鸡胚液,分别测定HA效价,HA效价不低于1∶16判为感染,按照Reed-Muench法计算EID50。
3 结果与分析
3.1 MDCK贴壁细胞无血清培养基适应驯化 复苏MDCK贴壁细胞,用含10% FBS的DMEM培养基培养,逐渐降低血清含量至1%,低血清驯化初期,MDCK细胞生长环境从含10% FBS的DMEM过渡到5% FBS的DMEM时,细胞未表现明显的不适应,细胞生长速度未放缓,细胞形态未出现肉眼可见的变化;当驯化适应至1% FBS条件时,MDCK细胞生长速度比10% FBS组稍慢,细胞伸展拉伸,经过一段时间的驯化,细胞已适应1%血清生长环境,生长速度逐渐恢复,生长状态良好,但细胞形态出现变圆趋势,贴壁较松散,少量细胞甚至悬浮于培养基呈现悬浮生长状态。用无血清培养基MS01替换含1%血清的DMEM培养基。
3.2 MDCK贴壁细胞的悬浮驯化 细胞无血清全悬浮驯化初期,细胞生长速率较低,经过一段时间的传代,细胞适应。以5×105/mL的密度转移细胞至250 mL三角瓶,培养体积为50 mL, 转速为100 r/min, 每24 h观察细胞生长状态,在MS01无血清培养基悬浮驯化后期,MDCK细胞边缘清晰,表现完整的单细胞悬浮生长状态,细胞大小较均一,结团现象较少,经过48 h的培养,细胞密度达到2.5×106/mL。倍增时间为24 h,细胞活率达到99%以上,说明MDCK细胞已经完全适应了无血清全悬浮生长环境。
3.3 细胞计数及形态观察 MDCK贴壁细胞经培养驯化,细胞状态如图1,MDCK悬浮细胞生长曲线及对应细胞密度如图2和表1。

A: 正常MDCK贴壁细胞;B: 适应低血清生长环境的MDCK细胞;C:无血清驯化后MDCK细胞悬浮培养形态A: Normal MDCK adherent cells;B: Adapted to low serum environment MDCK cells;C: All suspension MDCK cells图1 MDCK细胞悬浮培养Fig 1 Suspension culture of MDCK cells
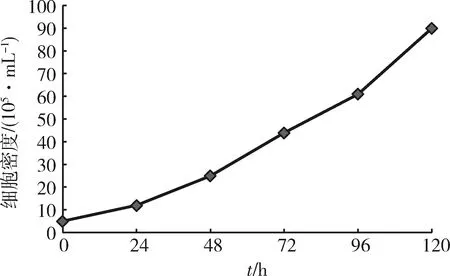
图2 MDCK悬浮细胞生长曲线Fig 2 The growth curve of MDCK suspension cell
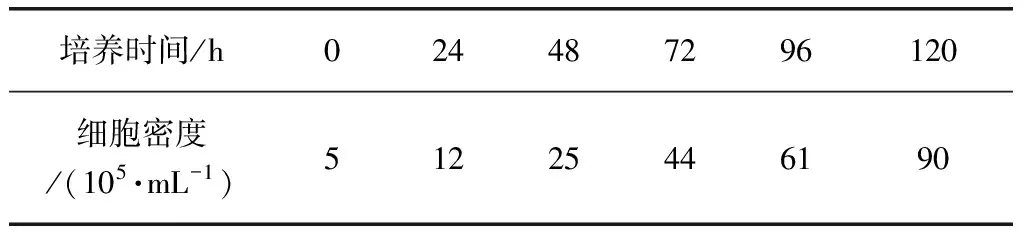
培养时间/h024487296120细胞密度/(105·mL-1)51225446190
3.4 禽流感病毒在MDCK悬浮细胞中的增殖 以不同密度的MDCK悬浮细胞进行H9亚型禽流感病毒BX13株的培养,添加3.5 μg/mL的TPCK-Trypsin,感染复数(MOI)为0.01,每24 h取样观察细胞病变,结果显示接毒后24 h和48 h的细胞活率分别为98%和94%,72 h的细胞病变率为100%。
3.5 病毒HA效价的测定 每24 h取样测定培养液HA滴度,结果见表2。
3.6 病毒EID50的测定 将H9亚型禽流感病毒BX13株以适宜的MOI和TPCK胰蛋白酶浓度接种密度为2.0×106/mL的细胞,收获培养72 h接种制备的病毒液,测定培养液病毒含量为108.5EID50/0.1 mL(表3)。
4 讨论与结论
我国兽医生物制品行业多采用鸡胚接种收获尿囊液的方式制备禽流感疫苗抗原,但鸡胚接种制备疫苗抗原存在诸如鸡胚来源不固定,有外源病毒污染的可能等因素。以传代动物细胞生产病毒疫苗抗原,可在短时间内增殖大量病毒,既能在短期内提供足够数量的疫苗抗原,又能保证产品的效果和安全性,同时可以降低病毒在鸡胚中连续传代可能导致病毒变异的风险。

表2 MDCK悬浮细胞密度对H9亚型禽流感病毒抗原HA滴度的影响Tab 2 Effect of MDCK suspension cells density onHA titer of H9 subtype AIV antigen
表3 MDCK悬浮细胞制备的H9亚型禽流感病毒抗原EID50测定结果Tab 3 Results of the EID50titer of H9 subtypeAIV antigen prepared by MDCK suspension cells
有研究表明,禽流感病毒在MDCK细胞中能够增殖稳定,适应性较强[8-9],因此以MDCK细胞作为载体制备禽流感疫苗抗原越来越受到重视,其生物安全性也已经得到了世界各国的广泛认可。早期很多学者[10-11]也对微载体培养禽流感病毒的方式进行了研究探索,采用微载体作为细胞附着基质增殖MDCK细胞生产禽流感疫苗抗原,步骤繁琐、污染风险大、生产成本高,此外,由于微载体培养存在微载体处理,放大困难等诸多问题因此没有能够在禽用疫苗领域推广。
全悬浮MDCK细胞的大规模培养,可以根据需求有效扩大细胞密度,解决疫苗产量低的问题,同时降低生产成本。本实验中,采用逐渐降低血清含量直至无血清培养的方法,最终获得了能够在无血清培养基中培养的MDCK悬浮细胞株,此株细胞可以稳定增殖传代,本研究掌握了一种从贴壁细胞到悬浮细胞驯化的方法,其他贴壁细胞的驯化也可借鉴此种方法。
文献报道采用类似方法悬浮驯化细胞,细胞倍增时间约48 h[12]。本实验所获得的悬浮细胞倍增时间为24 h,在营养充足的条件下适应高密度生长,有利于缩短细胞的培养时间,对规模化生产具有重要意义,并保持较高的活率,满足增殖禽流感病毒的要求。
本实验获得的MDCK悬浮细胞株对H9N2 BX13株禽流感病毒敏感,将该病毒株以适量的MOI和适合的TPCK胰蛋白酶浓度接种细胞密度为1.0×106/mL~2.0×106/mL的细胞液时,接毒后72 h培养液的HA毒价可以达到7log2~9log2,每0.1 mL的EID50达到108.5,证明该细胞株适合用于禽流感病毒抗原的制备,可以作为制备禽流感病毒抗原的候选细胞株,该细胞株对禽流感病毒的增殖能力与MDCK贴壁细胞相当。陈宏等对重组禽流感病毒H5亚型Re-7在MDCK细胞上增殖条件的研究中报道[13],贴壁细胞增殖病毒操作过程繁琐,同一批次不同细胞瓶中病毒滴度存在差异,时间成本大。采用MDCK悬浮细胞繁殖病毒产量远高于鸡胚培养和贴壁细胞培养,并且同一批次病毒质量均一稳定,为后续生物反应器逐级放大培养制备禽流感疫苗奠定了基础。
本研究通过逐步降低血清的方法使MDCK贴壁细胞适应无血清培养,获得了能够快速增殖并对H9亚型禽流感病毒敏感的MDCK纯悬浮细胞株,该细胞株为将来规模化使用生物反应器生产制备禽流感疫苗抗原奠定了基础。

