基于SSR荧光标记进行酒花品种鉴定
张志军,邢磊,岳杰,刘佳,尹花
(啤酒生物发酵工程国家重点实验室,青岛啤酒股份有限公司,山东 青岛, 266100)
酒花(HumlnusLupulus)为大麻科葎草属多年生蔓性草本植物,雌雄异株,雌花是啤酒酿造重要的组成成分。酒花被誉为“啤酒酿造的灵魂”,不仅赋予啤酒爽口的苦味和独特的酒花香气,还有稳定泡沫、防腐和提高非生物稳定性的作用。不同品种酒花在树脂、酒花油成分上差异较大,直接影响啤酒的风味和口感[1]。因此在酒花品种的选育、种植、加工、使用过程中,品种真实性鉴定对于酒花种植者、经销商和啤酒企业而言都是至关重要的判定指标。
经过多年的发展,酒花品种鉴定主要包括形态鉴别法、化学成分分析法和DNA分子标记法。传统的酒花形态鉴别主要是基于酒花种植的农学特征、酒花球果形态来识别酒花品种,而酒花采摘后经烘干、粉碎、制粒加工,已经无法区分形态特征。化学分析法是将酒花苦味酸[2],精油成分[3-5]或其他酒花成分等[6]作为品种区分的依据,但化学成分易受种植和贮藏条件等因素的影响[7-8]。DNA分子标记不受土壤、气候和贮运等因素的影响,但已报道的随机扩增多态性(randomly amplified polymorphic DNA,RAPD)[9-10]和扩增片段长度多态性(amplified fragment length polymorphism,AFLP)[11]2种方法,具有标记显性遗传和重复性低等缺点[12-13]。微卫星(simple sequence repeats,SSR)作为第二代分子标记,具有多态性丰富、共显性遗传和扩增模式简单等特征[14],已成为大麦[15-17]、小麦[18-19]等农作物品种鉴定的主要方法,在酒花品种鉴定上也有研究报道[20-21]。PATZAK等[20]基于聚丙烯酰胺凝胶电泳,利用30对SSR引物对11个酒花品种进行鉴定;HORREO等[21]利用毛细管电泳对生长在西班牙西北部(加利西亚)的野生啤酒花进行遗传多样性分析。目前SSR分子标记主要使用聚丙烯酰胺凝胶电泳和毛细管电泳2种检测平台,由于毛细管电泳具有高效、快速、微量、自动化等优点,已成为SSR分子标记的主流检测平台。然而毛细管电泳检测时要求扩增片段标记荧光染料,尤其在引物筛选阶段,如果对上百对引物进行荧光标记则引物成本较高,影响实际应用。TP-M13-SSR(simple sequence repeat with tailed primer M13)分子标记法作为一种低成本分析技术,在正向引物5′端标记M13尾巴序列,仅对M13通用引物进行荧光标记,引物合成成本大幅降低。该技术目前已在苹果、玉米、枸杞等农作物的种质资源多样性研究方面进行了广泛的报道[22-27],但在酒花品种鉴定方面尚无相关的研究报道。
本研究基于SSR荧光标记结合毛细管电泳,从大量引物筛选中选择多态性丰富的引物用于酒花品种指纹图谱构建,目的是建立一种快速、准确的酒花品种真实性鉴定技术,为酒花在种植、加工、采购环节提供品种区分和品种产权保护方面的技术支持,从源头上保障酒花产品的质量。
1 材料与方法
1.1 材料与试剂
青岛大花、Hersbruker、Saaz、Cascade等18个酒花品种共126个样品由啤酒生物发酵工程国家重点实验室收集,品种及产地见表1。为保证品种纯度的可靠性,上述酒花品种主要收集单株酒花的球果和叶片样品。待测样品为3个酒花公司送检的5份Cascade商业酒花样品(颗粒酒花),分别标记为T1~T5,进行品种真实性鉴定。
TaqDNA聚合酶,美国Sigma-Aldrich公司;dNTPs,美国Thermo Scientific公司;GeXP遗传分析系统试剂,美国Sciex公司;植物DNA提取试剂盒,北京百泰克公司;荧光引物,北京英骏生物技术有限公司合成。

表1 酒花品种及产地Table 1 Hop varieties and origin
1.2 仪器与设备
96通道高通量核酸提取仪,北京百泰克公司;C1000 TouchTMPCR仪,美国Bio-Rad公司;GenomeLabTMGeXP遗传分析系统,美国Sciex公司;CK1000D高通量组织研磨仪,北京托摩根公司;5430型离心机,德国Eppendorf公司;Nano Drop 2000超微量分光光度计,美国Thermo Scientific公司。
1.3 实验方法
1.3.1 DNA提取
称取30 mg酒花球果样品,置于2.0 mL离心管中,加一颗5 mm钢珠,利用高通量组织研磨仪1100 r/min粉碎1 min。按照植物DNA提取试剂盒步骤进行DNA提取,利用Nano Drop 2000对DNA浓度与纯度进行检测。提取的DNA统一稀释到20 ng/μL,-20 ℃保存备用。
1.3.2 引物筛选
根据相关报道[28-31],选择103对SSR引物作为本研究的候选引物进行多态性引物筛选。正向引物的5'端与M13序列相连合成TP-M13正向引物,M13通用引物在5′端用Alexa Fluor 750荧光进行标记,引物序列TGTAAAACGACGGCCAGT,反向引物为正常引物。
1.3.3 PCR扩增
PCR反应体系:2 μL 10×PCR Buffer,3 μL 25 mmol/L MgCl2,2 μL 2 mmol/L dNTP,0.4 U Taq DNA聚合酶,1 μL 0.8 μmol/L正向引物,1 μL 3.2 μmol/L反向引物,1 μL 3.2 μmol/L M13通用引物,1 μL 20 ng/μL模板DNA,灭菌去离子水补足到20 μL。
PCR反应程序:94 ℃预变性5 min;94 ℃变性45 s,56 ℃退火30 s,72 ℃延伸1 min,共31个循环;72 ℃延伸10 min。
1.3.4 毛细管电泳检测取
0.5 μL分子质量内标加入39.5 μL甲酰胺缓冲液,混合均匀,加入样品板中。取1 μL稀释后的PCR产物加入上样板中,石蜡油覆盖防止挥发,缓冲液板中添加3/4体积分离缓冲液。毛细管电泳进样电压2.0 kV,时间30 s,90 ℃变性2 min,分离电压6.0 kV,分离时间35 min。
1.4 数据分析
PCR产物分离过程中,GeXP遗传分析系统利用GeneMapper-V3.0软件对扩增产物的荧光信号强度进行收集、储存,参照分子质量内标得到图谱中各片段的大小。通过人工分析将电泳图谱中的特征峰判读为对应的等位基因,取3次重复的平均值并四舍五入取整数,作为该品种的等位基因大小。电泳图谱中的单峰(纯合型)用X表示,双峰(杂合型)的主峰和次峰用X/Y表示,根据各品种等位基因大小进行品种DNA指纹数据分析。
2 结果与分析
2.1 引物筛选及多态性分析
利用18个酒花品种进行引物筛选,每个品种选择3个代表性样品,综合考虑等位基因数量、峰值特征情况,从103对候选引物中筛选到11对多态性丰富的SSR引物,引物序列信息见表2。

表2 引物序列信息Table 2 Information of primer sequences
11对引物在18个酒花品种上共检测到69个等位基因,每对引物的等位基因数量3~11个不等,平均每对引物扩增出6.3个等位基因。引物HlGT1多态性最丰富,含有11个等位基因;引物HlGA4多态性最低,含有3个等位基因。通常情况下引物扩增产物的等位基因越多,则该引物的品种区分能力越大。此外,引物等位基因数量与可直接区分品种的数量也有一定关系,引物HlGT1含有的11个等位基因可单独区分8个酒花品种,如Saaz、Perle、Hallertauer、Magunum、Nugget、Columbus、Northern Brewer和麒麟丰绿;而引物HLC-001D含有5个等位基因,只能区分麒麟丰绿一个品种;引物HlGA4含有3个等位基因,无法区分任何一个品种。因此仅靠一对引物难以区分全部酒花品种,只有通过引物间的相互组合才能实现可区分品种数量的最大化。引物HlGT1可单独区分8个品种,其与引物3a88组合后,二者可区分品种增加到14个,在18个品种中区分率达到82.3%,在全部两对引物的组合中HlGT1和3a88组合的鉴定效率最高。相比较而言,引物HLC-001D和HlGA4组合后只能区分5个品种,区分率仅29.4%。通过最优引物组合设计,在引物3a88和HlGT1组合的基础上增加HLC-001D和HlGA4后可实现全部18个酒花品种的区分,区分率100%。因此将引物3a88、HlGT1、HLC-001D和HlGA4作为酒花品种鉴定的核心引物,其他7对引物作为扩展引物用于辅助验证提高鉴定的准确性。
DNA指纹图谱是指某一品种的特异性DNA片段(特征峰),按照固定的引物顺序排列后构成的该品种特有的谱图。利用筛选的4对核心引物(3a88、HlGT1、HLC-001D和HlGA4)对18个品种的126个酒花样品进行指纹图谱分析,并对所有供试样品的品种真实性进行判定。图1为国产青岛大花在4对引物下的指纹图谱,图2为捷克Saaz香花的指纹图谱。引物HLC-001D的毛细管电泳图谱中青岛大花的特征峰为213 bp,Saaz香花为196/213 bp;引物3a88的电泳图谱中青岛大花的特征峰为249/259 bp,Saaz香花为247 bp;引物HlGT1的图谱中青岛大花特征峰为177/203 bp,Saaz香花为195 bp。引物HlGA4的图谱中青岛大花为281 bp,Saaz香花为279 bp。结果表明,4对引物扩增片段范围均匀分布在150~300 bp,各引物特征峰明显,非特异性峰较少,适合种指纹图谱分析。
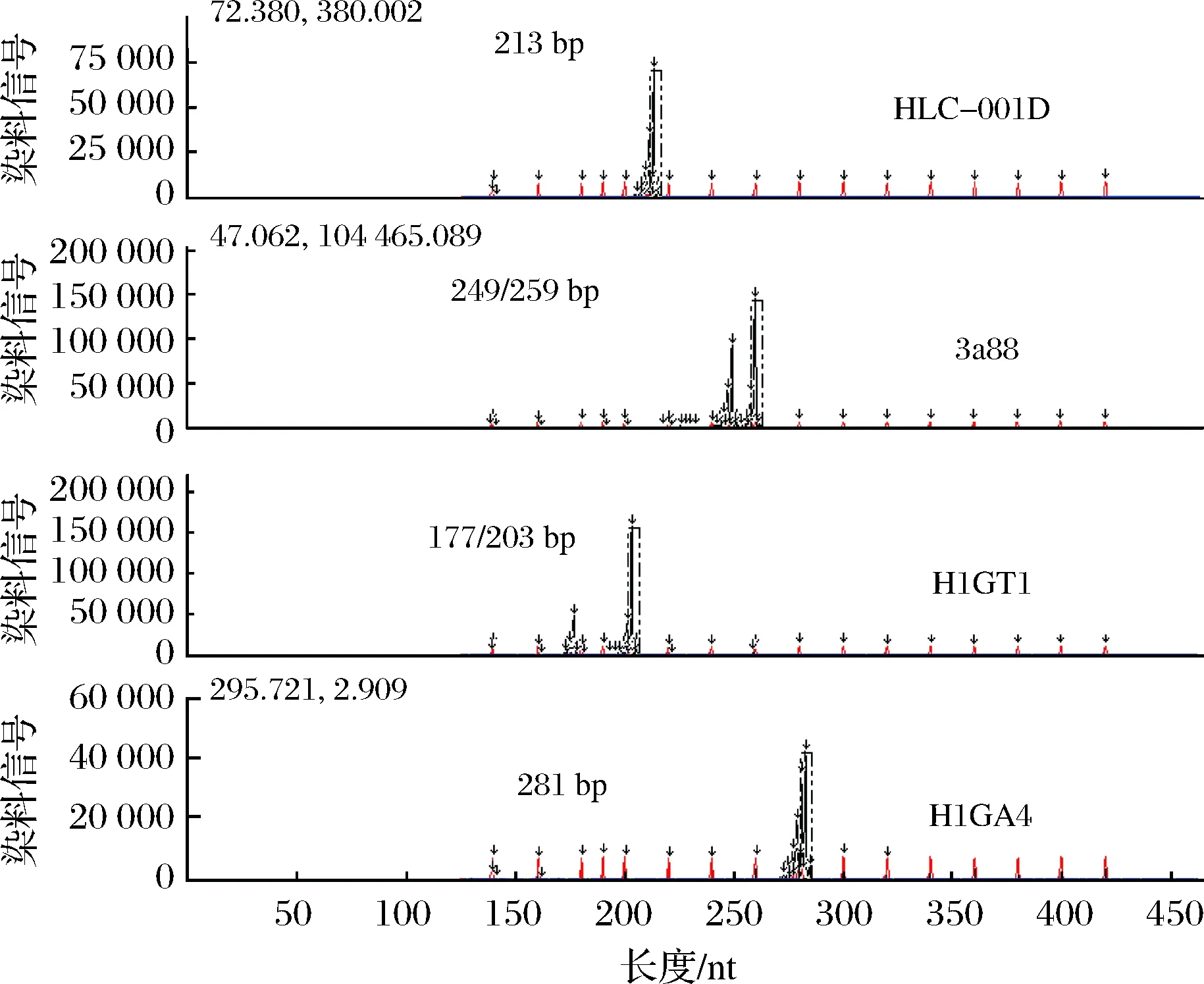
图1 青岛大花的指纹图谱Fig.1 The fingerprint of Tsingtao flower

图2 Saaz的指纹图谱Fig.2 The fingerprint of Saaz
2.2 酒花品种指纹数据库构建与验证
利用4对核心引物对18个品种的酒花样品进行分析,在已构建酒花品种指纹图谱的基础上,将单一品种的指纹数据按特定的引物顺序进行排列,汇总后得到各酒花品种的指纹数据库,见表3。
由表3可知,不同品种酒花的指纹数据差异大小不等,某些品种的指纹数据差别较大,如青岛大花的特征指纹数据为213、249/259、177/203、281 bp,麒麟丰绿为202、251、174/197、283 bp,2个品种在4对引物上差异明显,使用任何一对引物都能加以区分。而某些品种的指纹数据比较接近,只在个别等位基因上有差异,需要多引物组合后才能区分,如德国酒花Hallertauer、Hersbruker和Tradition。引物多态性分析表明,4对核心引物在18个酒花品种上共扩增出28个等位基因,每对引物的等位基因数量3~11个不等,平均等位基因数量为7.0个。其中引物HlGT1多态性最丰富,在159~203 bp包括11个等位基因;引物3a88多态性其次,在239~259 bp有9个等位基因;引物HlGA4多态性最低,在279~283 bp仅有3个等位基因。

表3 酒花品种指纹数据库 单位:bp
在对未知酒花样品进行品种鉴定时,通过DNA提取、PCR扩增和毛细管电泳分离、图谱分析后得到样品指纹数据,将其与目标酒花品种的标准指纹数据比对即可确定所属品种,实现品种真实性鉴定。以3个商业酒花公司提供的5份Cascade样品鉴定为例,常规指标分析表明5份样品的甲酸和酒花油含量差异较大,因此厂家对品种的真实性存疑。鉴定结果表明,样品T1~T5在核心引物(HLC-001D、3a88、HlGT1、 HlGA4)下的指纹数据与对照Cascade酒花的标准指纹数据完全一致,说明5份样品均为Cascade,样品来源真实可靠。研究过程中发现,建库收集的个别酒花样品的指纹数据与所标识的品种名称并不一致,可能是由于样品在种植、取样、运输过程中出现信息错误导致的。
基于最少引物鉴定最多品种的指纹图谱构建原则[10],在品种数量一定的情况下,需对大量引物进行片段分析和多态性验证,筛选的引物数量越少则鉴定效率越高,因此核心引物筛选是整个品种鉴定的关键。首先,引物筛选的基本原则在于选择等位基因数量多的引物。其次,对不同引物的区分能力进行排列组合,优选数量最少、扩增稳定的引物为核心引物。最后,将多引物整合在多重PCR反应体系中,扩增片段通过标记不同颜色荧光和片段大小进行区分,从而缩短检测时间、降低成本。该数据库具有扩展性,今后的研究需要丰富国内及全球的酒花品种,新品种的纳入可不断扩大数据库的鉴定能力,通过构建多重PCR反应体系,进一步提高检测效率。
3 结论
本研究基于TP-M13-SSR荧光标记结合毛细管电泳技术,从103对候选引物中筛选得到11对多态性丰富、重复性好的引物,通过引物组合设计,确定了4对核心引物构建的18个国内外主要酒花品种指纹数据库,共检测到28个等位基因,各引物等位基因数量3~11个不等,每对引物平均产生7.0个等位基因。酒花品种指纹数据的构建及其品种真实性鉴定,在酒花品种选育、田间种植、新品种产权保护等方面具有重要的应用价值,为酒花种植者、生产者、啤酒企业提高品种选育、田间管理和品质评价能力提供了技术支持。

