乙烯利和1-MCP对菠萝蜜果实中AheAAT和AheERF表达的影响
任雪岩,刘光财,李国鹏,叶春海,丰锋,王俊宁
乙烯利和1-MCP对菠萝蜜果实中和表达的影响
任雪岩,刘光财,李国鹏,叶春海,丰锋,王俊宁
(广东海洋大学农学院,广东湛江 524088)
【】研究乙烯(ETH)和1-甲基环丙烯(1-MCP)处理对菠萝蜜果实成熟过程中醇酰基转移酶(AAT)活性、Ahe和AheERF1/2转录因子表达的影响,为进一步认识菠萝蜜果实AATs在酯类物质合成中的作用及其调控提供理论依据。以‘海大2号’菠萝蜜果实为试材,果实盛花期选择具有代表性、花期一致的果实挂牌,花后约150 d采收,选择大小和成熟度相同,且无病虫伤的果实,分成3组进行处理。第一组采用1 000 mg∙L-1ETH溶液浸泡2—3 min;第二组采用0.5 mg∙L-11-MCP熏蒸处理15 h;第三组作为对照组。在果实成熟过程中定期取样,每次取样3—5个果,测定AAT酶活性、和表达等指标。通过测定AAT酶活性发现,ETH处理促进了果实的成熟衰老,提前了AAT活性高峰出现的时间,但是降低了酶活性。1-MCP处理抑制了果实成熟衰老,在贮藏前期抑制了AAT的活性,延迟了AAT活性高峰出现的时间,并显著降低了AAT的活性。对序列分析发现,其全长1 380 bp,编码459个氨基酸。AheAAT具有酰基转移酶的保守结构域H-x-x-x-D和L-x-x-YYPLAGR活性位点基序,D(N) F(V) GWG附加基序,属于BAHD醇酰基转移酶家族,其氨基酸序列与苹果和梨的相似性最高。同时,从菠萝蜜果实中克隆获得2个转录因子,分别命名为1/2,其中全长648 bp,编码215个氨基酸,与苹果和菜豆的同源性最高;全长657 bp,编码218个氨基酸,与苹果、番木瓜的同源性最高。的氨基酸序列含有64/65个氨基酸残基组成的AP2/ERF保守序列,具有ERF家族转录因子的特征序列。ETH处理使果实中表达高峰提前出现,并且下调了的表达。ETH处理对转录因子的影响与相同,并且ETH降低了转录因子与的相关性。1-MCP处理延长了菠萝蜜果实的贮藏期。在1-MCP处理后的贮藏前期,和转录因子的表达呈现显著降低。当和转录因子出现表达高峰时,1-MCP下调了它们的表达。然而,1-MCP对转录因子与的相关性几乎无影响。ETH处理提前了AAT的活性高峰及和转录因子的表达高峰,降低了AAT的活性,下调了和转录因子的表达,降低了与转录因子的相关性。1-MCP处理在贮藏前期抑制了AAT的活性及和转录因子的表达,在贮藏后期降低了AAT的活性,下调了和转录因子的表达量。
菠萝蜜;乙烯利;1-MCP;
0 引言
【研究意义】菠萝蜜(Lam.)染色体2n=56,是桑科木菠萝属乔木,为热带著名水果,果肉柔软,清甜可口,香气浓郁,有“热带水果皇后”之称。菠萝蜜为典型的呼吸跃变型水果,成熟与乙烯代谢密切相关[1],外源乙烯利(ETH)可加快其成熟和衰老,1-甲基环丙烯(1-Methylcyclopropene,1-MCP)作为一种稳定的乙烯受体抑制剂,可有效抑制菠萝蜜果实的成熟和衰老[2],能够较长时间保持菠萝蜜果实品质的优良。香气是衡量果实品质的重要指标之一。菠萝蜜的主要香气成分以酯类物质为主,酯类占到香气总量的一半以上,因此酯类物质构成了菠萝蜜的风味骨架[3]。醇酰基转移酶(AAT)是酯合成末端的关键酶,催化醇亚基和酰基-CoA合成不同的酯类香气物质[4]。转录因子是乙烯信号转导通路最下游的关键因子,对乙烯信号转导通路有重要的影响[5]。通过识别乙烯反应元件中的GCC-box,来实现或阻遏乙烯的反应。因此,开展相关研究,可以为进一步认识菠萝蜜果实AATs在酯类物质合成中的作用及其调控提供理论依据,为菠萝蜜品种选育,调控菠萝蜜果实中酯类物质含量,延长菠萝蜜果实采后贮藏时间及提高菠萝蜜果实的风味品质提供参考。【前人研究进展】前人研究发现甜瓜、苹果和香蕉中AAT的活性与酯类物质含量表现出正相关[6]。已得到AAT酶基因序列的物种有草莓、甜瓜、木瓜和桃等。NORDSTRÖM[7]和其他研究指出,酵母中的酯是在酯合成酶或酰基转移酶的作用下,由酰基辅酶A的参与和能量供应来合成的。通过对该酶的初步研究,发现其定位于细胞膜[8]。仙女扇花中的和是从植物中得到的第一个,它们属于醇酰基转移酶的BAHD家族,该家族具有H-x-x-x-D和L-x-x-x-Y-x-x-x-AG活性位点基序,还有FGWG的附加基序[9]。甜瓜果实中含有4个家族成员,除无活性外,其他3个基因都能够合成酯类物质,通过定点突变试验发现,CmAAT2蛋白中268位的苏氨酸被丙氨酸取代[10]。冯燕青[11]从自交系甜瓜中克隆得到,发现该基因的表达量在花后15 d的果实中最低,等果实完全成熟后其表达量达最高值。草莓果实中的转录水平随着果实的发育成熟而增强,果实香气中的酯类物质升高,醛类物质下降[12]。CUMPLIDO-LASO等[13]发现草莓中的可以催化C1—C8的芳族醇、直链醇和酰基-CoA反应产生酯类物质。通过下调草莓果实中的表达,果实中酯类物质含量明显减少,表明是酯类物质合成的关键基因。ERF(Ethylene-responsive transcription factors)类转录因子在植物的生育过程和抗逆过程中具有关键的效果,其家族蛋白都含有60—70个氨基酸组成的AP2保守结构域[14]。研究发现苹果中的参与了果实的成熟与衰老,其中和在成熟过程中和后熟过程中分别表达上调,并且可被1-MCP抑制表达[15]。YIN等[16]研究发现猕猴桃果实中的13个转录因子在水果发育的早期表达,其中有5个基因为下调表达,4个基因上调表达,并且上调表达可被1-MCP抑制,还有4个基因表达无明显变化趋势。龙眼果实中的两个在贮藏期间表现上调,并且通过乙酰化酶D1HD2互作来调控龙眼果实衰老的相关基因[17]。因此可知,在果实的生长发育进程中具有关键作用。【本研究切入点】在菠萝蜜果实的贮藏加工中,如何保持其优良的风味和品质是菠萝蜜贮藏加工的重要任务。对跃变型水果来说,为了调控其市场供应,常用乙烯利和1-MCP处理来分别对果实进行催熟和抑制成熟。菠萝蜜是典型的跃变型果实,外源ETH和1-MCP处理也可以分别促进其成熟和抑制其成熟,但有关ETH和1-MCP处理对菠萝蜜中香气形成过程中酶和基因表达影响的研究还未见报道。【拟解决的关键问题】通过分析对照(CK)、外源ETH和1-MCP处理菠萝蜜果实成熟过程中AAT活性、及1/2转录因子表达的变化情况,探讨ETH、1-MCP对菠萝蜜AAT活性和表达的调控作用,分析1/2转录因子与的相关性。
1 材料与方法
1.1 材料
供试材料为香气浓郁的干苞型菠萝蜜品种‘海大2号’果实。在果实盛花期选择具有代表性、花期一致的果实挂牌,花后约150 d采收。采收后立即将果实运回实验室,选择大小和成熟度相同,且无病虫伤的果实,分3组进行处理。第一组果实采用1 000 mg∙L-1ETH溶液浸泡2—3 min,然后取出晾干;第二组果实采用0.5 mg∙L-11-MCP熏蒸处理15 h;第三组作为对照(CK)。三组材料在22℃、90%的相对湿度条件下,让其自然成熟。在果实成熟过程中定期选取果实取样,每次取样3—5个果,取样时将果肉从菠萝蜜果实中分离出来,切成5 mm×5 mm的碎片,混匀装入铝箔袋密封,液氮速冻后,存于-80℃超低温冰箱中。
1.2 试剂
北京华越洋RNA提取试剂盒,TaKaRa cDNA合成试剂盒,pMDR20 T-Vector*1载体,DH5α感受态细胞,DNA快速回收纯化试剂盒(北京鼎国昌盛生物技术有限责任公司)。
Bio-Rad CFX Connect实时定量PCR仪。QPCR试剂盒SYBR(TransStartTop Green qPCR SuperMix)和质粒抽提试剂盒(北京鼎国昌盛生物技术有限责任公司)等。酰基转移酶活性测定试剂盒(苏州科铭生物技术有限公司)。
1.3 RNA的提取和cDNA第一链的合成
使用华越洋Plant RNA Kit超快型植物RNA提取试剂盒提取菠萝蜜总RNA。以菠萝蜜果实RNA为模板,采用cDNA合成试剂盒反转录合成第一链cDNA。
1.4 PCR引物设计及合成
用Primer Premier 5.0软件设计和的全长引物,委托上海生物工程有限公司合成(表1)。
经过PCR扩增,目的片段回收,连接转化,阳性克隆检测测序,得到和的全长序列。
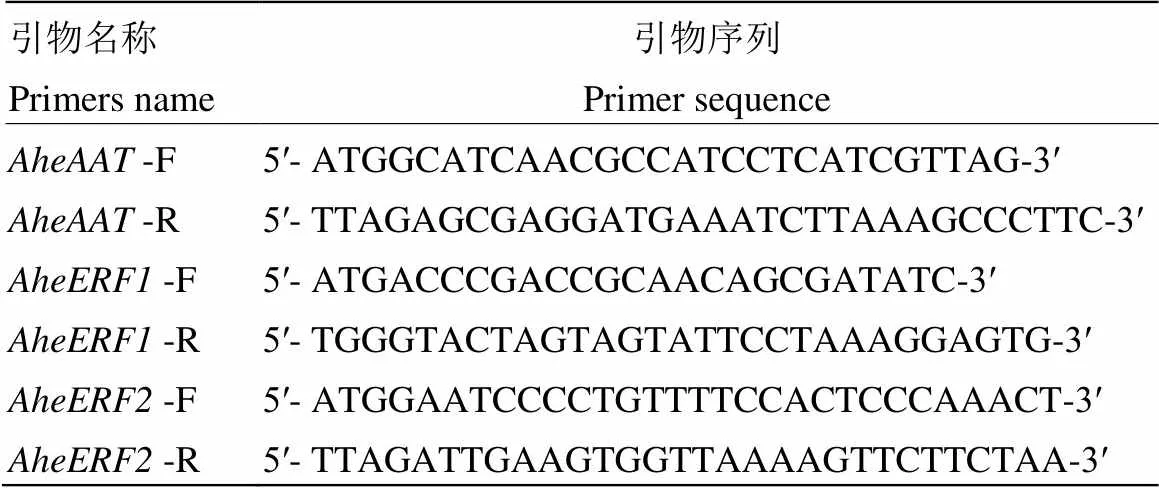
表1 基因全长引物序列
1.5 qPCR引物设计及qPCR程序
根据全长和转录组库中的1/2全长设计荧光定量引物(表2)。
qPCR扩增程序采用三步法,程序如下:94℃ 1 min;94℃ 5 s,55℃ 30 s,72℃ 30 s,39个循环。

表2 定量PCR引物序列
2 结果
2.1 菠萝蜜AheAAT、AheERF1和AheERF2的克隆
从菠萝蜜果实转录组库中,分别挑选到1个AAT和2个ERF转录因子的序列,通过设计3′RACE、5′RACE和全长引物,经过一系列的扩增、测序过程,最终获得这3个基因的全长cDNA序列,分别命名为、和。如图1所示,、和全长分别为1 380、648和657 bp。
2.2 AheAAT编码蛋白特征序列和理化性质分析
基因的编码区长1 380 bp,编码459个氨基酸,利用ProtParam软件对基因所编码的蛋白进行理化性质分析,结果表明,其分子式为C2276H3587N615O660S27,分子量为50.99 kD。所编码的蛋白的氨基酸组成中,亮氨酸(Leu)的含量最高,占总氨基酸的9.6%;脯氨酸(Pro)和缬氨酸(Val)的含量次之,都为7.2%。AheAAT蛋白的等电点为8.33,脂肪系数为84.53。平均亲水性为-0.147,属于疏水性蛋白;不稳定性系数为39.11,为稳定性蛋白。
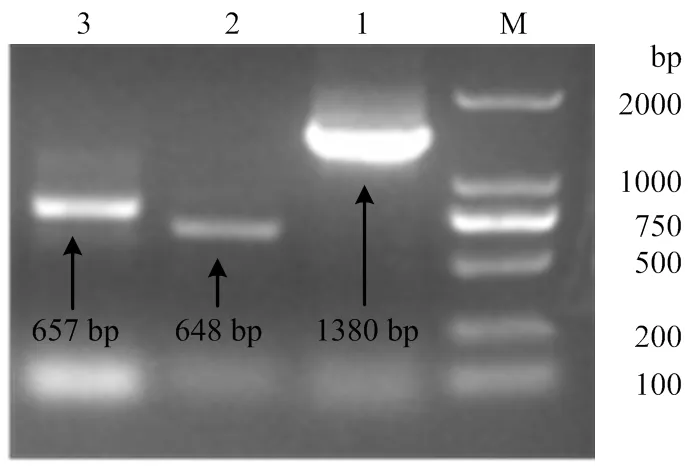
M:DNA Marker DL 2 000 bp
通过NCBI进行序列比对分析,将推导的氨基酸序列与GenBank中登录的苹果、梨、枇杷、葡萄、草莓、茶、柿的酰基转移酶氨基酸序列进行比对(图2)。发现的氨基酸序列与苹果和梨的相似性最高,分别为66.83%和66.17%。由图2可知具有酰基转移酶的保守结构域H-x-x-x-D(173—177氨基酸残基)和L-x-x-YYPLAGR(82—91氨基酸残基)活性位点基序,D(N) F(V) GWG(396—400氨基酸残基)附加基序,所以,属于BAHD醇酰基转移酶家族。
采用以上蛋白比对结果,使用MEGA7软件构建系统发育树(图3)。由图3可知,这些物种的蛋白共形成4个分支,苹果(AY517491.1、AY512893.1、KC291133.1、KC291132.1)、梨(AY534530.1、KJ775788.1)、柿(KP271995.1)、枇杷(KF704125.2)等水果聚为一支,葡萄(KX963771.1、AY705388.1)和茶(GQ438850.1)聚为一支,草莓(JN089766.1)和菠萝蜜(AheAAT)各为一支。
2.3 AheERF1转录因子分析
利用ProtParam软件对菠萝蜜中转录因子序列进行分析,显示转录因子全长648 bp,编码215个氨基酸,其蛋白理论分子质量为24.05 kD,等电点pI=8.81,平均亲水系数为-0.717,不稳定指数为45.91,脂肪系数为60.84。组成该蛋白的氨基酸中苏氨酸含量最高为13.5%,其次为丝氨酸8.8%。

图2 AheAAT与其他物种AAT蛋白序列比对(保守结构域用红色方框标出)

图3 AheAAT系统发育树
将推导的氨基酸序列与苹果、葡萄、草莓、柿、猕猴桃和拟南芥等ERF的氨基酸序列进行比对,如图4。推测出的氨基酸序列含有64个氨基酸残基组成的AP2/ERF保守序列(图4中蓝色方框),该保守序列是植物中ERF家族转录因子的特征序列。由图可知ERF转录因子的氨基酸全长序列同源性较低,其保守性只来自保守区,其他区域具有较大的差异,构成了转录因子的特征。
采用以上蛋白比对结果构建系统发育树,如图5。由图5可知,菠萝蜜中AheERF1与苹果(GU732445.1)、和菜豆(XM-007136909.1)的同源性最高,其次是葡萄(KX179904.1)、草莓(MH332939.1)和樱桃(KT369551.1),这6个物种的ERF聚为一支。海岛棉(KC969205.1)和拟南芥(AY059664.1)聚为一支,柿子(KJ170916.1)和猕猴桃(MH105005.1)聚为一支。菜豆(XM-007135737.1)和油桐(KX868905.1)聚为一支。
2.4 AheERF2转录因子分析
利用ProtParam软件对菠萝蜜中转录因子序列进行分析,显示转录因子全长657 bp,编码218个氨基酸,其蛋白理论分子质量为24.53 kD,等电点pI=5.10,平均亲水系数为-0.542,不稳定指数为62.45,脂肪系数为70.18。组成该蛋白的氨基酸中丝氨酸含量最高为13.8%,其次为谷氨酸12.4%。
将AheERF2推导的氨基酸序列与苹果、葡萄、草莓、柿、猕猴桃和拟南芥等ERF的氨基酸序列进行比对,如图6。推测出AheERF2的氨基酸序列含有65个氨基酸残基组成的AP2/ERF保守序列(图6中蓝色方框),该保守序列是植物中ERF家族转录因子的特征序列。由图可知ERF转录因子的氨基酸全长序列同源性较低,其保守性只来自保守区,其他区域具有较大的差异,构成了转录因子的特征。
采用以上蛋白比对结果构建系统发育树,如图7。由图7可知菠萝蜜中AheERF2与苹果(GU732453.2)、番木瓜(KM453704.1)、丹参(MH006599.1)、柿(MH054905.1,KJ170919.1)、草莓(MH332989.1)同源性最高,其次是猕猴桃(KC907726.1,GQ869861.1)、菜豆(XM 007144028.1)、百脉根(AB378626.1)、白桦(KM980452.1),这9个物种聚为一支。葡萄(KF207890.1)、拟南芥(AY133629.1)和菜豆(XM 007134417.1)各单独聚为一支。木油桐(KX868845.1)和毛果杨(XM 002315671.1)聚为一支。
2.5 不同处理对菠萝蜜果实中AAT酶活性的影响
不同处理下菠萝蜜果实中AAT活性的变化如图8所示。由图可知,3种处理下菠萝蜜后熟过程中AAT活性的变化随着贮藏天数的增加表现为先增加后降低。菠萝蜜果实在正常后熟过程中,其体内的AAT活性在第8天达到最大值。ETH处理提前了AAT的活性高峰,并稍微降低了酶活,降低8.85%。1-MCP处理在贮藏前期抑制了AAT的活性,推迟了AAT活性出现的高峰,在采后第16天才出现高峰,并且1-MCP降低了AAT的活性,降低33.18%。

图4 AheERF1与其他物种ERF蛋白序列比对(红色方框为保守结构域,蓝色方框为保守元件)

图5 AheERF1系统发育树

图6 AheERF2与其他物种ERF蛋白序列比对(红色方框为保守结构域,蓝色方框为保守元件)

图7 AheERF2系统发育树

图8 不同处理对果实AAT酶活性的影响
2.6 不同处理对AheAAT表达的影响
在贮藏不同时期的表达量如图9。由图可知,不同处理下的表达量在菠萝蜜果实贮藏过程中存在差异。ETH处理后,的表达相比CK提前了4 d,并且ETH下调了的表达。1-MCP在菠萝蜜贮藏的前期抑制了的表达,在贮藏第16天,的表达达到最大值,并且1-MCP处理也下调了的表达,下调了53.71%。

图9 不同处理对果实AheAAT表达的影响
2.7 不同处理对AheERF1和AheERF2表达的影响
不同处理AheERF1/2的表达如图10。在正常后熟过程中,ERF1的表达量从4 d时开始增加,第8天时,ERF1的表达量达到最大值,之后开始下降;的表达从第2天开始逐渐增加,到贮藏第8天时该基因的表达量达到最大值,之后开始下降。ETH处理将和表达高峰的时间提前,并且ETH降低和的表达量。1-MCP处理在贮藏前期抑制了和的表达,在贮藏第12天表达量开始增加,在第16天达到最大值,之后一直下降,在贮藏14 d时表达量开始增加,在贮藏第16天时达到最大值,然后持续下降。菠萝蜜果实中的表达丰度高于。

图10 不同处理对果实AheERF1/2表达的影响
2.8 AheAAT与AheERF1和AheERF2转录因子的相关性分析
由表3可知,对照中与、转录因子的相关系数分别为0.993、0.956,呈极显著相关性(<0.01)。说明和转录因子在菠萝蜜果实中的表达对的表达有直接影响作用。
ETH处理后,菠萝蜜果实中与、转录因子的相关系数分别为0.965、0.915,与转录因子极显著相关,与转录因子显著相关。ETH处理降低了转录因子与的相关性,对转录因子的影响较小。
1-MCP处理中,与、转录因子的相关系数分别为0.968、0.817,均为极显著相关(<0.01)。1-MCP处理对和转录因子的影响较小。
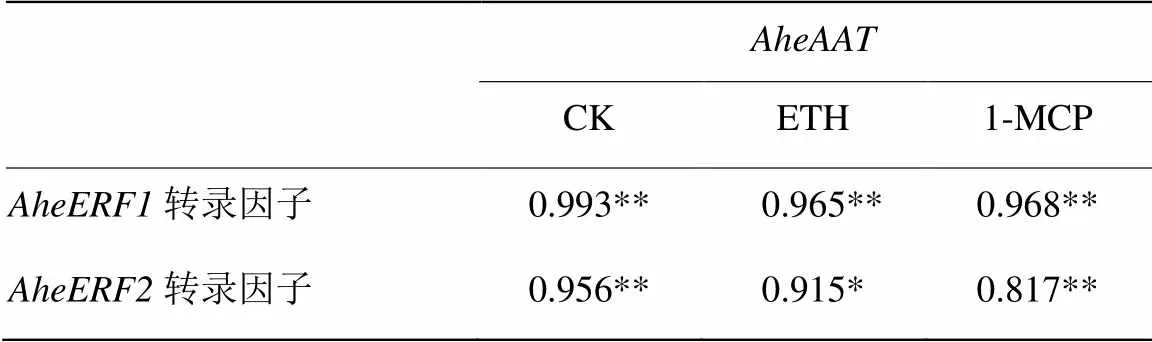
表3 AheAAT与AheERF1、AheERF2的相关性分析
**在0.01水平(双侧)上显著相关;*在0.05水平(双侧)上显著相关
** Significant correlation at 0.01 level (both sides); * Significant correlation at 0.05 level (both sides)
3 讨论
AAT酶是果实中酯类合成最末端的关键酶,具有极其重要的作用。张丽萍等[18]发现使用2 mmol∙L-1外源乙烯处理1-MCP处理后的南国梨果实,提高了AAT酶的活性。隋静[19]采用不同浓度的ETH处理草莓果实,发现AAT酶活性随乙烯浓度增加同步提高。本研究发现ETH处理提前了AAT活性高峰出现的时间,但是降低了酶活性,与张丽萍[18]和隋静[19]等的研究结果不同,可能是因为果实的品种和对果实的处理不同,导致结果的相反。DEFILIPPI等[20]在苹果中发现,1-MCP处理降低了AAT酶的转录水平,降低了酶活性,但不影响乙醇脱氢酶的活性。在甜瓜采收前3 d施用1-MCP处理,发现AAT活性明显被抑制[21]。本研究发现1-MCP处理在贮藏前期抑制了AAT的活性,延迟了AAT活性高峰出现的时间,并显著降低了AAT酶的活性。该结果与前人研究结果相似。
草莓果实中的,全长1 618 bp,编码452个氨基酸,分子量约50.7 kD[22]。从Charentais甜瓜中克隆出两个,和均编码461个氨基酸,分子量分别为51.5 kD和51.8 kD,等电点分别为8和8.5。HEALIT等[23]在玫瑰花的EST序列中发现3个与已知其他来源的BAHD家族基因相似,其中一个编码458个氨基酸的序列,命名为,其分子量为51.8 kD,等电点为5.45,该序列与草莓果实中的SAAT蛋白有69%的同源性,其属于BAHD酰基转移酶家族。LI等[24]在‘乔纳金’和‘金冠’苹果果实中分别克隆到和,两个基因的全长分别为1 639 bp和1 628 bp,二者的同源性为94.26%。分析序列后发现,含有保守区H-x-x-x-D和FGWG。通过聚类分析发现,蛋白与梨果实中的AAT蛋白亲缘关系最近,与草莓、柠檬等的亲缘关系较远。本研究得到的菠萝蜜中的AAT氨基酸序列与苹果中的AAT氨基酸序列具有较高的相似性,存在H-x-x-x-D、L-x-x-x-Y-x-x-x-AG和FGWG保守结构域。系统进化树分析发现菠萝蜜单独聚为一类,与其他物种的进化关系较远。
乙烯应答因子结合蛋白是广泛存在于植物中的一类转录调控蛋白,属于AP2/ERF转录因子超家族。该家族成员均含有约60个氨基酸的保守AP2/EREBP结合域。根据结构域的数量和相似性,可将AP2/ERF家族分为AP2、ERF和RAV三个亚家族[25-26]。
从菠萝蜜果肉中克隆得到的两个转录因子,其蛋白都具有ERF家族的典型结构特性。AheERF1和AheERF2均含有1个高度保守的AP2/ERF结构域。AheERF1蛋白的AP2/ERF结构域由64个氨基酸残基组成,存在于该蛋白的前部。AheERF2蛋白的AP2/ERF结构域由65个氨基酸残基组成,存在于该蛋白的中部。在AP2/ERF结构域含有YRG或RAYD保守的元件[27],其中20个左右的氨基酸残基构成了YRG元件,并且大部分氨基酸为碱性氨基酸,有利于DNA与其结合。大约40个氨基酸残基构成了RAYD保守元件,其影响YRG元件的构象,还可以和其他蛋白进行互作,调节DNA序列和AP2结构域的结合。AheERF1蛋白中含有YRG和RAYD保守元件,位于8—10位和45—48位,AheERF2蛋白含有YRG保守元件,位于92—94位。
的表达水平在果实成熟过程中受乙烯的调控[28]。YAHYAOUI等[21]在甜瓜果实中发现1-MCP对和的转录和表达有明显的抑制作用,也抑制了乙烯的产生。在苹果中,1-MCP抑制了的表达和乙烯、酯类物质的合成,1-MCP+ ETH处理可以诱导表达,并部分恢复乙烯和酯类物质的合成[29]。木瓜果实中的参与了香气物质的形成,该基因受到乙烯的调控[30]。本研究发现ETH提前了表达高峰出现的时间,并且下调了的表达。1-MCP处理在贮藏前期抑制了的表达,延迟了表达高峰出现的时间,下调了的表达。与前人研究结果类似。
常博文等[31]在长春花中发现,ETH处理促进了转录因子的转录,加强了细胞内的乙烯信号。LEI等[32]从‘蜻蜓’凤梨中得到3个家族基因,发现这3个基因受到外源乙烯的调控,且表达量受到正调控。张红娜等[33]在对‘巴厘’和‘台农16’菠萝品种的研究中发现,‘巴厘’品种中受到外源ETH的正调控,并在处理后1 d出现表达高峰;‘台农16’品种呈现缓慢下降的趋势。本研究发现ETH处理提前了菠萝蜜果实中表达高峰出现的时间,下调了的表达。菠萝蜜中与长春花、‘蜻蜓’凤梨和‘巴厘’菠萝中的研究结果相反,但是与‘台农16’菠萝的研究结果相似。
1-MCP处理对转录因子的影响研究较少。1-MCP处理在菠萝蜜后熟过程的前期抑制了转录因子的表达,在后熟过程的后期果实中产生新的乙烯受体,的表达恢复正常,但是受到1-MCP的影响,其后期的表达量下降,并且和的表达丰度不同。
通过相关性分析发现,的表达与、转录因子极显著相关,暗示和转录因子对的表达有调控作用,具体机理有待进一步研究。
4 结论
ETH处理提前了AAT的活性高峰,降低了AAT的活性。1-MCP处理在贮藏前期抑制了AAT的活性,在贮藏后期降低了AAT的活性。全长1 380 bp,编码459个氨基酸,氨基酸序列中存在H-x-x-x-D、L-x-x-x-Y-x-x-x-AG和FGWG保守结构域,属于醇酰基转移酶的BAHD家族。氨基酸序列同源比对发现,与苹果果实中的AAT氨基酸序列有较高的相似性,与其他物种的进化关系较远。ETH处理使果实中表达高峰提前出现,并且下调了的表达。ETH处理对转录因子的影响与相同,并且ETH降低了转录因子与的相关性。1-MCP处理延长了菠萝蜜果实的贮藏期,在贮藏前期,和转录因子的表达呈现显著降低;当和转录因子出现表达高峰时,1-MCP下调了其表达。
[1] 王俊宁, 马静, 丰锋, 杨转英, 叶春海. 乙烯对采后菠萝蜜果实碳水化合物代谢及其酶活性的影响. 江西农业大学学报, 2017, 39(1): 43-49.
WANG J N, MA J, FENG F, YANG Z Y, YE C H. Effects of ethylene on carbohydrate metabolism and enzyme activities in postharvest ripening jackfruit., 2017, 39(1): 43-49. (in Chinese)
[2] 谢忠斌, 叶春海, 任雪岩, 丰峰, 王俊宁. 1-MCP和乙烯利处理对采后菠萝蜜果实活性氧代谢的影响. 热带作物学报, 2018, 39(1): 77-83.
XIE Z B, YE C H, REN X Y, FENG F, WANG J N. Effects of 1-MCP and ethephon treatment on reactive oxygen metabolism of postharvest jackfruit., 2018, 39(1): 77-83. (in Chinese)
[3] 王俊宁, 任雪岩, 余树明, 何启朋, 丰锋, 刘光财, 叶春海. 9个菠萝蜜品系香气成分及特征香气分析. 果树学报, 2018, 35(5): 574-585.
WANG J N, REN X Y, YU S M, HE Q P, FENG F, LIU G C, YE C H. Analysis of aroma compounds in 9 jackfruit varieties., 2018, 35(5): 574-585. (in Chinese)
[4] 隋静, 姜远茂, 彭福田, 国颖, 刘丙花, 赵凤霞, 王海云. 草莓果实发育过程中芳香物质含量和醇酰基转移酶活性的变化. 园艺学报, 2007, 34(6): 1411-1417.
SUI J, JIANG Y M, PENG F T, GUO Y, LIU B H, ZHAO F X, WANG H Y. Development of aroma components and alcohol acyltransferase activity in strawberry fruit during ripening., 2007, 34(6): 1411-1417. (in Chinese)
[5] Yang Y X, Ahammed G, Wu C J, Fan S Y, Zhou Y H. Crosstalk among jasmonate, salicylate and ethylene signaling pathways in plant disease and immune responses.2015, 16(5): 450-461.
[6] 曹颖, 胡尚连, 张慧莹, 唐晓凤, 刘永胜. 番茄醇酰基转移酶基因. 植物研究, 2012, 32(6): 731-736.
CAO Y, HU S L, ZHANG H Y, TANG X F, LIU Y S.Cloning, sequence analysis and prokaryotic expression of an alcohol acyltransferase (AAT) gene in tomato ()., 2012, 32(6): 731-736. (in Chinese)
[7] Nordström K. Formation of ethyl acetate in fermentation with brewer’s yeast. III. participation of coenzyme A., 1962, 68(5): 398-407.
[8] Yoshioka K, Hashimoto N. Ester formation by alcohol acetyltransferase from brewers’ yeast., 1981, 45(10): 2183-2190.
[9] Stpierre B, Luca V D. Chapter nine evolution of acyltransferase genes: origin and diversification of the BAHD superfamily of acyltransferases involved in secondary metabolism., 2000, 34: 285-315.
[10] EL-SHARKAWY I, MANRÍQUEZ D, FLORES F B, REGAD F, BOUZAYEN M, LATCHÉ A, PECH J C. Functional characterization of a melon alcohol acyl-transferase gene family involved in the biosynthesis of ester volatiles. Identification of the crucial role of a threonine residue for enzyme activity., 2005, 59(2): 345-362.
[11] 冯燕青. 甜瓜果实醇酰基转移酶基因的克隆和表达及其对番茄的遗传转化[D]. 泰安: 山东农业大学, 2009.
FENG Y Q.Cloning and characterization of alcohol acyltransferase encoding genes from muskmelon and transformating antisense vector to tomato [D]. Tai’an:, 2009. (in Chinese)
[12] GONZÁLEZ M, GAETEEASTMAN C, VALDENEGRO M, FIGUEROA C R, FUENTES L, HERRERA R, MOYA-LEÓN M A. Aroma development during ripening of fragaria chiloensis fruit and participation of an alcohol acyltransferase () gene., 2009, 57(19): 9123-9132.
[13] CUMPLIDO-LASO G, MEDINA-PUCHE L, MOYANO E, HOFFMANN T, SINZ Q, RING L, STUDART-WITTKOWSKI C, CABALLERO JL, SCHWAB W, MUÑOZ-BLANCO J, BLANCO- PORTALES R. The fruit ripening-related geneencodes an acyl transferase involved in strawberry aroma biogenesis., 2012, 63(11): 4275-4290.
[14] OKAMURO J K, CASTER B, VILLARROEL R, MONTAGU M, JOFUKU K D. The AP2 domain of APETALA2 defines a large new family of DNA binding proteins in., 1997, 94(13): 7076-7081.
[15] WANG A D, TAN D M, TAKAHASHI A, LI T Z, HARADA T., two ethylene-response factors involved in apple fruit ripening., 2007, 58(13): 3743-3748.
[16] YIN X R, ALLAN A C, CHEN K S, FERGUSON I B. Kiwifruitandgenes involved in regulating fruit ripening., 2010, 153(3): 1280-1292.
[17] KUANG J F, CHEN J Y, LUO M, WU K Q, SUN W, JIANG Y M, LU W J. Histone deacetylase HD2 interacts withand is involved in longan fruit senescence., 2012, 63(1): 441-454.
[18] 张丽萍, 纪淑娟. 乙烯利对1-MCP处理南果梨冷藏后香气及香气合成过程中关键酶活的影响. 食品科学, 2013, 34(10): 294-298.
ZHANG L P, JI S J.Effect of Different concentrations of ethephon on aroma and key enzymes related to aroma formation in 1-MCP-treated nanguo pear after refrigerated storage., 2013, 34(10): 294-298. (in Chinese)
[19] 隋静. 草莓果实发育过程和采后处理对其芳香物质和醇酰基转移酶活性影响研究[D]. 泰安: 山东农业大学, 2007.
SUI J.Effects of fruit development period and post-harvest treatment on aromatic substances and AAT activity in strawberry [D]. Tai’an: Shandong Agricultural University, 2007. (in Chinese)
[20] DEFILIPPI B G, DANDEKAR A M, KADER A A. Impact of suppression of ethylene action or biosynthesis on flavor metabolites in apple (Borkh) fruits., 2004, 52(18): 5694-5701.
[21] YAHYAOUI F E, WONGS-AREE C, LATCHÉ A, HACKETT R, GRIERSON D, PECH J C. Molecular and biochemical characteristics of a gene encoding an alcohol acyl-transferase involved in the generation of aroma volatile esters during melon ripening., 2002, 269(9): 2359-2366.
[22] AHARONI A, KEIZER L C, BOUWMEESTER H J, SUN Z, ALVAREZ- HUERTA M, VERHOEVEN H A, BLAAS J, HOUWELINGEN A M, DE VOS R C, VAN DER VOET H, JANSEN R C, GUIS M, MOL J, DAVIS R W, SCHENA M, TUNEN A J, O'CONNELL A P. Identification of thegene involved in strawberry flavor biogenesis by use of DNA microarrays., 2000, 12(5): 647-662.
[23] SHALIT M, GUTERMAN I, VOLPIN H, BAR E, TAMARI T, MENDA N, ADAM Z, ZAMIR D, VAINSTEIN A, WEISS D, PICHERSKY E, LEWINSOHN E. Volatile ester formation in roses. Identification of an acetyl- coenzyme A. Geraniol/Citronellol acetyltransferase in developing rose petals., 2003, 131(4): 1868-1876.
[24] LI D P, XU Y F, XU G M, GU L K, LI D Q, SHU H R. Molecular cloning and expression of a gene encoding alcohol acyltransferase () from apple (cv. Golden Delicious)., 2006, 67(7): 658-667.
[25] HU L F, LIU S Q. Genome-wide identification and phylogenetic analysis of thegene family in cucumbers., 2011, 34(4): 624-633.
[26] RAO G D, SUI J K, ZENG Y F, HE C Y, ZHANG J G. Genome-wide analysis of the AP2/ERF gene family in., 2015, 5: 132-137.
[27] MAZAREI M, PUTHOFF D P, HART J K, RODERMEL S R, BAUM T J. Identification and characterization of a soybean ethylene- responsive element-binding protein gene whose mRNA expression changes during soybean cyst nematode infection., 2002, 15(6): 577-586.
[28] DEFILIPPI B G, JUAN W S, VALDÉS H, MOYA-LEÓN M A, INFANTE R, CAMPOS-VARGAS R. The aroma development during storage ofas evaluated by gas chromatography, electronic nose, and sensory analysis., 2009, 51(2): 212-219.
[29] 李大鹏. 苹果醇酰基转移酶基因参与酯类香气合成调控机理的研究[D]. 泰安: 山东农业大学, 2005.
LI D P. Expression characterization of thegene and its regulation mechanism of volatile ester biosynthesis in apple (cv. Golden Delicious)[D]. Tai’an: Shandong Agricultural University, 2005. (in Chinese)
[30] BALBONTIN C, GAETE-EASTMAN C, FUENTES L, FIGUEROA C R, HERRERA R, MANRIQUEZ D, LATCHÉ A, PECH J C, MOYA-LEÓN M A., a gene encoding an alcohol acyltransferase, is involved in ester biosynthesis during ripening of mountain papaya fruit., 2010, 58(8): 5114-5121.
[31] 常博文, 刘杰, 钟鹏, 郭晓瑞. 外源乙烯对长春花生理水平和生物碱积累的影响. 植物研究, 2018, 38(2): 284-291.
CHANG B W, LIU J, ZHONG P, GUO X R.Effects of exogenous ethylene on physiology and alkaloid accumulations in., 2018, 38(2): 284-291. (in Chinese)
[32] LEI M, LI Z Y, WANG J B, FU Y L, AO M F, XU L., An age-dependent gene of, responds to exogenous ethylene treatment., 2016, 17(3): 303.
[33] 张红娜, 刘胜辉, 孙伟生, 李运合, 孙光明, 林文秋, 张秀梅, 吴青松. 菠萝对乙烯利诱花的敏感性差异研究. 热带作物学报, 2018, 39(6): 1087-1094.
ZHANG H N, LIU S H, SUN W S, LI Y H, SUN G M, LIN W Q, ZHANG X M, WU Q S.Ethylene induced sensitivity of difference pineapple varieties., 2018, 39(6): 1087-1094. (in Chinese)
Effects of Ethephon and 1-MCP on the Expression ofGene andTranscription Factors in Jackfruit Fruit
REN XueYan, LIU GuangCai, LI GuoPeng, YE ChunHai, FENG Feng, WANG JunNing
(Agricultural College of Guangdong Ocean University, Zhanjiang 524088, Guangdong)
【】The effects of Ethephon (ETH) and 1-methylcyclopropene (1-MCP) on AAT activities, the expression ofgene andtranscription factor were studied during ripening of jackfruit to provide a theoretical basis for further understanding the role of AATS in the synthesis of esters and its regulation. 【】The test material was jackfruit of Haida2. During the full bloom period, the fruit with the representative flowering period was labeled and harvested about 150 days after flowering. The fruits with the same size and maturity and no disease and insect damage were selected to divide into three groups for treatment. The first group was immersed in 1 000 mg∙L-1ETH solution for 2-3 min; the second group was fumigated with 0.5 mg∙L-11-MCP for 15 h; the third group, as a control group, was naturally matured at 22℃ and 90% relative humidity conditions. During fruit ripening, samples were taken periodically with 3-5 fruits per times. The flesh of the jackfruit was frozen in liquid nitrogen and then stored in an ultra-low temperature refrigerator at -80℃for determination of AAT activities, the expression ofgene andof jackfruit.【】By analyzing the activity of AAT enzyme, it was found that ETH treatment promoted the ripening and senescence of jackfruit, advanced the peak of the activity peak of AAT, but reduced AAT enzyme activity. 1-MCP treatment inhibited the ripening and senescence of fruits by inhibiting the AAT activity in the pre-storage period, delaying the time of peak AAT activity, and significantly reducing the activity of AAT enzyme. Sequence analysis ofgene showed that the total length ofgene was 1 380 bp, encoding 459 amino acids.had a conserved domain H-x-x-x-D and an L-x-x-YYPLAGR active site motif, a D(N)F(V) GWG add-on motif. Thegene belonged to the BAHD alcohol acyltransferase family, and its amino acid sequence had the highest similarity to apples and pears. At the same time, two ERF transcription factors, named, were cloned from the fruit of jackfruit, of whichwas 648 bp in length, encoding 215 amino acids, and had the highest homology with apple and kidney bean.was 657 bp in length, encoding 218 amino acids, with the highest homology with apples, papaya. The amino acid sequence of AheERF1/2 contained an AP2/ERF conserved sequence consisting of 64/65 amino acid residues and had a characteristic sequence of an ERF family transcription factor. ETH treatment advanced the expression peak ofgene in jackfruits and down-regulated its expression. The effects of ETH treatment on the expression oftranscription factor were identical to that ofgene. ETH treatment decreased the correlation betweengene andtranscription factor. 1-MCP treatment prolonged the storage period of jackfruit fruit. 1-MCP treatment prolonged the storage period of jackfruit fruit. The expression ofgene andtranscription factors were significantly reduced during the pre-storage period after 1-MCP treatment. 1-MCP down-regulated the expression levels ofandtranscription factor at the peak of their expressions. However, 1-MCP had little effect on the correlations of thetranscription factor with thegene. 【】 ETH treatment advanced the peak activity of AAT enzyme, the peak expression ofandtranscription factors, down-regulated the expression ofandtranscription factors, and decreased the activity of AAT enzyme and the correlation betweenandtranscription factors. Compared with the control group, 1-MCP treatment inhibited the activity of AAT enzyme, the expression ofgene andtranscription factors in the pre-storage phase, decreased the activity of AAT enzyme and down-regulated the expression levels ofandtranscription factors during the late storage period.
jackfruit; ETH; 1-MCP;gene
10.3864/j.issn.0578-1752.2019.21.017
2019-05-15;
2019-08-21
国家自然科学基金青年基金(31401928)、广东省自然科学基金博士启动项目(S2013040011544)、广东海洋大学引进人才科研启动项目(1312130)、广东海洋大学硕士学位论文培育项目(201841)、广东海洋大学配套经费项目(C15486,C15491)、广东海洋大学大学生创新项目(CXXL2014068)
任雪岩,E-mail:xy85580@163.com。通信作者王俊宁,Tel:07592383252;E-mail:wangjunningb@126.com
(责任编辑 赵伶俐)

