DKK1通过抑制MMP2、MMP9的表达影响人小细胞肺癌SBC-5细胞的增殖和侵袭能力的研究
陈文娟,雷光焰,赵 征,雷宝霞,韩 乐*
(陕西省肿瘤医院 1.内三科;2.胸外科,陕西 西安710061)
2018年全球癌症统计显示:肺癌的发病率和死亡率均居恶性肿瘤首位[1]。小细胞肺癌(Small cell lung cancer,SCLC)约占肺癌发病率的14%,具有高度侵袭性,约60%患者就诊时已是广泛期[2]。约70%的患者对标准一线化疗反应较好,但不可避免的复发,二线治疗有效率有限,2年的总生存小于5%[3,4]。免疫检测点抑制剂在SCLC治疗中仍在探索阶段[5]。因此,深入研究SCLC发生发展分子机制至关重要。
DKK1是Wnt信号通路的负向调控因子,与多种肿瘤的发生发展相关[6]。MMP2和MMP9是基质金属蛋白酶(matrix metalloproteinases,MMPs)家族成员,在肿瘤转移和侵袭过程有重要作用。结合文献报道及小细胞肺癌的特征,猜测DKK1和MMPs可能与小细胞肺癌的发生发展有相关性。为进一步证实,本课题组采用慢病毒感染的方法稳定下调SBC-5细胞中DKK1的表达,观察下调DKK1表达对SBC-5细胞增殖和侵袭能力的影响,并对分子机制进行初步探讨。
1 材料与方法
1.1 材料人小细胞肺癌SBC-5细胞株冻存于实验室液氮罐、PCR引物由上海生工设计合成、DKK1、MMP2和MMP9抗体(兔抗人)购自Abcam 公司、β-actin(鼠抗人)抗体购自Sigma 公司、慢病毒由吉凯公司合成,其余常用试剂及仪器为实验室备用。
1.2 细胞培养SBC-5细胞复苏、重悬,于37 ℃、5% CO2孵箱中培养,常规消化传代,扩大培养,后续实验取对数生长期的细胞。
1.3 构建DKK1表达下调的SBC-5细胞株处理细胞,调整密度为1×104/ml,6孔版每孔加入2 ml细胞悬液,培养24 h,密度达20%且状态良好时换为无血清培养基,取DKK1过表达慢病毒及相应对照病毒,分别在含有Polybrene的ENi.S感染液中进行感染。基因靶序列:GAACCACCTTGTCTTCAAA。感染24 h更换成完全培养基,72 h观察细胞形态及绿色荧光的比例,大于80%提示感染成功。扩大培养,加入1 μg/ml嘌呤霉素筛选1周。
1.4 RT-PCR和Western-bloting方法鉴定SBC-5-DKK1-siRNA细胞株构建成功① RT-PCR: 按照操作步骤进行RNA提取,测定浓度和纯度。进行反转录和荧光定量PCR,β-actin作为内参,2-ΔΔCT法计算结果。② Western-bloting:冰上裂解细胞30分钟,提总蛋白,定量并制备蛋白样品;SDS-聚丙烯酰胺凝胶电泳,湿转法转膜,5%BSA室温封闭1 h,1×TBST 洗涤3次,每次15 min,BSA稀释的1∶2000 DKK1和1∶ 8000 β-actin一抗4℃过夜杂交,洗涤方法同上,1∶2000稀释的二抗室温杂交1 h,同上洗涤;ECL显影、曝光。
1.5 平板克隆形成实验细胞密度调整为2×103/ml,6孔版每孔100 μl细胞悬液,培养液补至2 ml,常规培养。肉眼可见克隆形成时终止培养,预冷PBS洗3次,甲醇固定15 min,结晶紫染液染色20 min,自来水冲洗,空气干燥。肉眼计数可见克隆数,计算克隆形成率:克隆形成率(%)=(克隆数/接种细胞数)×100%。重复3次。
1.6 Transwell细胞侵袭实验用Matrigel基质胶包被Transwell小室基底膜,室温风干;无血清培养基重悬细胞,密度调整为5×104/ml,取200 μl/孔加入含8 μm孔径膜的Transwell上室,下室加入500 μl完全培养基,培养24 h。拿出小室,淋洗及染色步骤同平板克隆实验,计数穿过微孔膜的细胞数,随机取10个视野,取平均值。重复3次。
1.7 Western-bloting法检测MMP2和MMP9蛋白的表达实验步骤同上所述。一抗为1∶2000 MMP2、MMP9和1∶ 8000 β-actin。
1.8 统计学方法采用SPSS24.0统计学软件进行t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 下调DKK1表达的SBC-5-DKK1-siRNA细胞株的构建
感染72 h观察两组细胞荧光率大于80%(图1),且形态良好,提示感染成功。
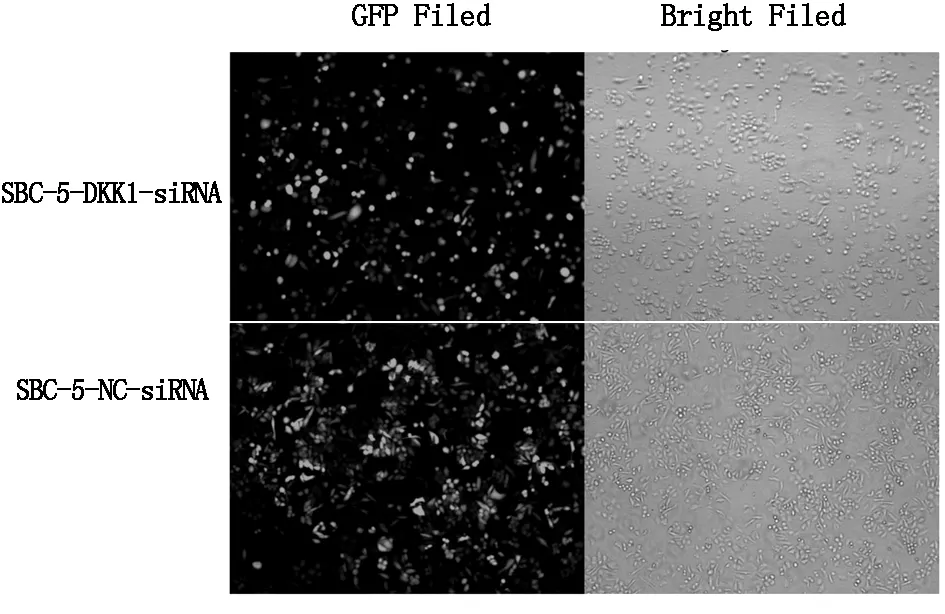
图1 倒置荧光显微观察慢病毒感染SBC-5细胞后两组细胞的形态及荧光,可见感染效率大于80%
2.2 下调DKK1表达的SBC-5-DKK1-siRNA细胞株的鉴定
RT-PCR和Western-bloting方法验证感染效率。结果提示:实验组中DKK1的mRNA和蛋白表达水平均显著低于对照组细胞(图2A,B)。
2.3 平板克隆形成实验
计数两组细胞克隆形成的数目,计算克隆形成率,结果显示:实验组为(0.11±0.01),低于对照组(0.20±0.01),差异具有统计学意义(P=0.0097)(图3A,B)。
2.4 Transwell 实验检测细胞的侵袭能力
计数穿过小室基底膜的细胞数:每高倍视野(×200)下实验组穿过基底膜细胞数为58.67±6.01,对照组为158± 6.56(图4A,B),两组间差异均具有统计学意义(P=0.0059) 。
2.5 Western-bloting检测两组细胞中MMP2和MMP9蛋白表达差异结果显示:与对照组相比,实验组MMP2和MMP9蛋白的表达均被抑制(图5)。
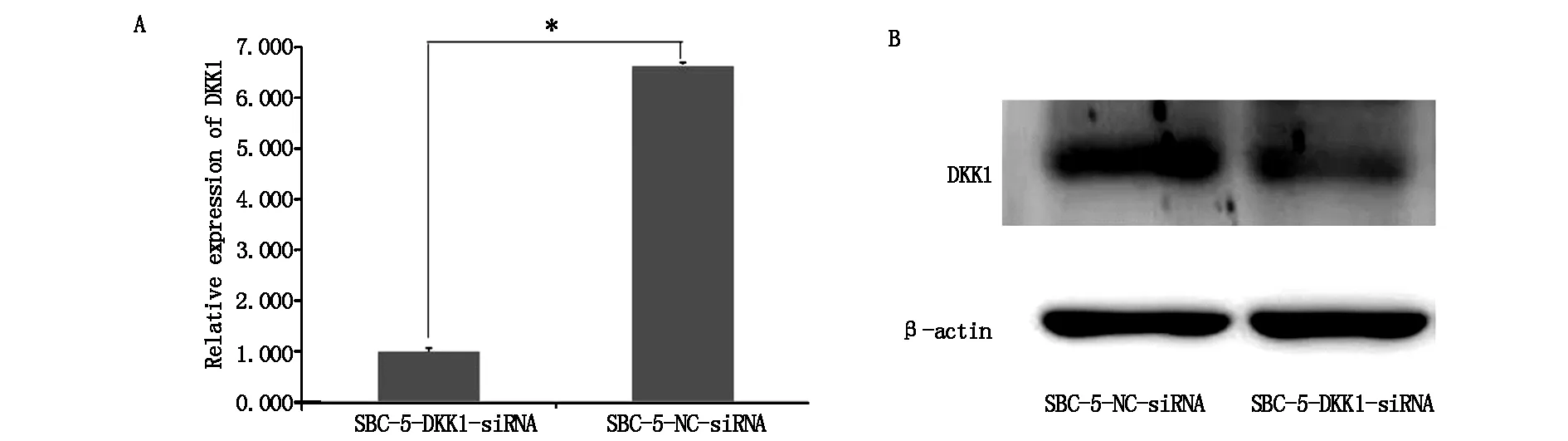
图2 两组细胞中DKK1mRNA和DKK1蛋白的表达(*P<0.05)
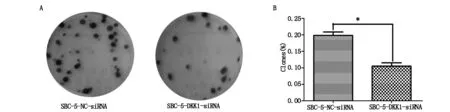
A:下调DKK1表达对SBC-5细胞克隆形成能力的影响;B:实验结果的统计学分析( *P<0.05)
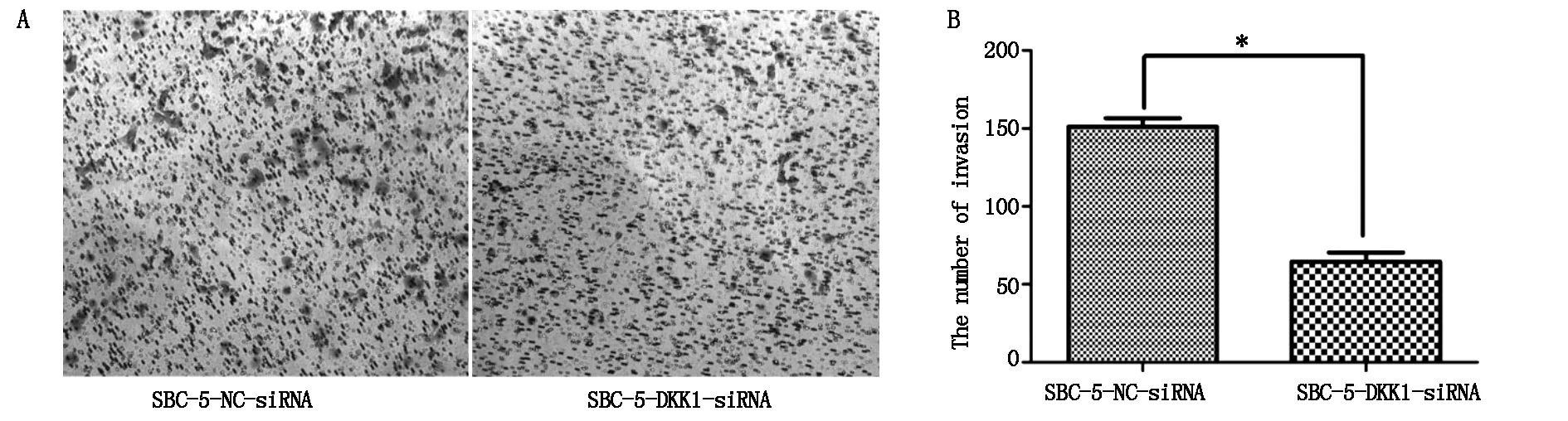
A:Transwell 检测细胞的侵袭能力变化;B:侵袭能力统计分析(*P<0.05)
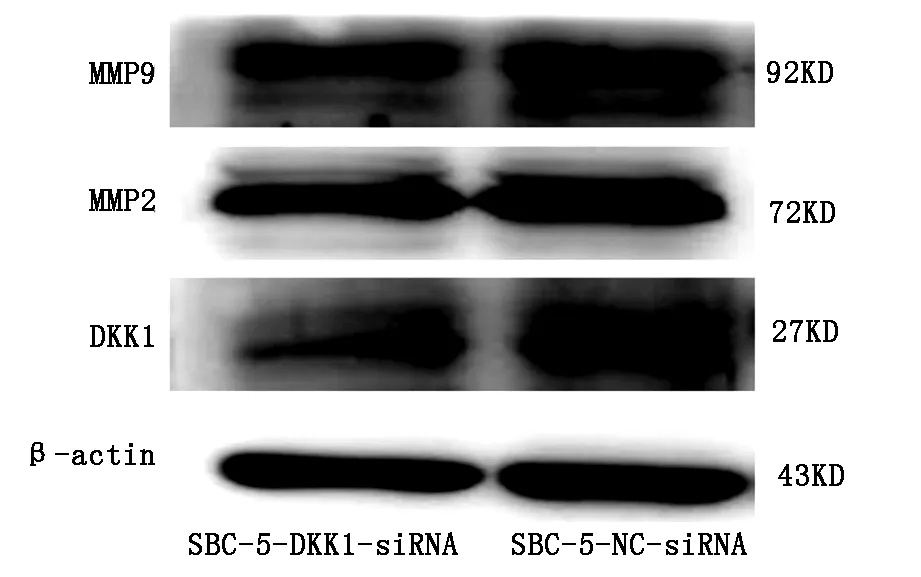
图5 Western-bloting法检测下调DKK1后两组细胞中MMP2和MMP9蛋白表达的差异
3 讨论
Wnt信号通路被认为与肿瘤的发生、肿瘤细胞的增殖及转移等过程密切相关[7]。DKK1是DKKs家族中的一员,属于分泌型蛋白。通过与Wnt受体LRP5/6及跨膜蛋白Kremen1/2结合形成三聚体,诱导其内吞而发挥抑制Wnt信号通路的作用[8]。
DKK1被报道在乳腺癌细胞株MDA-MB-231和前列腺癌细胞株C4-2B 中过表达,通过抑制Wnt通路引起骨溶解的增加[9,10]。DKK1在NSCLC患者血清水平和细胞株中表达升高,尤其是骨转移者[11]。尽管DKK1被报道与多种恶性肿瘤相关,但在SCLC中的研究仍较少。结合文献及SCLC易发生转移的特点,猜想DKK1可能在小细胞肺癌的发生发展过程中发挥着重要的作用。我们选取具有高增值能力及转移能力的BC-5细胞,下调DKK1的表达,发现细胞的增殖及侵袭能力被抑制。提示DKK1对SBC-5细胞的生物学行为均有影响。初步揭示DKK1可能参与了SCLC的发生发展过程。
DKK1对Wnt信号通路的调控较为复杂[12]。为初步探讨DKK1影响SBC-5细胞株的机制,我们检测下调DKK1表达后MMP2和MMP9的表达,发现MMP2和MMP9的表达均被抑制,初步揭示DKK1可能通过MMP2和MMP9在SCLC中发挥作用。MMP2和MMP9参与了肿瘤的增殖、侵袭及转移等过程,特别是在新生血管的形成中发挥着重要的作用[13]。Maniotis等人发现在高侵袭性葡萄膜黑色素瘤中,存在血管生成拟态(vasculogenic mimicry,VM)现象[14],MMP2和MMP9被称为VM相关蛋白。Lingli Yao等[15],在高表达DKK1和低表达DKK1的NSCLC细胞株A549和H460中,分别下调和上调DKK1表达,观察到下调DKK1表达后VM相关蛋白MMP2及MMP9表达均被抑制,上调组结果相反。本实验在SBC-5细胞株中的结果与文献报道结果一致。提示DKK1可能通过MMP2和MMP9影响小细胞肺癌的发生、发展及转移。
综上所述,本实验初步验证了DKK1对SBC-5细胞株生物学行为的影响,同时揭示DKK1可能通过调节血管拟态相关蛋白MMP2和MMP9的表达在小细胞肺癌中发挥生物学功能。为后续深入研究DKK1在人SCLC中的作用机制奠定实验基础。

