SAMHD1参与逆转座子LINE-1调控在白血病发病中的机制研究
魏宇鹏,关宝杰
(吉林省一汽总医院,吉林 长春130011)
LINE-1 (long interspersed nuclear elements-1)是现今人体内唯一具有自主转座活性的逆转座子,广泛分布于基因组中[1]。宿主细胞对LINE-1的转座有着严格地控制,在正常分化的细胞中,LINE-1的启动子为高度甲基化状态,造成沉默[2,3]。当机体对LINE-1的控制能力减弱时,基因组的稳定性会受到巨大威胁[4],进而引发基因缺陷性疾病甚至癌变。有研究表明在几乎所有的肿瘤细胞中LINE-1均为激活状态。了解机体对于LINE-1的调控机制,对于理解这些疾病的发生至关重要。SAMHD1蛋白(SAM domain and HD domain containing protein 1)最早在人树突状细胞(DCs)的cDNA文库中发现[5]。SAMHD1是人体唯一已知的dNTP水解酶,通过控制细胞内dNTP池的丰度参与体内核酸调控,在维持基因组稳定的过程中发挥着关键作用[6],SAMHD1的突变是免疫缺陷性疾病AGS的重要诱因[7]。作为宿主细胞的天然抗病毒因子,SAMHD1被发现具有广谱的抗逆转录病毒和DNA病毒功能[5]。LINE-1的转座与逆转录病毒的整合过程十分相似,SAMHD1同样也是人体调控LINE-1活性的关键蛋白,随着LINE-1检测方法的优化,在多种肿瘤和癌变组织中发现了大量LINE-1转座的证据,这种LINE-1的异常活化现象往往反映了较深的癌变程度[8]。结合SAMHD1频繁突变在白血病、大肠癌、肺癌和肝癌中的陆续发现,提示我们LINE-1的转座增加与SAMHD1的频繁突变很可能存在某种联系。SAMHD1的突变导致LINE-1异常活化,可能是白血病等多种肿瘤发生的重要诱因。白血病是一类造血干细胞恶性克隆性疾病,在我国发病率在各种肿瘤中在第六位。目前对于白血病的发病机制仍然缺乏了解。本研究选取来自白血病中的SAMHD1突变体,探讨其对于逆转座LINE-1的活性影响。
1 资料与方法
1.1 研究对象参考国内外白血病来源的样本中的SAMHD1突变信息,选取3个突变位点,其可能位于SAMHD1的活性中心、变构中心、四聚体形成的交界面等关键位置。分别是E355K,T365P,P158S,以野生型SAMHD1(109aa-626aa)为对照。
1.2 研究方法
1.2.1SAMHD1相关突变体在体外表达及纯化 选定的SMAHD1突变位点,分别将其构建到原核表达载体pET28a和真核表达载体VR1012上。BL21(DE3)预表达SAMHD1 WT及相关突变体,当OD600是0.6时,0.5 mM IPTG,16℃诱导过夜。次日收菌,超声破碎,3 000 rpm/5 min,离心去细胞碎片,然后收集上清,12 000 rpm/20 min分离可溶性蛋白及不可溶性蛋白,用Western Blot检测蛋白表达情况。将表达好的突变体扩大培养,先用镍柱亲和层析纯化,继续用凝胶过滤层析(GE Superdex 200)纯化,分离得到SAMHD1单体,BCA法测量SAMHD1单体蛋白浓度并分装,-80℃保存,为接下来的一系列实验做准备
1.2.2检测SAMHD1相关突变体dNTPase活性。分别取等量纯化好的SAMHD1 WT及各种突变体单体蛋白,加5 mM MgCl2,0.5 mM dGTP,25℃分别诱导0.5 h,6 h,24 h后,终浓度10 mM EDTA终止反应。样品用10 kd超滤管超滤后12 000 g/20 min,离心,达到除去SAMHD1蛋白(70 kd)及杂质的目的。收集反应产物并用HPLC(安捷伦)分离,分离柱子:150×2.0 mm C18 柱子 (Phenomenex)。用260 nm波长检测产物。使用标准品dG校正产物的出峰位置。
1.2.3SAMHD1 WT及突变体抗LINE-1的活性检测 使用99-PUR-L1RP-EGFP载体检测突变体抗LINE-1的活性,其包含一个可筛选的抗性基因-Puro,该表达质粒转染细胞后,其反转录产物需要经过剪切和拼接,并插入基因组后,细胞才能表达EGFP。阴性对照为JM111。EGFP的阳性率通过流式细胞仪检测,可以直接反映LINE-1的转座活性。实验过程:第1天HEK293T铺板,第2天细胞密度达到20%左右,将1.5 μg 99-PUR-L1RP-EGFP分别与空载体,SAMHD1及突变体质粒共同转染EK293T,阴性对照是JM111。转染后48 h,将培养基换成10% FBS的DMEM并含有5 nmol Puro,继续培养2 d后收细胞, LINE-1的EGFP阳性率用流式细胞仪检测。
2 结果
2.1 SAMHD1及其突变体的表达情况pET28a-SAMHD1-WT及3个突变体在大肠杆菌中预表达,蛋白免疫印迹检测,结果表明(图1a)所有的突变体均表达,但是E355K、T365P突变体的可溶性表达的蛋白量比较少。VR1012-SAMHD1-WT及3个突变体在真核表达系统HEK293T细胞中表达,SAMHD1 WT及3个突变各转染100 ng,表达结果如图(图1b),均可表达, T365P表达较弱,推测这突变导致蛋白不能正确折叠,所以导致它们在原核和真核表达系统中的表达量均受到影响,这也可能影响其发挥功能。
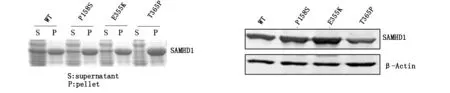
(a)SAMHD1突变体在大肠杆菌中的表达情况(S:上清;P:沉淀)。(b) SAMHD1突变体在293T细胞中的表达情况
2.2 SAMHD1野生型及其突变体dNTPase活性检测纯化获得SAMHD1野生型和不同突变体的蛋白,利用高效液相色谱法检测其dNTPase活性,结果(图2)表明与野生型相比,3个SAMHD1突变体的dNTPase活性均有显著下降,说明选取的3个白血病相关SAMHD1突变体都失去了dNTPase活性。
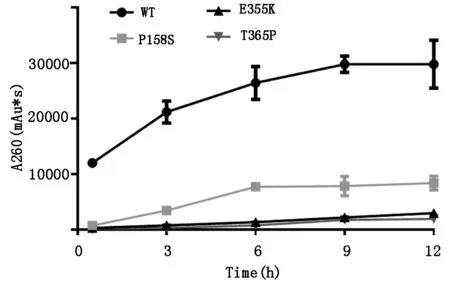
图2 SAMHD1突变体dNTPase活性的检测
2.3 SAMHD1及其突变体抑制LINE-1活性的检测在HEK293T共转染SAMHD1和LINE-1质粒,48 h后加puro筛选,96 h后流式细胞仪检测EGFP的比率,结果表明(图3)5个SAMHD1突变体在抑制LINE-1方面均存在缺陷,大多数没有dNTPase活性的SAMHD1突变体,其抑制LINE-1的能力也显著减弱。
3 讨论
目前人们对于SAMHD1抑制LINE-1的分子机制仍所知有限。2013年赵可等人首次发现SAMHD1通过抑制LINE-1的ORF2p表达,进而抑制LINE-1的活性,突变体D311A没有dNTPase活性,还有部分抑制LINE-1的能力[9];2015年,郭斐团队发现SAMHD1通过增加细胞内的eIF2α磷酸化和解聚eIF4A/eIF4G复合物促进应急颗粒的形成,限制LINE-1核糖体蛋白复合物RNPs从胞浆转移到胞核内,从而抑制LINE-1的转座,失去dNTPase酶活的SAMHD1突变体,不能通过隔离LINE-1的RNPs抑制LINE-1的活性,并认为dNTPase酶对抑制LINE-1很关键;在结构方面,有研究证明,锌离子结合位点(His167、His206、Asp207、Asp311)的突变会破坏蛋白与锌离子的结合,使突变体都丧失dNTPase活性,在不同的文献上发现这些突变体在不同程度上失去对LINE-1的抑制。SAMHD1 S33位点在韩国人群中存在多态性,当引入小残基突变时,其失去抑制LINE-1转座的能力;2018年,研究者发现SAMHD1 的592位发生磷酸化缺陷的突变(T592A)时,可以显著增强其对LINE-1逆转录的抑制。上述研究者分别从不同角度研究了SAMHD1抑制LINE-1的过程,证明有多种因素影响着SAMHD1对LINE-1的调控,尤其SAMHD1的dNTPase活性对其抑制LINE-1的影响众说纷纭。借助来源于临床肿瘤组织的SAMHD1突变信息,通过构建突变体,考察SAMHD1抑制LINE-1的可能机制,将有助于我们更真实、更深刻地了解SAMHD1抑制LINE-1逆转座活性这一重要的生理过程。
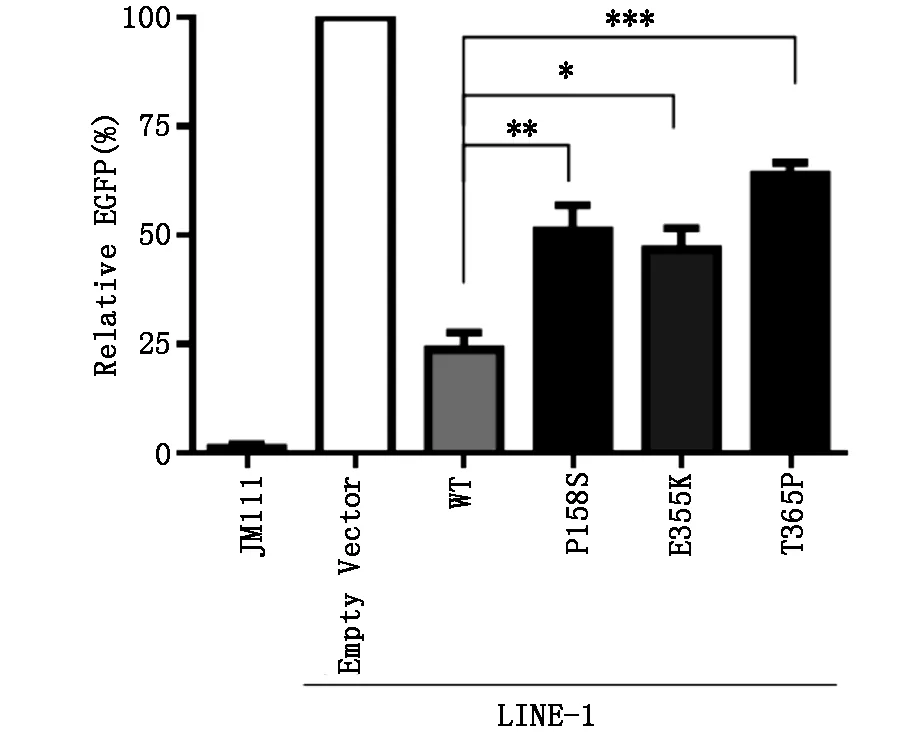
图3 SAMHD1突变体抑制逆转座子LINE-1活性检测
本研究选取的来源于白血病样本中SAMHD1突变,其dNTPase活性均出现明显下降,而其抑制逆转座子LINE-1的能力也同样显著降低。SAMHD1具有dNTPase活性是维持体内核酸稳态的关键,其可以通过降低细胞内dNTP水平,控制逆转座子的活性,维持基因组稳定性。SAMHD1在白血病、结肠癌等肿瘤中的突变和下调,预示着其可能是潜在的抑癌基因,而SAMHD1突变与逆转座子LINE-1活化间的关联,又为相关肿瘤的诊疗和预判提供新的思路。

