乌头中内生真菌的分离鉴定及其抑菌活性和机制研究
夏 飞, 上官晓雨, 冯思亮, 汪梦雯, 杨 苗, 胡 松, 郑 雪
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
乌头(AconitumcarmichaeliDebx.)为毛茛科,乌头属多年生草本药用植物,其子根经炮制、加工后形成我国传统中医上常用的一种中药材——附子.传统中医认为附子味甘、大热、有大毒,是公认的补火要药[1],具有抗炎、提高机体免疫力、麻醉止痛、抗肿瘤、调节内分泌等功效.在临床上,附子对于慢性肾炎、急性菌痢疾等疾病,具有良好的治疗效果[2].由于附子良好的临床药用效果,对附子生物资源的综合开发利用具有重要的意义.
植物内生真菌是共生于植物组织中而不引起植物病变的真菌[3],内生真菌能刺激植物的生长发育并能提高植物抗逆能力[4],往往具有丰富的物种多样性[5,6].目前认为,植物内生真菌可以产生与植物相同或者相似的化学成分.药用植物中的内生真菌能够产生萜类、生物碱类、苯丙素类、甾体化合物等多种次生代谢物[7,8],在生物医药开发、农业病虫害防治等各方面极具开发价值.其次,内生真菌还能够产生一些抑菌物质,由于其物质来源的天然性,具有较高安全性,可作为食品中抑制微生物的添加剂[3].大肠杆菌、金黄色葡萄球菌、四联球菌是食品中常见的污染菌[9-11],能够引起食品腐败变质,甚至危害人体健康.因此,从药用植物中分离、筛选真菌资源抑制这些有害微生物就显得尤为重要.
目前,乌头内生真菌微生物资源开发利用仍不够充分.为深入开发利用乌头内生真菌资源,本研究从乌头侧根中分离若干内生真菌菌株,通过形态学结合ITS序列分析对其进行初步的分类鉴定.并探索分离菌株发酵液对大肠杆菌(EsherichiacoliCMCC (B) 44102)、金黄色葡萄球菌(StaphylococcusaureusCMCC (B) 26003)、四联球菌(Micrococcustetragenus)、枯草芽孢杆菌(Bacillussubtilis)、酿酒酵母(Saccharomycescerevisiae)的抑菌活性.并从生长曲线、胞外蛋白含量及电导率变化方面,初步探究其抑菌机制.本研究为通过微生物工程、发酵工程手段综合开发利用乌头药用植物资源奠定基础.
1 材料与方法
1.1 实验材料
1.1.1 原料及菌种
新鲜乌头侧根,来源于汉中,南郑区附子栽培基地.
供试菌株:大肠杆菌(EsherichiacoliCMCC (B) 44102)、金黄色葡萄球菌(StaphylococcusaureusCMCC (B) 26003)、四联球菌(Micrococcustetragenus)、枯草芽孢杆菌(Bacillussubtilis)、酿酒酵母(Saccharomycescerevisiae)均为本研究室保藏菌株.
1.1.2 主要试剂和培养基
葡萄糖、氯化钠、琼脂粉、酵母浸粉、蛋白胨,以上试剂均为国产分析纯.真菌基因组提取试剂盒(天根生化科技有限公司).
马铃薯蔗糖琼脂培养基(PDA):土豆200 g,葡萄糖20 g,琼脂20 g,水1 000 mL,pH自然.PDA中不添加琼脂即为PDB培养基.
LB液体培养基:蛋白胨10 g,酵母粉5 g,氯化钠10 g,pH为7.0.
1.1.3 主要仪器
紫外可见分光光度计(SP-756PC,上海光谱仪器有限公司);立式压力蒸汽灭菌器(LS-C50L,江阴滨江医疗设备厂);离心机(TDL-80-2B,上海安亭科学仪器厂);霉菌培养箱(MJX-150-Ⅱ,北京科伟永兴仪器有限公司);电导率仪(DDSJ-308A,上海仪电科学仪器股份有限公司).
1.2 实验方法
1.2.1 内生真菌的分离
将新鲜乌头侧根清洗干净,用无菌水清洗三次.在超净工作台中用75%(v/v)的酒精清洗其表面,再用无菌水淋洗乌头表面残余酒精.切取清洗干净的乌头侧根表面材料,置于PDA培养基培养,以确定乌头侧根表面无微生物污染.按照张立新等[12]的方法采用PDA培养基对乌头侧根中内生真菌进行分离,分离出真菌菌株纯化后保存备用.
1.2.2 内生真菌的鉴定
(1)平板形态观察
将分离出的真菌单点接种于PDA平板,在28 ℃下培养7 d.观察分离菌株的菌落和显微细胞形态.
(2)转录组间隔区(Internal Transcribed Spacer,ITS)序列分析
无菌条件下刮取单菌落菌丝至研钵,加入无菌石英砂,研磨.并使用试剂盒提取菌株DNA.之后采用引物对ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对真菌的ITS序列进行扩增[13].PCR反应体系和扩增条件如前所述[14].PCR产物经1.0%琼脂糖凝胶电泳确认大小及完整性后,送上海生工生物工程股份有限公司进行测序分析.测序结果提交NCBI数据库进行比对,并采用MEGA 6.0软件绘制系统发育树,选用Neighbor-Joining绘图算法,重复迭代1 000次[15].
1.2.3 内生真菌发酵液的抑菌活性及机制探究
(1)抑菌效果研究
内生真菌发酵液抑菌作用采用滤纸片法[16]进行测定.将无菌滤纸片浸满过滤除菌后的内生菌发酵液,用无菌镊子置于涂满指示菌的平板上.指示菌为细菌的平板置于37 ℃下培养24 h;酵母指示菌平板置于28 ℃培养3 d,观察是否出现抑菌圈,并测量抑菌圈直径.选择抑菌效果最明显的内生真菌菌株进行抑菌机制的研究.
(2)抑菌机制研究
探讨不同添加量的菌株C的除菌发酵液对指示菌生长的影响.每100 mL指示菌发酵液中分别添加0.1 mL、0.2 mL、0.4 mL、0.8 mL、1.6 mL菌株C的除菌发酵液,置于37 ℃,130 rpm/min条件下培养.每2 h取样,于600 nm处测得吸光值,测定指示菌的生长曲线[17].为研究菌株C的除菌发酵液对指示菌细胞结构的影响,采用考马斯亮蓝G-250法测定指示菌液蛋白质含量[18],指示菌电导率采用电导率仪进行测定.
1.3 统计分析
每个试验重复三次,结果表示为Means±SD,采用ORIGIN(Origin Pro 9.0)作图.
2 结果与讨论
2.1 乌头侧根内生真菌的分离及菌落形态
从乌头侧根中分离的若干菌株中,其中4株在PDA培养基上形态差别非常明显(如图1所示),分别命名为菌株A,菌株B,菌株C和菌株D.菌株A菌落呈现青竹色(#72baa7),菌落表面有放射状皱纹,并有红色渗出液滴分布于菌落之上(图1(a)),并渗入培养基中,平板背面呈现紫红色.菌株B的菌落呈现灰色,菌落表面呈现褶皱(图1(b)),菌株B产生黄色色素渗入培养基中呈现亮黄色.菌株C菌落呈现松叶色(#74905d)细密的形态,在平板表面如同粉末状,无褶皱.菌落周围菌丝呈现白色,无液滴渗出及色素产生现象(图1(c)).菌株D菌落呈现草色(#6d8346),质地细密,菌落上有褶皱,无色素产生(图1(d)).
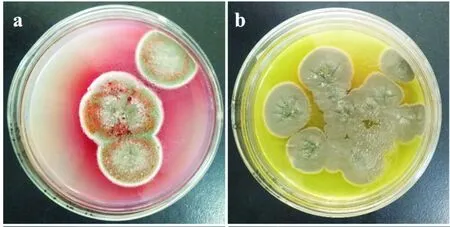
(a)菌株A (b)菌株B

(c)菌株C (d)菌株D图1 内生真菌在PDA培养基上的生长形态
2.2 内生真菌的鉴定
2.2.1 内生真菌ITS序列分析
将4株真菌的ITS序列提交NCBI数据库进行BLAST比对,并进行系统发育分析,如图2所示.结果表明:菌株A与Talaromyces属聚在一簇,具有极高的相似性,初步确定菌株A是篮状菌属(Talaromyces)真菌.菌株B与青霉属(Penicillium)的真菌在同一簇,具有非常高的同源性.菌株C与Aspergillus属Aspergillusniger、A.tubingensis、A.costaricaensis等具有很高同源性,初步确定菌株C为曲霉属(Aspergillus)真菌.菌株D与枝孢霉属(Cladosporium)真菌同源性较高,可初步判断菌株D是枝孢霉属(Cladosporium)真菌.本研究中分离到的四株内生真菌的分类信息初步确定为Talaromyces、Penicillium、Aspergillus和Cladosporium四个属.这四种内生真菌,李治滢等[19]从药用乌头中也曾分离到.由于ITS序列用于真菌分类的分辨率并不是特别精确,仅依据ITS序列系统发育树并不能对分离到的内生真菌进行准确分类,需结合形态学观察等方法做进一步探讨.

图2 分离的内生真菌ITS序列系统发育树
2.2.2 内生真菌的显微形态观察
菌株A的子囊果由菌丝交织而成,无孔口,状若篮网,外无硬壳包裹(图3(a)),其子囊的形态与文献[20,21]中报道的篮状菌属相似.菌株A分生孢子头呈现帚状分枝,未见其有足细胞(图3(b)).其子囊孢子呈现椭圆形(图3(c)),单生.结合ITS序列分析及形态学的观察,菌株A与篮状菌属中T.purpureogenus极为相似.T.purpureogenus曾被报道从三七中分离得到,其能够产生2个Drimane倍半萜化合物[22].菌株B形成子囊果进行有性生殖,其子囊果是由菌丝缠绕而使其呈现球型,外部无闭囊壳,子囊表面不光滑(图3(d)).菌株B分生孢子头呈现扫帚状,分生孢子较大,呈现圆形(图3(e)、(f))结合系统发育树分析及显微形态结构,菌株B与橘青霉(P.citrinum)的特征极为相似.
菌株C的子囊果为规则的圆形,其中包含大量的孢子(图3(g));其分生孢子头形态呈扫把状,无足细胞(图3(h));菌株C的孢子呈串排列(图3(i)).通过ITS序列比对,菌株C与黑曲霉的相似度达到100%,但通过平板形态观察与显微形态观察,发现菌株C与常见的黑曲霉(A.niger)的形态并不一致.导致这一结果的原因是由于黑曲霉类群包含8种在形态上难以区分的分类群,A.tubingensis、A.luchuensis和A.costaricaensis都包含于A.niger中[23].菌株D的子囊果呈现较松散球型,无外壳包裹.子囊果外围由子囊致密地排列,而中间的子囊较为松散(图3(j)).其分生孢子呈分枝状,分生孢子梗略作匍匐状(图3(k)),分生孢子形成短链(图3(l)).菌株D与Cladsporiumcladosporioides形态最为接近,据报道,Cladsporiumcladosporioides是一种能够产生紫杉醇的真菌[24,25].
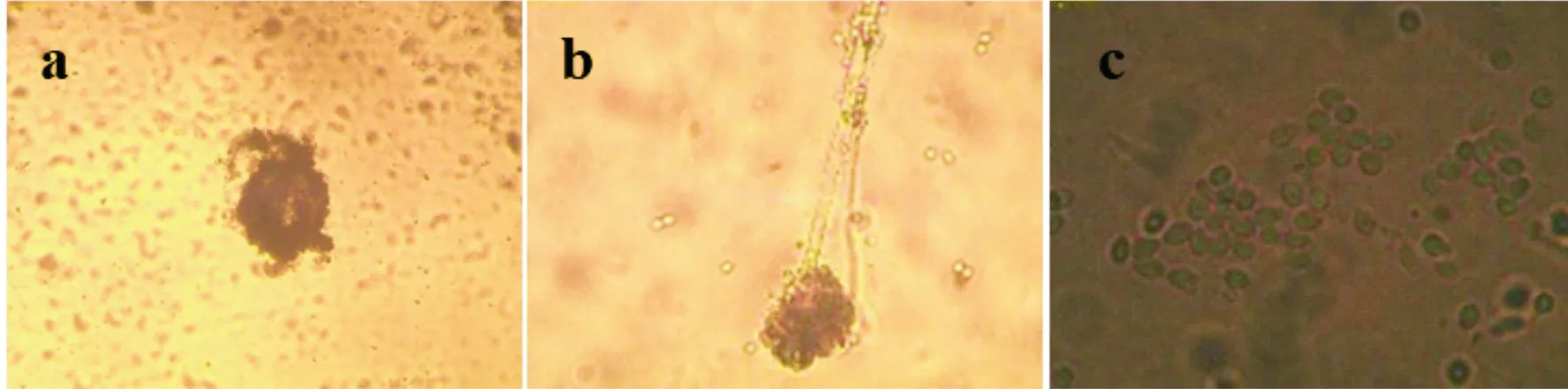
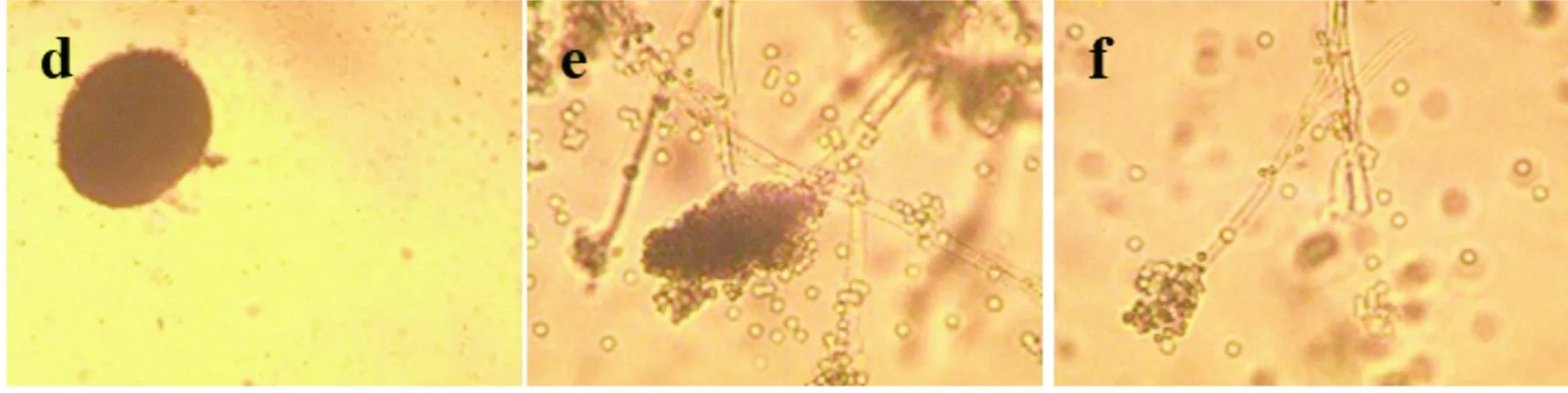


(a)菌株A子囊果形态(×100) (b)菌株A分生孢子头形态(×100) (c)菌株A孢子形态(×400) (d)菌株B子囊果形态(×100) (e)菌株B分生孢子头形态(×100) (f)菌株B分生孢子头及孢子形态(×400) (g)菌株C子囊果形态(×100) (h)菌株C分生孢子头形态(×100) (i)菌株C孢子形态(×400) (j)菌株D子囊果形态(×100) (k)菌株D分生孢子头形态(×100) (l)菌株D孢子形态(×400)图3 乌头侧根内生真菌的显微镜形态
2.3 内生真菌的抑菌活性
2.3.1 具有抑菌活性的内生真菌的筛选
内生真菌发酵液的抑菌活性如表1所示.菌株C的除菌发酵液对金黄色葡萄球菌表现出较明显的抑制作用,对四联球菌也有一定的抑制作用(图4),然而菌株C除菌发酵液对其他指示菌,如大肠杆菌、枯草芽孢杆菌以及酿酒酵母并没有表现出明显抑制作用.本研究中分离的其它内生真菌对指示菌的抑制效果并不明显.

表1 内生真菌发酵液的抑菌作用
注:“-”表示无抑制作用,“+”表示有抑制作用,“++”表示抑制作用较明显
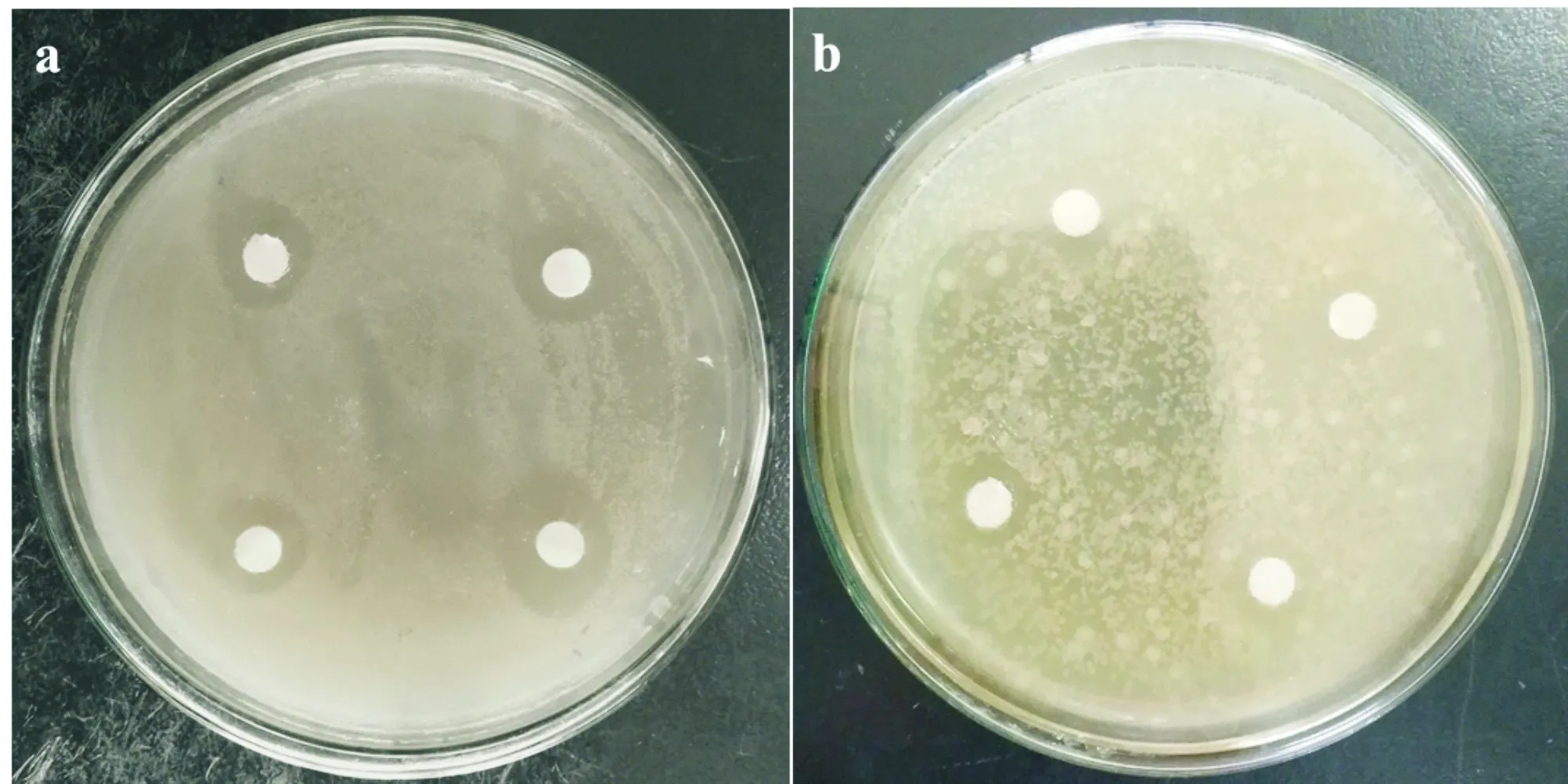
(a)金黄色葡萄球菌 (b)四联球菌图4 菌株C发酵液对金黄色葡萄球菌和四联球菌的抑制效果
2.3.2 菌株C发酵液对金黄色葡萄球菌生长的影响
添加不同量的菌株C的除菌发酵液对金黄色葡萄球菌均表现出抑制作用(图5).菌株C发酵液在金黄色葡萄球菌发酵液中比例小于0.4%时,金黄色葡萄球菌的生长曲线趋势与对照组相同,在0~4 h处于生长迟滞期,4~12 h进入对数生长期,12 h后进入生长稳定期.添加了菌株C发酵液的实验组中金黄色葡萄球菌仍然能够生长,但相同时期其菌量明显低于对照组.当发酵液添加量大于0.4%时,金黄色葡萄球菌的生长受到极大的抑制,在4~12 h的对数生长期未进行增殖.当培养至12 h时,金黄色葡萄球菌开始进行增殖.由此可以推断,菌株C的除菌发酵液可以推迟金黄色葡萄球菌的对数期.蒋斌等[26]在研究连翘对金黄色葡萄球菌的抑菌作用机制时,也发现金黄色葡萄球菌的菌量值低于对照组,连翘可推迟其对数期,在一定程度上与本研究结果相近.

图5 菌株C发酵液对金黄色葡萄球菌生长曲线的影响
2.3.3 菌株C发酵液对金黄色葡萄球菌胞外蛋白含量的影响
对金黄色葡萄菌培养过程中胞外蛋白质含量进行测定,探究菌株C发酵液抑制金黄色葡萄球菌的作用途径.采用考马斯亮蓝G-250比色法构建的蛋白质标准曲线方程为Y=6.227 6X+0.000 6(R2=0.997 4).菌株C发酵液在金黄色葡萄球菌发酵液中比例小于0.4%时,胞外蛋白质含量明显下降(图6),而菌株C发酵液添加量为0.1%和0.2%时,对细胞外蛋白质含量影响不大.整体上,由于菌株C发酵液并没有完全抑制金黄色葡萄球菌的生长,胞外蛋白质含量随着时间延长均呈现明显的增加趋势.已有研究证实,在药用植物荆芥提取物抑制酵母生长过程中,酵母胞外蛋白含量也呈现上升趋势,且明显高于对照组[27].这与本研究中观察的到现象相似.

图6 菌株C发酵液对金黄色葡萄球菌胞外蛋白质含量变化的影响
2.3.4 菌株C发酵液对培养基电导率的影响
菌株C发酵液添加对金黄色葡萄球菌菌液电导率并没有表现出非常明显的规律.然而,不同处理组的不同时期,与对应对照组相比,金黄色葡萄球菌菌液的电导率仍有一定的变化,如表2所示.菌液电导率增加表示细胞膜结构受到损伤,细胞内离子外流,从而造成菌液中电导率升高[28].然而,细胞内离子外流能引起的电导率变化很小,加之检测手段分辨率不够精确[29],因而,结果中并没有体现出明显的变化规律.
金黄色葡萄球菌是一种常见的食源性致病菌,在生肉、水产及速冻食品中广泛存在[10,30],采用中药抑制金黄色葡萄球菌及其作用机制的研究是目前研究热点之一.抑制金黄色葡萄球菌的途径也不尽相同.紫甘薯花色苷色素可增强细胞膜的通透性,使细胞质稀薄、解体,导致金黄色葡萄球菌死亡[31];五倍子中所含的鞣酸能够使细菌体内的原生质体及蛋白质凝固,从而影响菌体代谢致其死亡[32].在本研究中,菌株C的发酵液可推迟金黄色葡萄球菌的对数生长期,其作用机制极可能是在对数期抑制菌体分裂.同时,引起金黄色葡萄球菌细胞外蛋白水平升高,电导率发生变化,也可能是因为抑菌物质作用于细胞膜,影响细胞结构的完整性以及功能.
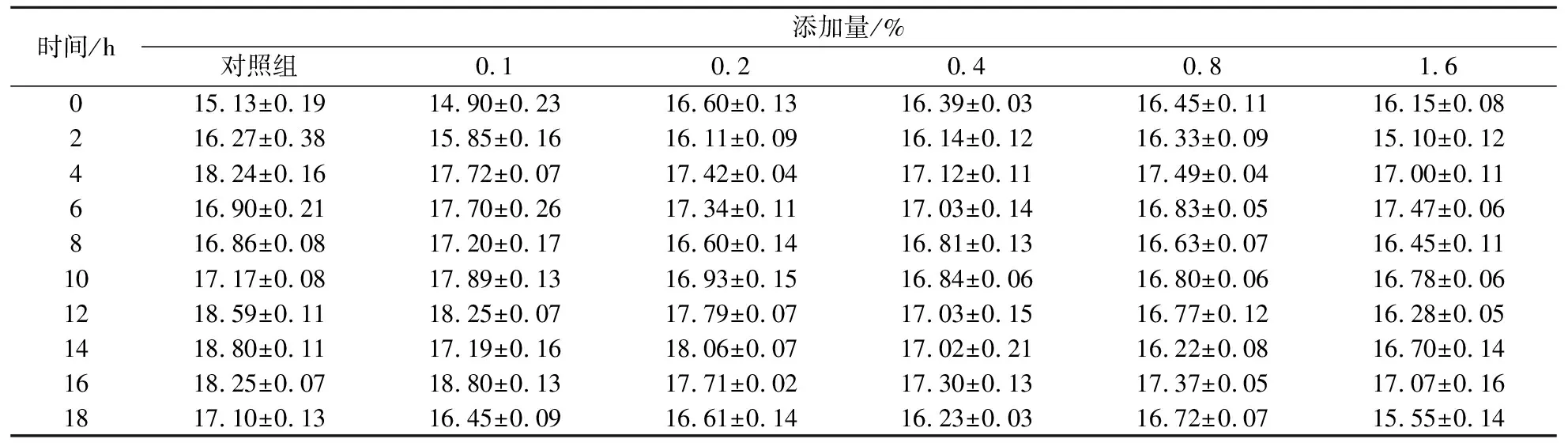
表2 菌株C发酵液对金黄色葡萄球菌发酵液电导率(μs/cm)的影响
3 结论
从乌头侧根中分离到4株真菌,根据ITS序列及形态学初步确定菌株A、B、C、D分别属于Talaromyces(篮状菌属),Penicillium(青霉属),Aspergillus(曲霉属)以及Cladosporium(枝孢霉属).菌株C对金黄色葡萄球菌具有明显抑制作用,其发酵液可推迟金黄色葡萄球菌对数的生长期,促进金黄色葡萄球菌胞外蛋白质含量增加,引起菌悬液电导率变化.因此推测菌株C发酵液可能是通过抑制金黄色葡萄球菌的菌体的分裂增殖和破坏细胞结构进而达到抑菌效果.在后续研究中,对发酵液中抑菌物质种类及结构的解析将是深入开发乌头药用微生物资源的重要研究内容.

