四氯化碳不同条件下复制大鼠肝纤维化模型的比较
梁洁 孟根斯立木 颜羽昕 王昕 金蓉 苏晓丽 马月宏 谢敏琦
试验研究
四氯化碳不同条件下复制大鼠肝纤维化模型的比较
梁洁①孟根斯立木①颜羽昕①王昕①金蓉①苏晓丽①马月宏①*谢敏琦②
(①内蒙古医科大学基础医学院 内蒙古 呼和浩特 010110 ②内蒙古自治区第三医院)
为了探讨四氯化碳在不同条件下建立肝纤维化动物模型的最佳方法,将大鼠分为5组。除正常组外,各组采用不同条件的四氯化碳造模法,每周给药2次。8周后,测定血清谷丙氨酸转氨酶、天门冬氨酸转氨酶和碱性磷酸酶;取肝脏组织作病理阿学相关检查。结果表明,各试验组大鼠均表现出肝纤维化,其中腹腔注射组程度最严重,灌胃2组程度最轻。结论:本研究中不同方法都能成功制作肝纤维化大鼠模型,但肝纤维化程度有所不同并且各有利弊,其中灌胃2组最为理想。
肝纤维化 四氯化碳 疾病模型 大鼠
肝纤维化(Hepatic Fibrosis, HF)是一种慢性肝损伤疾病,主要发病原因有病毒性肝炎、酒精肝、脂肪肝、寄生虫感染、化学毒物感染及自身免疫性疾病等[1-3]。如果长期累积,损伤因素不去除,将会导致肝硬化和肝癌等严重后果,危害人类健康。所以,为了探索制造肝纤维化动物模型的最佳方法,本文比较了几种不同的造模方法,以期筛选出成熟最优秀的肝纤维化造模方案,为研究肝纤维化发病机制以及相关治疗药物打下坚实的基础。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂 高速冷冻离心机、725型紫外分光光度计(岛津UV-2550)、电子分析天平、显微镜(奥林巴斯BX51)、切片机(LEICA SM2010 R)、水合氯醛(批号20141007,天津福晨化学试剂厂)、CCl4(批号20140319,国药集团化学试剂有限公司)、实验前用灭菌精制花生油配成50%浓度、花生油(山东鲁花集团产品)、ALT、AST、AKP测定试剂盒(南京建成生物工程公司产品)。
1.1.2 试验动物 Wistar大鼠40只,雄性,体质量190~220g,8周,清洁级,购于北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。饲养于内蒙古医科大学实验动物中心[SYXK(蒙) 2015-0001],动物自由进食、饮水,饲喂标准颗粒饲料,室温18~22℃,适应性饲养1周后使用。
1.2 试验方法
1.2.1 动物分组及处理

表1 动物分组及处理
1.2.2 样品采集及肝脏病理学检查 试验第8周末禁食不禁水12h后,各组大鼠分别腹腔注射10%水合氯醛麻醉,经腹主动脉取血,静置20min后,4℃ 3500r/min离心10min,分离血清,根据各试剂盒的说明书测定谷丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)和碱性磷酸酶(AKP)的浓度。取1叶肝脏,于4%甲醛溶液中固定,脱水、包蜡、切片及HE和Masson三色染色,光学显微镜下观察。观察肝脏组织结构变化以及炎症反应并进行Ishak肝纤维化程度评分[4]。将各组肝脏标本进行Masson三色染色,选中视野中蓝染区域即纤维组织,使用Image J软件测定视野中肝纤维化病变所占面积。
1.3 统计学处理
使用SPSS 24.0软件进行数据分析。组间比较采用One-Way ANOVA法比较。
2 结果
2.1 大鼠表征
大鼠一般健康状况在一定程度上可以反映造模水平,具有参考价值。A组大鼠健康状况良好,饮食、饮水正常,行动敏捷,体重自然增长,大便成形,毛色有光泽,无死亡,明显优于其他几个试验组。B组大鼠活动减少,有时可见大便不成形,皮毛杂乱,颈后皮肤有溃烂,精神倦怠,试验结束时,死亡1只。C组大鼠精神萎靡,易激怒,大便不成形,饮食饮水显著减少,皮毛杂乱无章,体重先增加不明显,后有所增加,腹部明显鼓胀,推断已经产生腹水,试验结束时,死亡4只。D组大鼠活动减少,精神欠佳,偶尔出现大便不成形,饮食正常、无明显变化,皮毛稍显杂乱,体重稍有增加。E组大鼠精神不佳,活动明显减少,有时易激怒,偶可见大便不成形,饮食减少,皮毛毛躁杂乱,体重稍有增加,试验结束时,死亡1只。
2.2 各组大鼠ALT,AST,AKP的变化
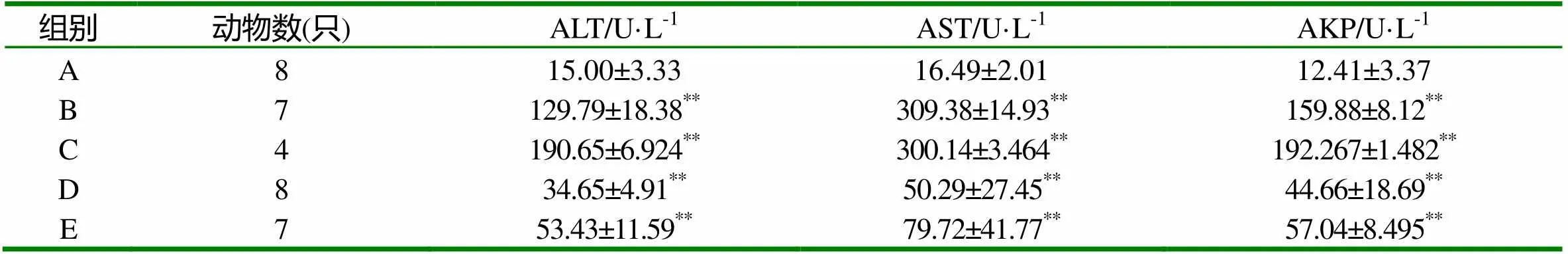
表2 各组大鼠ALT,AST,AKP的变化
注:与正常组A组相比:*P<0.05差异显著,**P<0.01差异极显著。下表类同。
从试验结果可以看出,各试验组血清中酶的含量与A组比都有显著性差异,说明肝脏都有不同程度的损伤。其中C组损伤最严重,B、E组次之,D组相对最轻。
2.3 各组大鼠肝脏外观比较
A组大鼠肝脏颜色鲜红,柔软,光滑,触摸没有颗粒感;其余各组大鼠肝脏颜色均暗淡,C组大鼠甚至呈现黄色,说明肝脏病变严重。除此之外,各试验组大鼠肝脏都较硬,B组大鼠触摸有颗粒感,C组大鼠变硬且坏死严重,D、E组大鼠肝脏有不同程度的变硬。
2.4 各组大鼠肝脏组织病理学切片观察
从HE、Masson染色病理组织中可以看出,A组大鼠肝小叶结构完整,肝细胞排列整齐,胞浆均匀,未见变性坏死、炎症细胞浸润、纤维组织增生。其余各组均有不同程度的大鼠肝小叶结构破坏,肝板排列混乱,炎症细胞浸润,纤维组织增生。此外,B组样本出现大小不一的脂滴;C组样本形成明显的假小叶,肝细胞出现气球样病变;D组样本有大量炎症细胞浸润;E组样本可见明显的桥间连接以及少量假小叶。
2.5 Image J测定肝纤维化病变总面积

附图 各组大鼠肝纤维化病变总面积
Image J软件可以测定Masson染色病理切片中蓝色胶原部分的面积,从而可以检测肝纤维化导致肝脏的病变面积。与正常组大鼠相比,其余各实验组大鼠肝脏病变总面积均有显著性差异,但各实验组大鼠之间比较没有明显差异。但也能从数据看出,C组大鼠病变面积最大,纤维化程度最严重,E组,B组次之,D组大鼠肝纤维化病变总面积相对最少。
2.5 肝纤维化程度Ishak评分结果

表3 各组大鼠Ishak评分结果
Ishak评分系统0分表示无纤维化病变;1分表示部分门管区有纤维增生,有或无短的纤维隔膜;2分表示大多数门管区有纤维增生,有或无短的纤维隔膜,3分表示大多数门管区有纤维增生,偶见门管区以纤维桥连;4分表示门管区纤维增生,同时伴有明显桥连;5分表示有明显的桥连,偶见结节;6分表示可能或明确的肝硬化。A组大鼠全部显示无纤维化病变,其余各组均出现肝纤维化病变。B组大鼠评分在3~5之间,有明显的纤维化,其中个别大鼠程度较严重;C组大鼠纤维化程度严重,甚至有肝硬化出现;D组大鼠评分3~4之间居多,是较理想的肝纤维化模型;E组大鼠肝纤维化程度也较严重,有肝硬化出现。
3 讨论
(1)肝纤维化是肝脏疾病发展过程中的重要节点,正确认识并及时治疗可以有效控制疾病的发展[5]。为了研究疾病的发病机制及治疗药物,必须建立适宜的动物模型。诸多文献[6-9]研究显示,制造肝纤维化动物模型有多种方法,可以分为化学药物诱导法[10-12]、免疫法[13]、胆管堵塞手术法[14]等。其中,化学药物诱导法中四氯化碳诱导法是最经典的一种方法[15],而且造模途径多样。有研究报道,复合因素法可以提高肝纤维化模型的成功率,同时减短造模周期[16, 17];腹腔注射法成模率高,造模周期短,但动物死亡率也高[18];灌胃法操作简单,动物耐受性好,但造模周期长,成模较困难[19]。所以,本文比较了不同方法的利弊。同时,目前临床对于肝纤维化的检测并没有特异性的诊断方法[20],一般通过检测肝功能三项,即谷丙转氨酶、谷草转氨酶、碱性磷酸酶的浓度来判断肝细胞的损伤情况;此外肝纤维四项,即透明质酸、Ⅲ型前胶原、层黏连蛋白、IV型胶原,在一定程度上也可以反映肝纤维化程度;较准确的方法是通过肝脏组织切片来推断肝纤维化进程。本实验通过记录大鼠一般生理状况,检测血清肝功三项指标,临床上常使用检测血清中酶的变化来反映肝脏的功能以判断肝脏的损伤程度,所以本试验也选取了这一指标。肝脏损伤伴随肝细胞的变性坏死、破裂,进而使存在于细胞内的酶进入到血清中,通过测定血清中酶的含量可以反应肝细胞受损情况及损伤程度。观察大鼠肝脏大体形态,制作HE、Masson染色病理切片并评分、计算来判断大鼠肝纤维化程度,并总结实验过程中出现的重点及难点问题来初步判断几种模型的优势和劣势。(2)B组复合因素皮下注射造模法皮下注射方法比较简单,形成肝纤维化时间较短,但皮下注射易导致大鼠皮肤溃烂,应采用碘酒消毒以防皮肤损伤;同时,高脂乳剂灌胃较难操作,大鼠易呛,易致死,所以需要避免一次性给药,应该少量多次,这一点造成工作量增加;此外,从病理切片看,该组大鼠肝组织多有脂滴出现,有形成脂肪肝的倾向,导致肝纤维化造模不够准确。(3)C组腹腔注射形成肝纤维化时间短,成功率高,但对大鼠伤害较大。大鼠在腹腔注射后有长时间的激怒状态,易造成大鼠之间互相攻击,导致不必要的伤害。同时,大鼠精神萎靡,饮食饮水均减少,死亡率也随之升高。此外,从病理切片来看,腹腔注射造模法容易造成肝纤维化程度变重,甚至有肝硬化的发生,所以应该酌情减少造模时间来控制病情程度。(4)D组、E组灌胃法优点在于CCL4可直接经门静脉到达肝,一般在1.5h左右肝内即可达最高水平。同时操作简单,大鼠耐受性较好,伤害小,死亡率低。但成模时间长,容易逆转。同时剂量和时间不易把握,可能出现造模过轻或过重的情况。采用首剂加倍来制备模型,随时观察大鼠反应,调整给药剂量及时间,能够更好地提高造模成功率。
4 结论
本试验设计的D组,即使用50%CCl4以2ml/kg灌胃,连续8周制作的肝纤维模型效果最好,纤维化程度较符合要求,操作过程简便,对大鼠的损伤较小,可以作为制作肝纤维化模型的一种常用方法;而B组在实验过程中应用高脂乳剂,有些大鼠出现了脂肪肝的倾向,而且高脂乳剂在灌胃时较困难,不容易灌入,易溢出,此类造模方法更适用于因脂肪肝造成的肝纤维化疾病的模拟;C组肝纤维化程度重,腹腔注射刺激性大,大鼠耐受性不好,注射后有较长一段时间大鼠处于应激易怒状态,更适用于肝硬化的造模;E组肝纤维化程度较C组轻,但较D组重,合理把握、适当减少灌胃周期,或许也能成为另一种制作肝纤维化模型的可行方法。
[1] Lachenmeier DW, Monakhova YB, Rehm J. Influence of unrecorded alcohol consumption on liver cirrhosis mortality[J]. World J Gastroenterol, 2014, 20(23): 7217-7222.
[2] Lin J, Wu J F, Zhang Q, et al. Virus-related liver cirrhosis: Molecular basis and therapeutic options[J]. World J Gastroenterol, 2014, 20(21): 6457-6469.
[3] Okazaki I, Noro T, Tsutsui N, et al. Fibrogenesis and Carcinogenesis in Nonalcoholic Steatohepatitis (NASH): Involvement of Matrix Meta- lloproteinases (MMPs) and Tissue Inhibitors of Metalloproteinase (TIMPs)[J]. Cancers (Basel), 2014, 6(3): 1220-1255.
[4] Kamal Ishak, Amelia Baptista, Leonardo Bianchi, et al. Histological grading and staging of chronic hepatitis[J]. Journal of Hepatology, 1995, 22(6): 696-699.
[5] 严何. 肝纤维化的机制及研究进展[J]. 基层医学论坛, 2019(16): 2357-2358.
[6] 黄迪, 古维立, 胡志文等. 大鼠肝纤维化模型建立及肝纤维化的检测[J]. 广州医药, 2012, 43(05): 56-60.
[7] 金俊杰, 钟鸣, 余胜民等. 四氯化碳致肝纤维化大鼠模型药理实验方法学研究[J]. 时珍国医国药, 2012, 23(07): 1659-1661.
[8] 孙侠, 黄小琼, 钟海潮等. 四氯化碳、酒精与四氯化碳联合、胆管结扎致SD大鼠肝纤维化病理学比较[J]. 中国比较医学杂志, 2012, 22(03): 36-39+82.
[9] 邝胜利, 胡兵. 肝纤维化大鼠模型研究进展[J]. 实验动物与比较医学, 2008(01): 62-66.
[10] 郑君, 林晓春. 四氯化碳致大鼠肝纤维化模型的建立[J]. 安徽医学, 2014, 35(5): 553-555.
[11] 郭花, 薛挥. 肝硬化动物模型研究进展[J]. 中国比较医学杂志, 2006, 16(8): 449-501.
[12] 耿嘉蔚. 硫代乙酞胺诱导大鼠肝纤维化的研究[J]. 云南医药, 2009, 30(6): 613-615.
[13] 刘秀英. 四氯化碳和猪血清肝纤维化模型组织病理比较[J]. 世界华人消化杂志, 2004, 12(8): 1875-1879.
[14] 陈瑞玲, 马雄. 胆汁淤积导致肝纤维化的机制及其阻断策略[J]. 临床肝胆病杂志, 2019, 35(02): 247-251.
[15] 康玉华, 杨宇, 王宝家, 等. 肝纤维化动物模型的研究进展[J]. 辽宁中医杂志, 2016, 43(10): 2229-2231.
[16] 李志钢, 杨晋翔, 张伟, 等. 肝纤维化实验动物模型的建立与评价[J]. 北京中医药大学学报(中医临床版), 2009, 16(04): 43-46.
[17] 金俊杰, 钟鸣, 余胜民, 等. 四氯化碳致肝纤维化大鼠模型药理实验方法学研究[J]. 时珍国医国药, 2012, 23(07): 1659-1661.
[18] Scholten D, Trebicka J, Liedtke C, et al. The carbon tetrachloride model in mice[J]. Lab Anim, 2015, 49 (1 Suppl) : 4-11.
[19] 魏伟, 吴希美, 李元建. 药理实验方法学(第4版)[M]. 北京: 人民卫生出版社, 2010: 1137-1138+1698.
[20] Nesreen Ishak Mahmoud, Basim Anwar Shehata Messiha, Ali Ahmed Abo-Saif, et al. Inhibition of activated factor X; a new pathway in ameliorating carbon tetrachloride-induced liver fibrosis in rats[J]. Journal of Biochemical and Molecular Toxicology, 2019, 33(5).
国家自然科学基金项目(81560706);内蒙古自然科学基金资助项目(2014MS0841);内蒙古自治区青年创新人才培训计划项目;内蒙古医科大学人才团队项目
S818.9
A
1007-1733(2019)11-0001-04
(2019–08–14)

