猴头菇醇提物乙酸乙酯萃取相组分的分离与鉴定
,*
(1.广东轻工职业技术学院食品与生物技术学院,广东广州 510300;2.华南理工大学食品科学与工程学院,广东广州 510641;3.广东太阳神集团有限公司,广东广州 510665)
猴头菇[Hericiumerincaceus(Bull.:Fr.)Pers],又称猴头蘑、猴头菌、刺猬菌等,属于担子菌纲(Basidiomycetes)、多孔菌目(Polyporales)、齿菌科(Hydnaceae)、猴头属(Hericium)[1],因其子实体圆而厚且与猴子头部相似而得名。猴头菇中含有多肽类、多糖类、萜类、甾醇类、酚类等活性成分,具有抗氧化、降血脂、调节免疫力、抗肿瘤、降胆固醇、保肝等多种生物活性[2-3]。
随着天然产物研究的深入和分离纯化方法的不断改进,已有相关研究报道了从猴头菇中分离纯化得到化合物,并进行了相关的结构鉴定和生物活性评价研究,使得猴头菇中的化学成分数据得到了丰富。例如Kawagishi等[4-6]以猴头菇菌丝体为原料,分离出7种二萜类物质,分别称之为Erinacine A、B、C、D、E、F、G,这种二萜类物质以鸟巢烷型二萜(Cyathane)骨架为基本构型,普遍具有抗菌、抗炎和刺激神经生长因子(NGF)合成等生物活性。Kawagishi等[7]还从猴头菇子实体中分离纯化得到3个酚类物质,并对其进行了结构鉴定以及活性研究,结果发现这些化合物具有较强的促进神经生长因子合成的活性。麻兵继等[8]以猴头菇子实体为原料,利用柱色谱技术从其甲醇浸提物中分离纯化得到11个化合物,其中包含2个甾醇类化合物。Li等[9]从猴头菇子实体中分离得到14种甾醇,包括4种新的甾醇和10种已知的甾醇,而甾醇类化合物具有较好的抗病毒、利尿、抗肿瘤以及保护胃黏膜作用。
本课题组前期的研究结果表明[10],猴头菇醇提物及其不同极性部位萃取物均具有一定的抗氧化活性,其中乙酸乙酯相的抗氧化活性相对较高,对DPPH·、·OH和ABTS+·的清除率分别为41.64%(2.5 mg/mL)、82.84%(2.5 mg/mL)和89.18%(0.5 mg/mL)。由此可见,猴头菇醇提物的乙酸乙酯相萃取组分具有较好的抗氧化活性,具有较好的继续研究价值。但是目前对于猴头菇醇提物及其不同极性部位萃取物中的单体化合物的分离鉴定和活性研究尚缺乏相关数据,对于乙酸乙酯相中的主要功效化合物仍有待进一步研究。而获取这部分研究数据的前提是需要通过相关分离手段获取化合物单体。
基于上述背景,本文以猴头菇子实体为原料,在前期研究[10]的基础上进一步对猴头菇醇提物乙酸乙酯萃取相进行分离鉴定研究,采用硅胶柱层析和半制备HPLC法对其进行分离纯化,将纯化得到的单体化合物进行结构表征和鉴定,为猴头菇中的单体化合物分离以及后续功效实验提供基础数据,以期为猴头菇资源的深度开发和利用提供参考。
1 材料与方法
1.1 材料与仪器
猴头菇子实体 产自吉林省长白山二道白河;氘带甲醇 美国Sigma公司;石油醚、乙酸乙酯、甲醇、香草醛、浓硫酸等试剂 均为分析纯,国药集团化学试剂有限公司。
ZF-90D暗箱式紫外分析仪 上海光豪分析仪器有限公司;BSZ-160F电脑自动部份收集器 上海精科实业有限公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;岛津LC-20AB分析型高效液相色谱仪 日本岛津公司;岛津LC-20AR半制备型高效液相色谱仪 日本岛津公司;Esquire HCT PLUS质谱仪 德国Bruker公司;AVANCE-III HD600超导核磁共振波谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 猴头菇醇提物乙酸乙酯萃取相的制备 参考黄越等[10]的方法并稍作改动,按如下流程制备猴头菇醇提物及其乙酸乙酯萃取组分。具体制备方法如下:
猴头菇醇提物制备流程:将猴头菇子实体切成小块,然后置于50 ℃下干燥16 h,期间不断翻动以保证干燥均匀,称取一定量干燥至恒重的猴头菇子实体干粉,按以下工艺制备猴头菇醇提物:乙醇浓度50%,料液比1∶15 g/mL,提取温度50 ℃,提取时间5 h,提取2次,合并2次提取液,在3000 r/min转速下离心10 min,收集上清液并在45 ℃条件下旋蒸浓缩2~3 h,直至不再有液体旋出,获得猴头菇醇提物。
猴头菇醇提物乙酸乙酯萃取相的制备流程:将猴头菇醇提物与少量蒸馏水进行混合,振荡均匀后形成水悬浮液。分级萃取时选取的有机溶剂依次为石油醚、乙酸乙酯,石油醚萃取操作时按1∶1 (V/V)与水悬浮液进行混合,振荡10 min后静置进行萃取,收集石油醚相,剩余相再次用石油醚萃取,重复2次,共萃取3次。剩余水相用乙酸乙酯萃取3次,收集得到猴头菇醇提物乙酸乙酯相,在45 ℃条件下旋蒸浓缩2~3 h,直至不再有液体旋出,置于-20 ℃下储存。
1.2.2 猴头菇醇提物乙酸乙酯萃取相的粗分离 采用硅胶柱层析法对猴头菇醇提物乙酸乙酯萃取相进行粗分离,选用规格为Φ6.0 cm×60 cm的层析柱,采用柱层析用硅胶(100~200目)进行湿法装柱。取猴头菇醇提物乙酸乙酯萃取相组分30 g,用适量乙酸乙酯将其完全溶解,加入样品重量1.5倍的硅胶(100~200目)充分搅拌均匀。在旋转蒸发器里于45 ℃条件下旋干混匀,进行干法上样。
根据乙酸乙酯相TLC显色结果确定洗脱剂系统组成。依次采用纯石油醚、不同石油醚与乙酸乙酯混合比例(99∶1、98∶2、95∶5、90∶10、80∶20和50∶50,V/V)、纯乙酸乙酯、不同乙酸乙酯与甲醇混合比例(19∶1、9∶1和1∶1,V/V)、纯甲醇一系列溶剂系统进行梯度洗脱,每种洗脱剂用量均为3500 mL。等量逐份收集洗脱液,用250 mL锥形瓶进行收集,每200 mL收集一次,一共得到A1~A210共210个组分。用毛细管将得到的210个组分快速准确地点样于GF-254薄层硅胶板上,吹干,用适当的展开剂展开,然后取出吹干,再使用紫外灯、碘和香草醛-硫酸显色剂进行显色。观察各个斑点的相对比移值(Rf),对比分析,将相似组分合并进行再分离纯化。通过TLC显色结果分析,将A36~A81合并作为组分C1,A82~A91合并作为组分C2,A92~A106合并作为组分C3,A107~A115合并作为组分C4,A116~A128合并作为组分C5,A129~A136合并作为组分C6,A137~A143合并作为组分C7,A145~A168合并作为组分C8,A169~A185合并作为组分C9,A186~A210合并作为组分C10。将组分C1~C10在45 ℃条件下旋蒸浓缩3~5 h,直至不再有液体旋出,得到组分C1~C10,以待后续进行分离纯化。
1.2.3 猴头菇醇提物乙酸乙酯萃取相的细分离
1.2.3.1 组分C6的分离纯化 硅胶柱层析对组分C6的分离:选用规格为Φ2.6 cm×80 cm的层析柱,用200~300目柱层析用硅胶进行湿法装柱。称取2.0 g样品,进行干法上样,依次用不同混合比例的石油醚与乙酸乙酯混合比例(10∶1、8∶1、5∶1和1∶1,V/V)、纯乙酸乙酯、不同乙酸乙酯与甲醇混合比例(5∶1和5∶4,V/V)一系列溶剂系统进行梯度洗脱,每种洗脱剂用量均为750 mL。等量逐份依次收集洗脱液,通过TLC显色结果分析,合并相似组分,并在45 ℃条件下旋蒸浓缩20~50 min,得到4个组分C6-1、C6-2、C6-3和C6-4。
半制备型HPLC对组分C6-2的分离:称取800 mg组分C6-2充分溶于甲醇,过0.45 μm有机滤膜,采用以下条件进行分析与制备。HPLC条件:分析型色谱柱:岛津C18柱(5 μm,4.6 mm×150 mm);流速:1 mL/min;检测波长:254 nm;进样量:10 μL;分析时间:50 min,采用梯度洗脱分析。半制备HPLC条件:半制备型色谱柱:LC spherical-C18柱(7 μm,20 mm×300 mm);流速:8 mL/min;检测波长:254 nm;进样量:1 mL;分析时间:80 min,使用梯度洗脱程序进行分离操作,洗脱程序如表1所示。

表1 组分C6-2的半制备HPLC梯度洗脱程序Table 1 Gradient elution conditions for fractionC6-2 with semi-preparative HPLC
1.2.3.2组分C7的分离纯化 采用硅胶柱层析对组分C7进行分离,选用规格为Φ1.5 cm×80 cm的层析柱,用200~300目柱层析用硅胶进行湿法装柱。称取1.0 g样品进行干法上样。采用不同石油醚与乙酸乙酯混合比例(5∶1、4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶5和1∶9,V/V)、纯乙酸乙酯、不同乙酸乙酯与甲醇混合比例(95∶2、90∶5、90∶10和1∶1,V/V)和纯甲醇一系列溶剂系统进行梯度洗脱,每种洗脱剂用量均为250 mL。用电脑自动部分收集器等量逐份收集洗脱液,经TLC检测分析,合并相似组分,并在45 ℃条件下旋蒸浓缩1~2 h,直至不再有液体旋出,得到8个组分C7-1、C7-2、C7-3、C7-4、C7-5、C7-6、C7-7、C7-8。
硅胶柱层析对组分C7-3的分离:选用规格为Φ 1.5 cm×80 cm的层析柱,用200~300目柱层析用硅胶进行湿法装柱。将组分C7-3(0.128 g)进行干法上样。依次用不同石油醚与乙酸乙酯混合比例(1∶4.5、1∶5、1∶7和1∶9,V/V)和纯乙酸乙酯一系列溶剂系统进行梯度洗脱,每种洗脱剂用量均为100 mL。用电脑自动部分收集器等量逐份收集洗脱液,经TLC检测分析,合并相似组分。并在45 ℃条件下旋蒸浓缩20~50 min,得到3个组分C7-3-1、C7-3-2和C7-3-3。
1.2.3.3组分C8的分离纯化 称取组分C8共2.0 g充分溶解于甲醇中,过0.45 μm有机滤膜,采用以下条件进行分析与制备。
分析HPLC条件:分析型色谱柱:岛津C18柱(5 μm,4.6 mm×150 mm);流速:1 mL/min;检测波长:254 nm;进样量:10 μL;分析时间:50 min,采用梯度洗脱程序进行分离操作。
半制备HPLC条件:半制备型色谱柱:LC spherical-C18柱(7 μm,20 mm×300 mm);流速:8 mL/min;检测波长:254 nm;进样量:1 mL;分析时间:80 min,采用梯度洗脱程序进行分离,洗脱程序如表2所示。
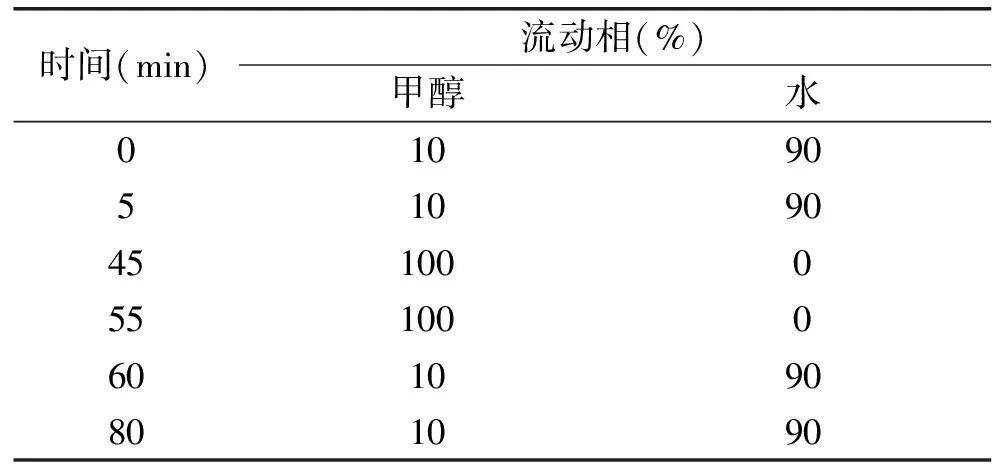
表2 组分C8的半制备HPLC梯度洗脱程序Table 2 Gradient elution conditions for fraction C8with semi-preparative HPLC
1.2.4 化合物的结构鉴定与分析
1.2.4.1 质谱分析(ESI-MS) 各取少量化合物H1、H2、H3、H4、H5,分别用色谱纯甲醇进行充分溶解,通过Esquire HCT PLUS型大容量离子阱对其进行质谱分析,采用正、负离子扫描模式[11],雾化气和干燥气为高纯氮气,喷雾气压力5 psi,干燥气流速为4.0 L/min,干燥气温度为180 ℃,毛细管电压为3000 V,扫描范围为质荷比50~1000 (m/z)。
1.2.4.2 核磁共振分析(NMR) 分别称取一定量化合物H1、H2、H3、H4、H5,使用氘带甲醇进行溶解[12],置于核磁管中,用AVANCE-III HD600超导核磁共振波谱仪进行测定,以四甲基硅烷(TMS)作内标,化学位移δ和偶合常数J分别采用ppm以及Hz表示,1H-NMR以及13C-NMR的工作频率分别为600、151 MHz。
2 结果与分析
2.1 猴头菇醇提物乙酸乙酯萃取相的粗分离结果
猴头菇醇提物乙酸乙酯萃取相经梯度洗脱、等量逐份收集洗脱液、TLC显色分析合并,以及旋转蒸发分别得到组分C1~C10,其中C1共7.68 g,C2共0.167 g,C3共1.2 g,C4共2.98 g,C5共3.18 g,C6共2.41 g,C7共1.28 g,C8共4.94 g,C9共2.88 g,C10共1.06 g。
其中组分C2为无色油状物,经TLC检测分析为单一化合物,因此标记为化合物H1(167 mg)。组分C6、组分C7以及组分C8经HPLC分析,相对较易分离得到单一化合物,其他组分所含物质种类复杂,分离难度大,因此选择组分C6、组分C7以及组分C8进行后续分离纯化。
2.2 猴头菇醇提物乙酸乙酯萃取相的细分离结果
2.2.1 组分C6的分离纯化结果 组分C6经梯度洗脱,得到4个组分C6-1、C6-2、C6-3和C6-4,经TLC检测分析,组分C6-2(0.915 g)可以得到有效分离,因此对组分C6-2进一步采用半制备型HPLC进行分离纯化。
组分C6-2的半制备HPLC分离谱图如图1所示,根据HPLC分析结果,保留时间为35.011~39.538 min的化合物为单一化合物,因此对其进行收集,并在45 ℃条件下旋蒸浓缩30 min,得到无色针状结晶,标记为化合物H2(23.1 mg)。

图1 组分C6-2的半制备HPLC分离谱图Fig.1 The semi-preparative HPLCchromatogram for fraction C6-2
2.2.2 组分C7的分离纯化结果 组分C7经梯度洗脱,得到8个组分C7-1、C7-2、C7-3、C7-4、C7-5、C7-6、C7-7、C7-8,经TLC检测分析,组分C7-3(128 mg)可以得到有效分离,因此对组分C7-3进一步采用硅胶柱层析进行分离纯化。
组分C7-3经梯度洗脱,得到3个组分C7-3-1、C7-3-2和C7-3-3,其中,组分C7-3-1有白色鳞片状结晶析出,用石油醚反复重结晶后得到白色鳞片状结晶,经TLC检测分析为单一化合物,标记为化合物H3(9.4 mg)。
2.2.3 组分C8的分离纯化结果 组分C8的制备型HPLC分离谱图如图2所示,根据HPLC分析结果,保留时间分别为11.565~14.013 min以及17.576~21.581 min的化合物均为单一化合物,因此对这两部分分别进行收集,并在45 ℃条件下旋蒸浓缩30 min,分别得到白色针状结晶(60.4 mg)以及无色片状结晶(48.3 mg),分别标记为化合物H4和化合物H5。

图2 组分C8的半制备HPLC分离谱图Fig.2 The semi-preparative HPLC chromatogram for fraction C8
2.3 化合物H1~H5的结构鉴定
2.3.1 化合物H1的结构鉴定 化合物H1为无色油状物,由质谱谱图得出ESI-MS(Negative mode):m/z=281[M-H]-,其分子量为282。
化合物H1的1H-NMR谱数据(600 MHZ,CD3OD,TMS):δ5.34(1H,t,J=4.7 Hz)为一个烯氢信号,δ2.27(1H,t,J=7.4 Hz)可能为一个炔烃上的质子信号或者与N、S、C=O、Ar相连的碳上的一个质子信号,δ2.05(1H,dd,J=12.7,6.3 Hz)为与双键相连碳上的质子信号,δ1.61(2H,m),1.31(10H,d,J=17.0 Hz),0.94~0.86(2H,m)为饱和碳上的质子信号;化合物H1的13C-NMR谱数据(151 MHZ,CD3OD,TMS):δ176.29处的碳信号提示分子中含有一个羧基,δ129.46,127.69与1H-NMR谱中提供的双键信息相对应,δ33.56,31.67,29.92~27.46,26.71,24.70,22.33,13.04。
据上述数据分析,并与标准图谱以及刘天行等[13]报道的油酸谱图数据基本吻合,由此确定化合物H1为油酸(Oleic acid),分子式为C18H34O2,结构式如图3。
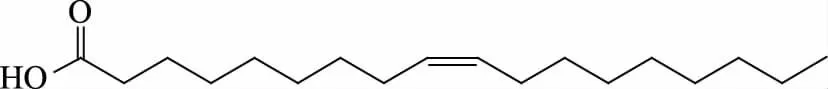
图3 化合物H1的化学结构式Fig.3 Chemical structure of compound H1
2.3.2 化合物H2的结构鉴定 化合物H2为无色针状结晶,由质谱谱图得出ESI-MS(Negative mode):m/z=329[M-H]-,分子量为330。
化合物H2的1H-NMR谱数据(600 MHZ,CD3OD,TMS):δ6.89(s,1H)提示分子中存在芳香基团,δ6.13(1H,s)可能为一个双键碳或者芳香基团碳上的质子信号,δ3.88(3H,s)可能为-OCH3中的质子信号,δ2.83(1H,d,J=13.8 Hz),2.72(2H,t,J=6.7 Hz),2.63(1H,d,J=13.8 Hz),1.87(3H,m),1.86(3H,s)可能为饱和碳上或者三键碳上的质子信号,δ2.12(3H,d)可能为与三键或者双键碳相连碳上的质子信号,δ1.4(3H,s)为饱和碳上的质子信号;化合物H2的13C-NMR谱数据(151 MHZ,CD3OD,TMS):δ198.94提示分子中存在烯丙氧基结构,δ172.6,158.74为羰基碳的信号特征,δ155.81,148.82,131.10,124.88,124.72,114.17,95.34为双键碳信号,δ75.82,68.27,54.93为-O-CH2中的碳信号,δ51.52,30.51为饱和碳信号,δ26.33,23.68,19.48,16.93为与双键相邻的碳信号。据上述数据分析,并与Ueda K等[14]报道的从猴头菇中提取得到的异苯并呋喃酮衍生物Hericenone I的谱图数据基本吻合,由此确定化合物H2为Hericenone I,分子式为C19H22O5,结构式如图4。
Ma等[15]在对猴头菇中具有细胞毒性的芳香化合物研究过程中,分离得到了Hericenone I,研究表明,Hericenone I对人食管癌EC109细胞具有一定的细胞毒性,在浓度为1×10-3mol/L时,其对EC109细胞生长抑制率为65.34%,这可能是因为其具有与霉酚酸相近的结构。
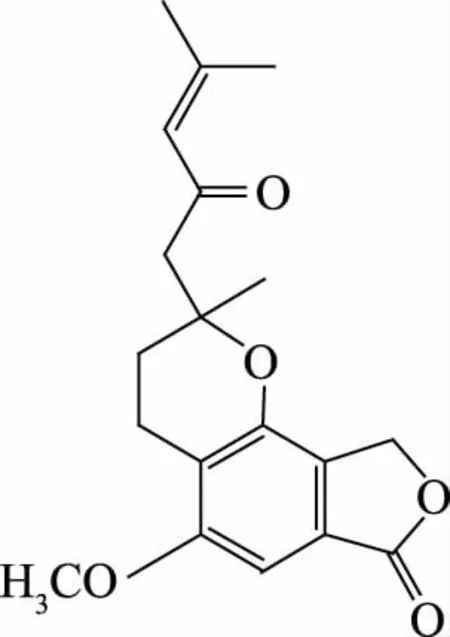
图4 化合物H2的化学结构式Fig.4 Chemical structure of compound H2
2.3.3 化合物H3的结构鉴定 化合物H3为白色鳞片状结晶,由质谱谱图得出ESI-MS(Positive mode):m/z=587[2M+Na]+,其分子量为282。
化合物H3的1H-NMR谱数据(600 MHZ,CD3OD,TMS):δ1.29(54H,s,27CH2),0.89(6H,t,J=4.45 Hz,2CH3)均为烷烃上的质子信号;化合物H3的13C-NMR谱数据(151 MHZ,CD3OD,TMS):δ31.67,29.07,22.34,13.04。
据上述数据分析,并与标准图谱以及Chen Z等[16]报道的正二十九烷的谱图数据基本吻合,由此确定化合物H3为正二十九烷(n-Nonacosane),分子式为C29H60,结构式如图5。
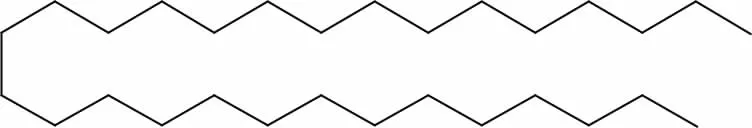
图5 化合物H3的化学结构式Fig.5 Chemical structure of compound H3
陈宇[17]在对小刺猴头菌的子实体和发酵液中的化学成分进行分析时也发现猴头菇子实体中含有正二十九烷。与本研究结果一致。
2.3.4 化合物H4的结构鉴定 化合物H4为白色针状结晶,由质谱谱图得出ESI-MS(Negative mode):m/z=243[M-H]-,其分子量为244。
化合物H4的1H-NMR谱数据(600 MHZ,CD3OD,TMS):δ8.00(1H,d,J=8.1 Hz)为一个烯氢信号,δ5.90(1H,d,J=4.7 Hz),5.70(1H,d,J=8.1 Hz)可能为烯氢信号或者酰胺键中与N相连的质子信号,δ4.27(2H,d,J=7.7 Hz),4.26(1H,d,J=7.8 Hz),4.15(1H,s,J=5.1 Hz)可能为烯氢信号或者羟基上的质子信号,δ3.87(1H,dd,J=9.6,7.1 Hz),3.83(2H,d,J=12.3,2.4 Hz),3.75(3H,m)。化合物H4的13C-NMR谱数据(151 MHZ,CD3OD,TMS):δ164.79,151.09处的碳信号为羰基碳的信号特征,δ141.35,102.70,101.33为双键碳信号,与1H-NMR谱中的烯氢信号相对应,δ89.38,84.97,69.91,60.92为-O-CH2-中的碳信号。
据上述分析,并与标准图谱以及Mantsch H H等[18]报道的尿苷的谱图数据基本吻合,由此确定化合物H4为尿苷(Uridine),分子式为C9H12N2O6,结构式如图6。
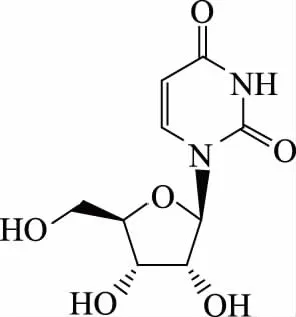
图6 化合物H4的化学结构式Fig.6 Chemical structure of compound H4
尿苷是一种核苷,其具有治疗多种疾病的潜在作用。张珂等[19]研究发现,短期使用尿苷可以阻止一些药物引起的脂肪肝,但长期使用会加剧脂肪肝的形成。此外,尿苷还可作为抗病毒抗肿瘤药物的中间体[20],具有极其重要的医药价值,已广泛应用于医药行业。
2.3.5 化合物H5的结构鉴定 化合物H5为无色片状结晶,由质谱谱图得出ESI-MS(Negative mode):m/z=351[M+Cl]-,分子量为316。
化合物H5的1H-NMR谱数据(600 MHZ,CD3OD,TMS):δ7.96(1H,d,J=1.1 Hz),6.31(1H,d,J=16.6 Hz)为烯烃或者芳烃上的质子信号,δ5.57(s,2H),5.39(t,1H,J=7.2 Hz),5.25(t,1H,J=6.9 Hz)为烯氢信号指示,δ3.82(s,3H),δ3.46(d,2H,J=7.2 Hz)为与O或者卤素相连饱和碳上的质子信号,δ2.34(m,2H)可能为一个炔烃上的质子或者与N、S、C=O、-Ar相连的碳上的一个质子信号,δ1.93(m,2H),1.78(s,3H),1.62(s,3H),1.30(s,3H)为-C=C-CH或者-C≡C-CH质子信号;化合物H5的13C-NMR谱数据(151 MHZ,CD3OD,TMS):δ172.84,166.42为羰基碳的碳信号,δ152.88,145.06,135.06,132.55,124.54,123.31,116.01,103.62,96.27为双键碳信号特征,δ71.56,56.78为-O-CH2-中的碳信号特征,δ39.39,27.31,25.22,21.65,17.80,16.04。
据上述数据分析,并与Ueda K等[14]、Cordes J等[21]报道的从猴头菇中提取得到的异苯并呋喃酮衍生物Hericenone J的谱图数据基本吻合,由此确定化合物H5为Hericenone J,其分子式为C19H24O4,结构式如图7。
Hericenone J为猴头菇子实体的次生代谢产物,属于异苯并呋喃酮衍生物,研究表明其具有一定的刺激内源性神经生长因子(NGF)表达的活性[21]。

图7 化合物H5的化学结构式Fig.7 Chemical structure of compound H5
3 结论
猴头菇中富含多种生物活性成分,从其子实体乙醇提取物的乙酸乙酯萃取相中提出分离并鉴定出油酸、Hericenone I、正二十九烷、尿苷、Hericenone J。其中Hericenone I与Hericenone J为猴头菇子实体的次生代谢产物,属于异苯并呋喃酮衍生物,据报道它们均有一定的刺激内源性神经生长因子(NGF)表达的活性[21],Hericenone I还被证实对人食管癌EC109细胞具有一定的细胞毒性[15],这可能是因为其具有与霉酚酸相近的结构,这些都显示了其作为猴头菇活性成分的功能活性及作为功能性食品开发应用的意义和潜力。尿苷是一种核苷,具有治疗多种疾病的潜在作用,如可阻止脂肪肝[19]以及作为抗病毒抗肿瘤药物的中间体[20],具有极其重要的医药价值。本文为猴头菇活性成分的研究提供了理论依据,对其开发及应用有重要意义。

