撒坝猪MCUR1基因克隆、生物信息学分析及其组织表达量检测
董新星,李明丽,崔艺佳,兰国湘,王孝义,严达伟
(云南农业大学 动物科学技术学院,云南 昆明 650201)
Baughman等[1]和De Stefani等[2]两个研究团队发现线粒体钙单向转运体(mitochondrial calcium uniporter,MCU)位于线粒体内膜上,是钙离子通道的一个主要成分。研究表明:线粒体内钙离子的稳态在细胞生理学中起着重要作用[3]。而单向转运复合体的调节因子是决定线粒体钙稳态的关键[4]。近几年一些线粒体钙离子单向转运体的调节分子如MCUR1(mithondrial calcium uniporter regulator 1)、MICU1(mitohondrial calcium uptake 1)等陆续被鉴定出来,其中MCUR1又被称为CCDC90A,能够通过与MCU相互作用调节线粒体对钙的摄取[5-6]。一旦MCUR1表达缺失,MCU将无法维持正常线粒体的钙离子水平,将会打破线粒体稳态,从而引起疾病的发生。有研究表明,MCUR1基因上调导致线粒体钙稳态改变可能是引起肿瘤细胞恶性进展的始动因素。该基因可通过抑制肝癌细胞凋亡,加速肝癌细胞增殖,从而促进肝癌细胞的生长[7]。在MCUR1基因上调引起的线粒体钙稳态重塑中,凋亡相关蛋白p53是促进肝癌细胞生长的重要分子,并且与MCUR1的表达水平呈负相关[8]。当敲降MCUR1基因时可显著促进慢性粒细胞白血病(慢性髓系白血病,chronic myeloid leukemia,CML)细胞系K562细胞的凋亡[9]。
目前,关于猪MCUR1基因的结构和功能的研究尚不清楚,本课题组前期简化基因组结果发现:MCUR1与猪的生长性能存在联系。本研究对撒坝猪MCUR1进行克隆与生物信息学分析,旨在揭示猪MCUR1基因编码区序列的生物信息学特征。运用实时荧光定量PCR技术检测该基因在mRNA水平上的表达规律,丰富MCUR1基因的数据库信息,为今后研究MCUR1基因在撒坝猪生长相关过程中的作用奠定基础。
1 材料与方法
1.1 样品采集
本研究采集撒坝猪的脾脏、胰脏、背脂、肾脏、肺、大脑、肝脏、心脏、背最长肌和大白猪的背最长肌,于-80 ℃保存。
1.2 主要试剂及仪器
2×TaqPCR Master Mix、DNA Marker、RNA提取试剂(Trizol)、cDNA第一链合成试剂盒、实时荧光定量PCR仪、荧光定量试剂SYBR Premix Dimer Eraser。
1.3 引物设计及合成
根据GenBank上公布的猪的MCUR1基因序列(登录号:XM_003128183.4 ),利用Primer Premier 5.0软件设计引物,以ACTIN基因(登录号:NM_001164650.1)作为内参设计扩增引物,引物序列见表1,引物由北京擎科(昆明)生物技术有限公司合成。
1.4 RNA提取与cDNA合成
采用Trizol法分别提取撒坝猪的脾脏、胰脏、背最长肌和背脂等9种组织以及大白猪的背最长肌的RNA,并反转录为cDNA,质控合格后保存备用。
1.5 PCR扩增及克隆
以撒坝猪的肝脏组织样cDNA为模板扩增MCUR1基因的CDS序列。PCR反应体系为25 μL,包含ddH2O 11 μL,2×TaqPCR Master Mix 12.5 μL,上下游引物各0.5 μL(10 μmol·L-1),cDNA模板0.5 μL。PCR反应程序为:94 ℃预变性4 min;然后94 ℃变性30 s,退火30 s,72 ℃延伸30 s,40个循环;于72 ℃后延伸8 min,4 ℃终止反应。退火温度依引物而异。经检测后的PCR扩增产物送至北京擎科(昆明)生物技术有限公司进行序列测定,测序结果经比对拼接后,获得撒坝猪MCUR1基因完整CDS序列。该序列已提交到NCBI网站,获得登录号为:MN254967。
1.6 生物信息学分析软件
采用上述得到的CDS序列,经一系列预测分析获得MCUR1基因的生物学信息。预测项目与软件如表2所示。
1.7 实时荧光定量PCR检测
以撒坝猪不同组织cDNA作为模板,以ACTIN基因为内参,实时荧光定量PCR检测MCUR1基因在不同组织中的表达。取0.2 mL PCR管,配制如下反应体系,每个反转录产物配制3管,反应体系为25 μL∶2×qPCR Mix 12.5 μL,7.5 μmol·L-1上下游引物2.0 μL(表1),cDNA 2.5 μL,RNase-free水 8.0 μL。PCR反应条件为:95 ℃,10 min为模板的预变性阶段;95 ℃,15 s,60 ℃,60 s,共40个循环为模板的扩增阶段,60 ℃→95 ℃,每15 s缓慢升温0.3 ℃,建立熔解曲线阶段。结果用2-△△Ct法进行计算。
2 结果与分析
2.1 撒坝猪MCUR1基因CDS的扩增及克隆
以撒坝猪肝脏组织cDNA为模板对MCUR1基因进行克隆,经1.0%琼脂糖凝胶电泳检测,分别发现长度约582、599、476 bp的3条电泳带(图1),经拼接后,获得1 095 bp的CDS区,与预期的目的条带一致。
2.2 生物信息学分析
2.2.1 撒坝猪MCUR1蛋白理化特性与疏水性分析
表1 引物序列信息
Table1Primer sequences information
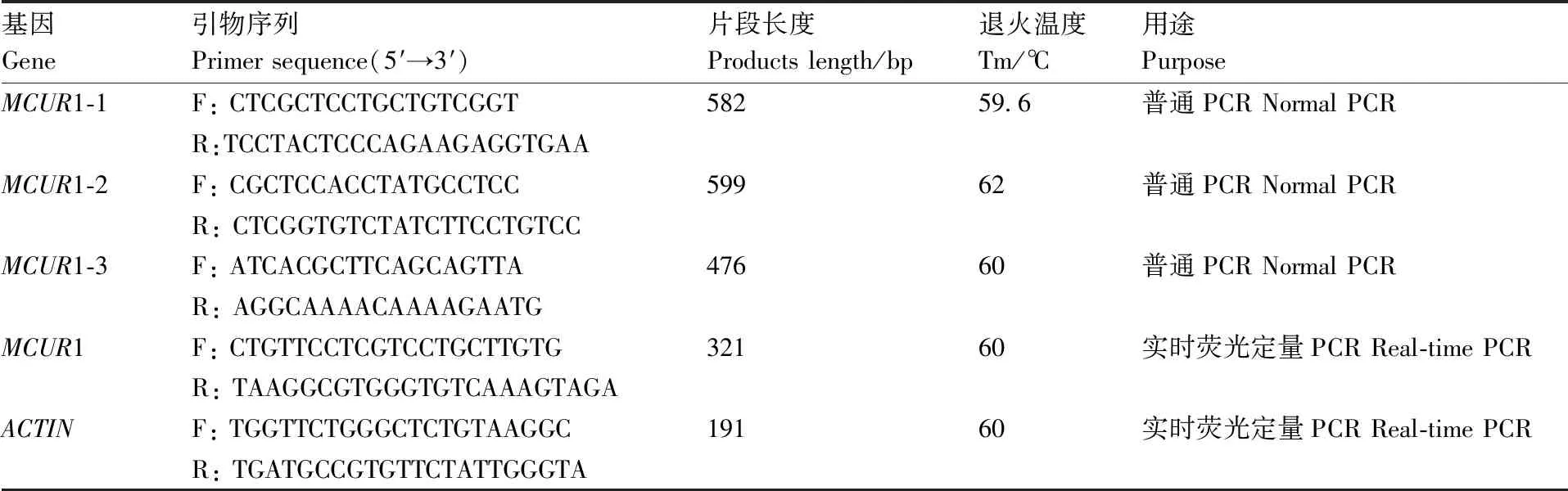
基因Gene引物序列Primer sequence(5′→3′)片段长度Products length/bp退火温度Tm/℃用途PurposeMCUR1-1F: CTCGCTCCTGCTGTCGGT58259.6普通PCR Normal PCRR:TCCTACTCCCAGAAGAGGTGAAMCUR1-2F: CGCTCCACCTATGCCTCC59962普通PCR Normal PCRR: CTCGGTGTCTATCTTCCTGTCCMCUR1-3F: ATCACGCTTCAGCAGTTA47660普通PCR Normal PCRR: AGGCAAAACAAAAGAATGMCUR1F: CTGTTCCTCGTCCTGCTTGTG32160实时荧光定量PCR Real-time PCRR: TAAGGCGTGGGTGTCAAAGTAGAACTINF: TGGTTCTGGGCTCTGTAAGGC19160实时荧光定量PCR Real-time PCRR: TGATGCCGTGTTCTATTGGGTA
表2 生物信息学分析工具
Table2Bioinformatics analysis tools

预测项目Predict subject软件Software网址Website开放阅读框Open reading frameNCBI OFR /蛋白理化性质Physicochemical properties of proteinProtParam https://web.expasy.org/protparam/疏水性分析Hydrophobic analysisProtscale https://web.expasy.org/protscale/信号肽预测Signal peptide predictionSignalP http://www.cbs.dtu.dk/services/SignalP/跨膜区分析Transmembrane analysisTMHMM Server v.2.0http://www.cbs.dtu.dk/services/TMHMM/亚细胞定位Subcellular localizationPsortⅡhttp://www.psort.org/psortb/Coil区分析Coil area analysisCOILS Serverhttps://embnet.vital-it.ch/software/COILS_form.html磷酸化位点Phosphorylation siteNetPhos 3.1 Serverhttp://www.cbs.dtu.dk/services/Net Phos/糖基化位点Glycosylation siteNetNGlyc 1.0http://www.cbs.dtu.dk/services/NetNGlyc/二级结构Secondary structureSOPMAhttps://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html三级结构Tertiary structurePhyre2http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=in-dex进化树The evolutionary treeMEGA6.0/功能结构域Functional structural domainSAMRThttp://smart.embl.de/smart/job_status.pl?jobid=116547588181601533707646MhEAszEcjMCpG Island预测CpG Island predictionCpG Plot http://www.bioon.com.cn/doc/showarticle.asp?newsid=1115
经ORF Finder程序预测显示,撒坝猪MCUR1蛋白编码364个氨基酸(图2)。经ProtParam在线软件预测显示:MCUR1蛋白分子式为C1787H2949N533O503S14,相对分子质量40.398 ku,理论等电点(pI)为10.27,半衰期为30 h,不稳定系数55.70,属于不稳定蛋白,脂肪指数为95.99,平均亲水性为-0.213,属于亲水蛋白。
MCUR1蛋白的氨基酸组成如表3所示:其中含量最高的是丙氨酸(Ala)和精氨酸(Arg),占全部氨基酸的10.2%。
经Protscale程序预测撒坝猪MCUR1蛋白的疏水性,结果如图3:第74位亮氨酸(Leu)疏水性最强(3.067),第15位脯氨酸(Pro)亲水性最强(-2.411)。
2.2.2 撒坝猪MCUR1蛋白信号肽和跨膜结构分析
运用SignalP软件对撒坝猪MCUR1蛋白的信号肽进行预测。由图4可知,S<0.5,表明撒坝猪MCUR1蛋白不存在信号肽。运用TMHMM Server v.2.0对撒坝猪MCUR1蛋白跨膜结构进行分析,预测结果(图5)表明,MCUR1蛋白不存在跨膜结构。
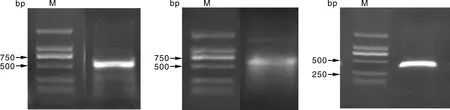
图1 撒坝猪MCUR1基因PCR扩增结果Fig.1 Result of the PCR amplicons MCUR1 gene in Saba pigs
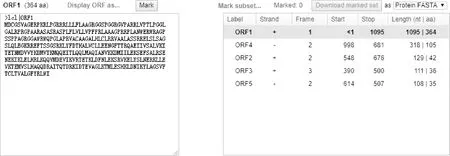
图2 MCUR1基因ORF分析Fig.2 ORF analysis of MCUR1 gene sequence
表3MCUR1蛋白的氨基酸组成
Table3Amino acid composition of MCUR1 protein

氨基酸Amino acids个数Number占比Percentage%氨基酸Amino acids个数Number占比Percentage/%Ala (A)3710.2Arg (R)3710.2Asn (N)82.2Asp (D)113.0Cys (C)51.4Gln (Q)133.6Glu (E)246.6Gly (G)277.4His (H)51.4Ile (I)133.6Leu (L)5013.7Lys (K)226.0Met (M)92.5Phe (F)102.7Pro (P)184.9Ser (S)246.6Thr (T)184.9Trp (W)51.4Tyr (Y)51.4Val (V)236.3
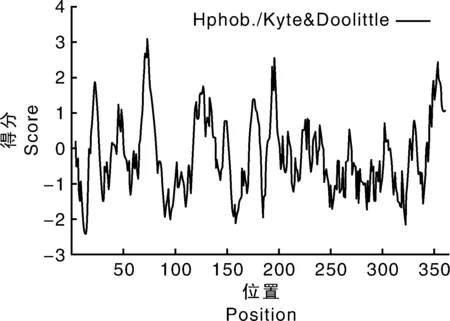
图3 撒坝猪MCUR1蛋白质疏水性预测结果Fig.3 The hydrophobicity profile of MCUR1 in pigs analyzed by Prot Scale in Saba pig
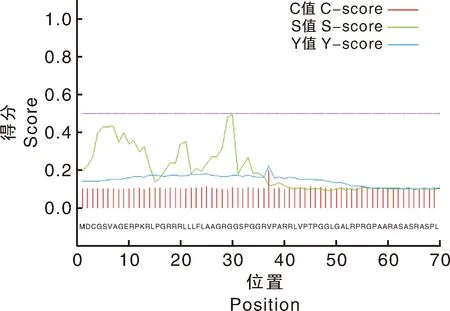
图4 撒坝猪MCUR1蛋白信号肽预测Fig.4 Prediction of MCUR1 protein signal peptide in Saba pig
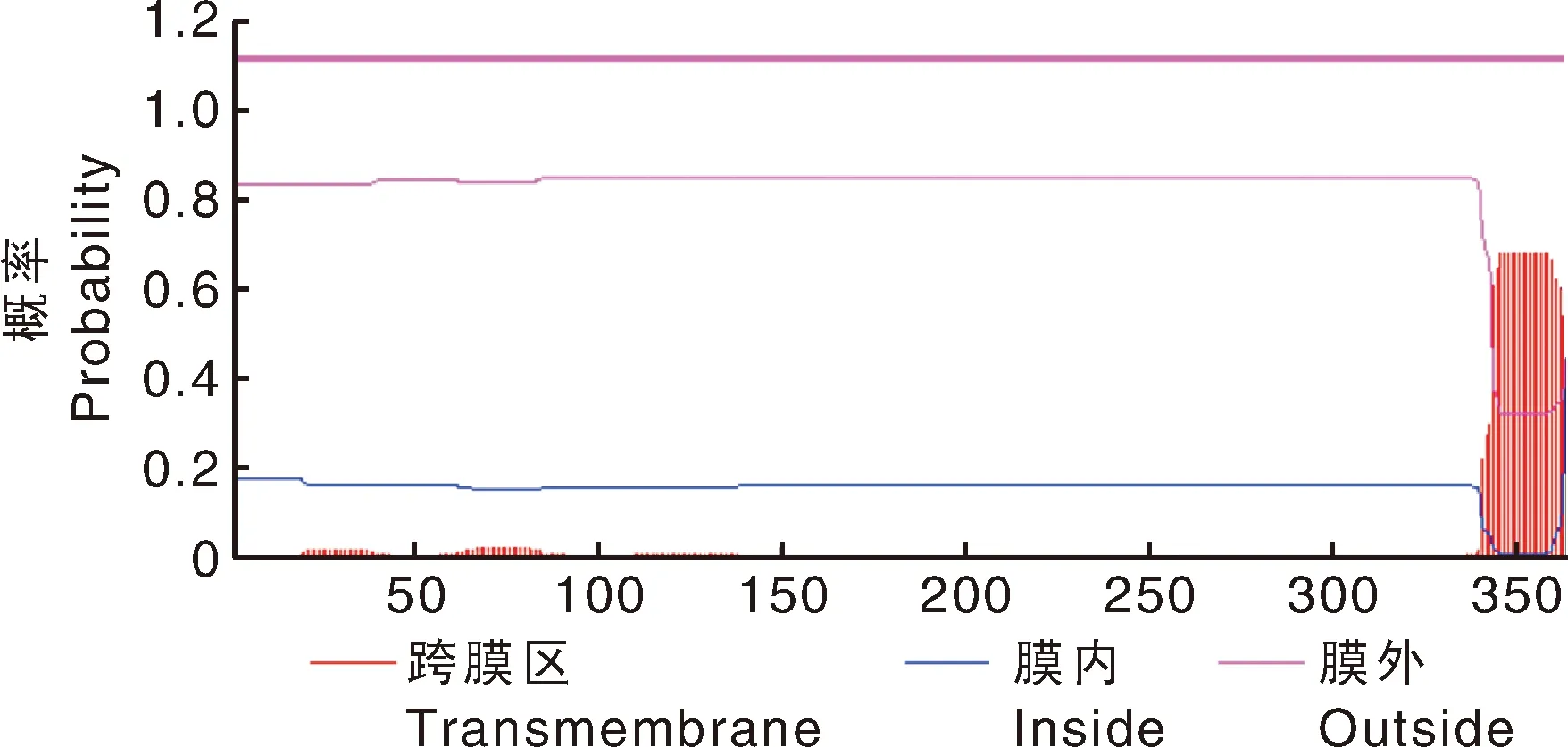
图5 撒坝猪MCUR1蛋白的跨膜区分析结果Fig.5 Transmembrane analysis of MCUR1 protein in Saba pigs
2.2.3 撒坝猪MCUR1蛋白亚细胞定位
通过在线软件PsortⅡ分析预测猪MCUR1基因编码蛋白的亚细胞定位,结果如表4:该蛋白主要分布在细胞质,其次为细胞质膜,在细胞壁和胞外少量分布。因此,可以推断出撒坝猪MCUR1蛋白主要在细胞质中发挥作用。
2.2.4 撒坝猪MCUR1蛋白卷曲螺旋预测与分析
通过COILS Server软件预测撒坝猪MCUR1蛋白的卷曲结构的结果如图6:MCUR1蛋白含有2个典型的卷曲螺旋结构。
2.2.5 撒坝猪MCUR1蛋白糖基化位点、磷酸化位点预测
运用 NetNGlyc 1.0 预测撒坝猪MCUR1蛋白N糖基化位点(图7),发现MCUR1蛋白没有糖基化位点。运用NetPhos 3.1 Server 在线软件预测MCUR1编码蛋白磷酸化位点,结果如图8所示:当潜在磷酸化位点的阈值为0.5时,MCUR1蛋白存在32个潜在的磷酸化位点,其中包含20个丝氨酸(Ser)位点、10个苏氨酸(Thr)位点、2个酪氨酸(Tyr)位点。在撒坝猪MCUR1蛋白上可能有unsp、PKC、CaM-II、GSK3等15种保守的蛋白激酶结合位点,在102、141处unsp分值最高,为0.991。
2.2.6 撒坝猪MCUR1蛋白二级结构与三级结构预测
采用ExPAsY的SOPMA程序预测撒坝猪MCUR1蛋白的二级结构如图9所示:MCUR1蛋白α-螺旋区域有212个氨基酸,占58.24%,β-转角区域有15个氨基酸,占4.12%,无规则卷曲区域有110个氨基酸,占30.22%,延伸链区域有27个氨基酸,占7.42%。采用Phyre2对MCUR1蛋白同源建模获得三级结构模型,撒坝猪的MCUR1蛋白经折叠、弯曲等一系列过程形成如图10所示的三级结构。
表4 撒坝猪MCUR1蛋白亚细胞定位分值
Table4Location score of MCUR1 protein in Saba pigs

位置Position分值Score细胞质Cytoplasm7.50细胞质膜Cytoplasmic membrane1.15细胞壁Cell wall0.62胞外Extracellular0.73
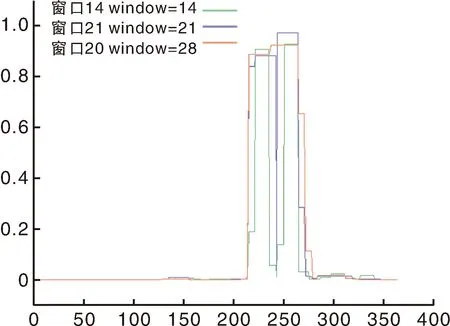
图6 撒坝猪MCUR1蛋白卷曲螺旋预测结果Fig.6 Predicting results of MCUR1 protein crimp in Saba pigs

图7 撒坝猪MCUR1蛋白的N-糖基化位点预测Fig.7 N-glycosylation sites of MCUR1 in Saba pigs
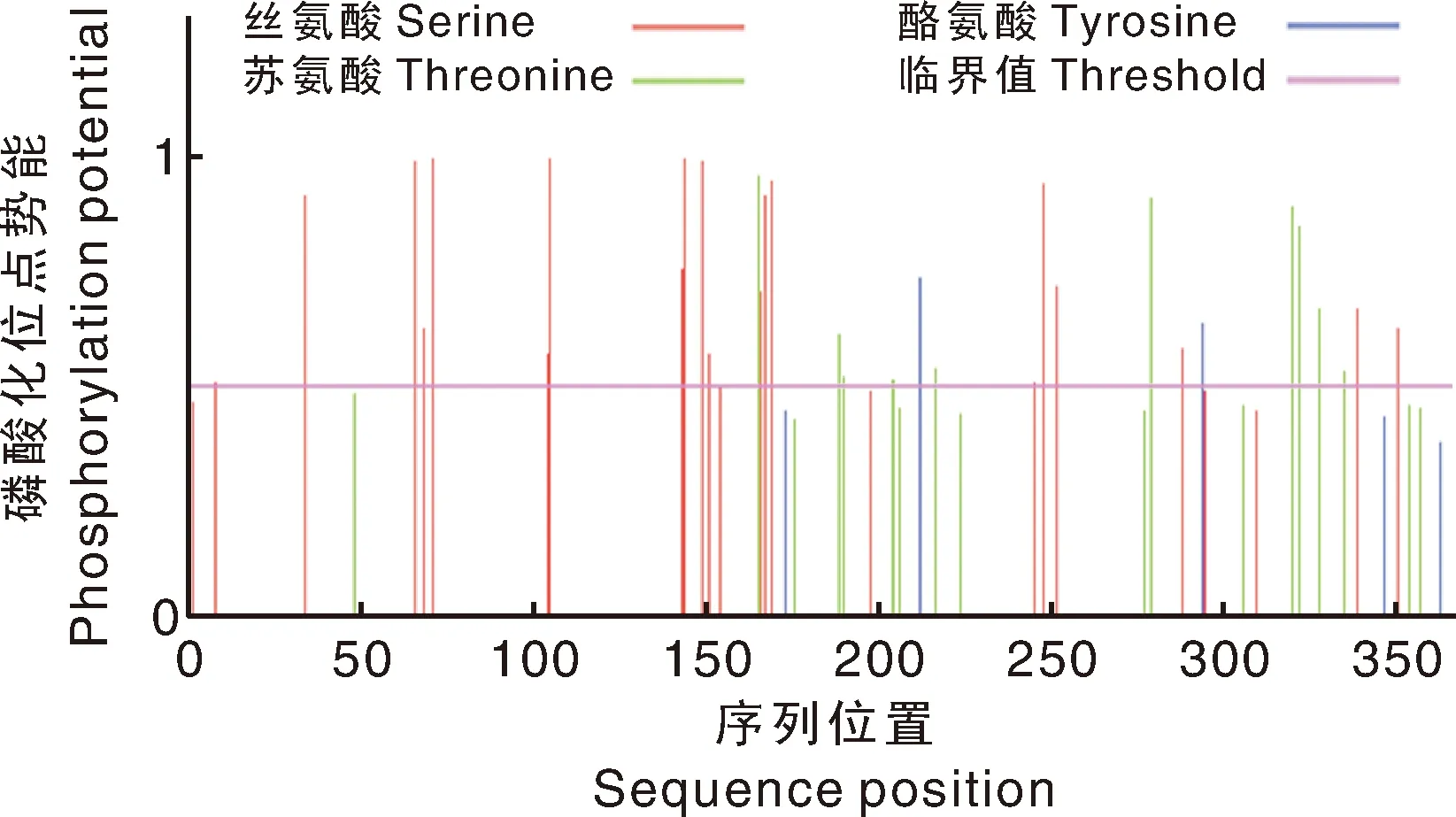
图8 撒坝猪MCUR1蛋白的磷酸化位点预测Fig.8 The predicted results of MCUR1 encoding protein phosphorylation sites

图9 撒坝猪MCUR1蛋白的二级结构Fig.9 Secondary structure of pig MCUR1 protein
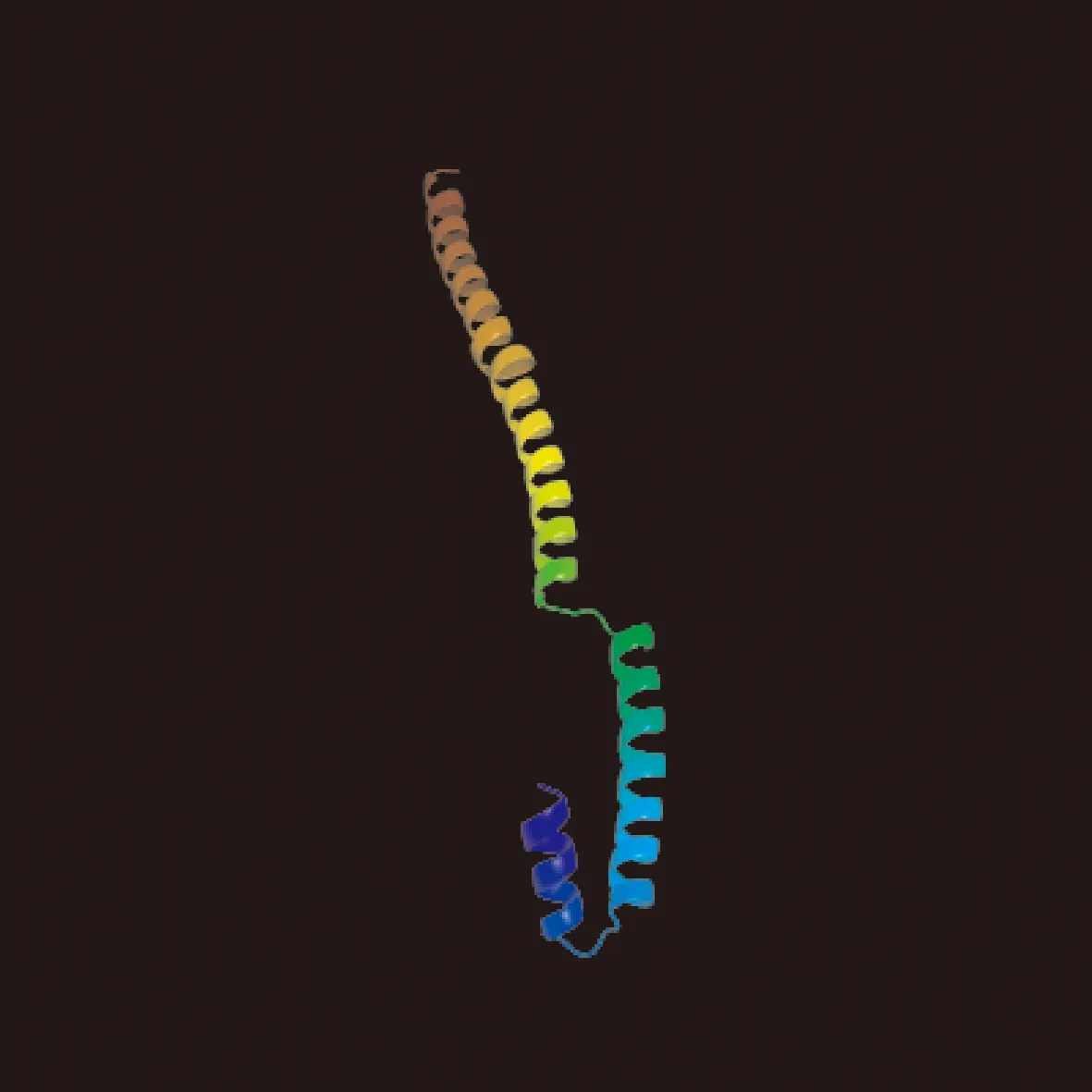
图10 撒坝猪MCUR1蛋白三级结构预测Fig.10 Tertiary structure prediction of MCUR1 protein
2.2.7 撒坝猪MCUR1基因同源性比对和系统进化树构建
使用MegAlign对牛(XM_024983732.1)、鸡(XM_418928.6)、狗(XM_418928.6)、山羊(XM_018039134.1)、人(NM_001031713.3)、猴(XM_010376415.1)、鼠(NM_001081059.3)、绵羊(XM_012115877.2)和猪(XM_005665577.3)的MCUR1基因编码序列进行同源性分析,结果显示(图11),猪MCUR1基因编码区序列与牛、鸡、狗、山羊、人、猴、鼠、绵羊的同源性分别为85.3%、68.0%、83.6%、87.9%、84.4%、80.3%、76.8%、88.2%。
用MEGA6.0软件对9个物种进行进化树分析,结果如图12:撒坝猪与绵羊、山羊、牛的亲缘关系较近,与鸡的关系较远。
2.2.8 撒坝猪MCUR1基因CpG Island预测
运用CpG Plot在线软件预测撒坝猪MCUR1基因的CpG Island,结果(图13)显示,撒坝猪的MCUR1在47~430碱基处有一个CpG Island。
2.2.9MCUR1基因组织表达分析
通过实时荧光定量PCR可知:撒坝猪MCUR1基因在不同组织中的表达量不同(图14),其中在肝脏中的表达量最多,在肺脏中的表达量最少。在大白猪的背最长肌中MCUR1的表达量高于撒坝猪的背最长肌(P<0.01)(图15)。
3 讨论
线粒体是细胞内主要的钙储存场所之一[10-11]。通过线粒体内膜的钙离子流对细胞的生物能、胞质内钙离子的信号转导以及细胞凋亡途径的激活都具有调控作用[12-20]。近年来,钙离子通道及相关蛋白成为研究热点,其中MCU、MCUR1和MICU1成为研究的主要对象。MCUR1主要与MICU1、MICU2、MCU形成复合体调节线粒体Ca2+转运。研究证实,MCUR1的缺失会导致线粒体Ca2+浓度严重降低,过表达MCUR1会显著促进线粒体Ca2+内流,提高线粒体对胞质Ca2+的缓冲能力[21]。MCUR1在维持正常细胞能量代谢中起重要作用,MCUR1的缺失会抑制细胞内氧化磷酸化,使细胞能量产生不足,而引起细胞的自噬[21]。有报道显示,MCUR1在肝癌细胞中的表达水平增加,进而增强线粒体Ca2+的摄取,抑制线粒体凋亡,从而促进肝癌细胞的增殖和存活[22]。原发性肝癌组织中,线粒体钙离子单向转运调节分子MCUR1基因表达异常增高,高表达MCUR1的肝癌细胞其静息水平的线粒体钙离子浓度明显上升,而过表达MCUR1不仅能够激活线粒体钙摄入,还能显著促进细胞生长[7]。在多发骨髓瘤(multiple myeloma,MM)患者体内,MCUR1基因表达上调,并通过抑制p53通路促进细胞增殖,抑制细胞凋亡。在分子机制方面,沉默MCUR1基因后,p53表达升高,p53下游凋亡关键分子BCL2(B-cell lymphoma-2)降低,提示MCUR1促进MM细胞增殖有可能是通过抑制p53的表达实现的。多发性骨髓瘤的病因与发病机制至今虽尚未阐明,但是MCUR1基因有望成为多发性骨髓瘤诊断和治疗的新靶点[23]。

图11 撒坝猪与9个物种MCUR1基因编码区同源性分析Fig.11 Homology analysis of MCUR1 gene CDS region between Saba pig and 9 kinds of species
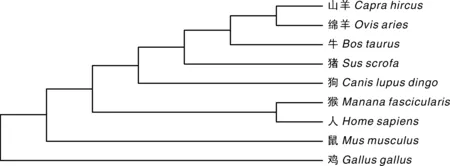
图12 基于9个物种MCUR1序列构建的系统树Fig.12 System tree based on the sequence of MCUR1 of 9 species

图13 撒坝猪MCUR1基因CpG Island预测Fig.13 Prediction of MCUR1 gene CpG Island in Saba pigs
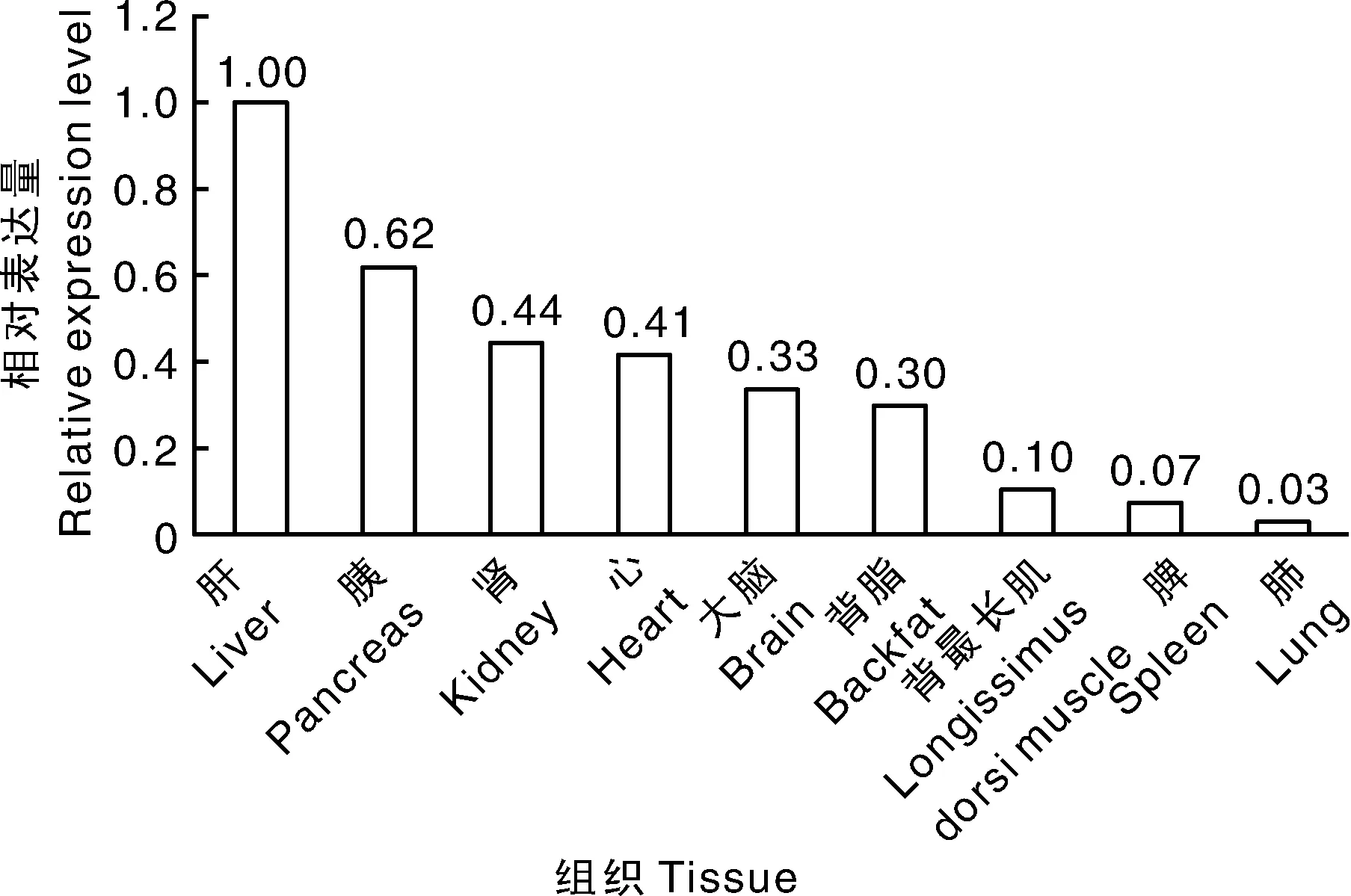
图14 MCUR1基因在撒坝猪不同组织中的表达量Fig.14 The expression of MCUR1 gene in different tissues of Saba pig
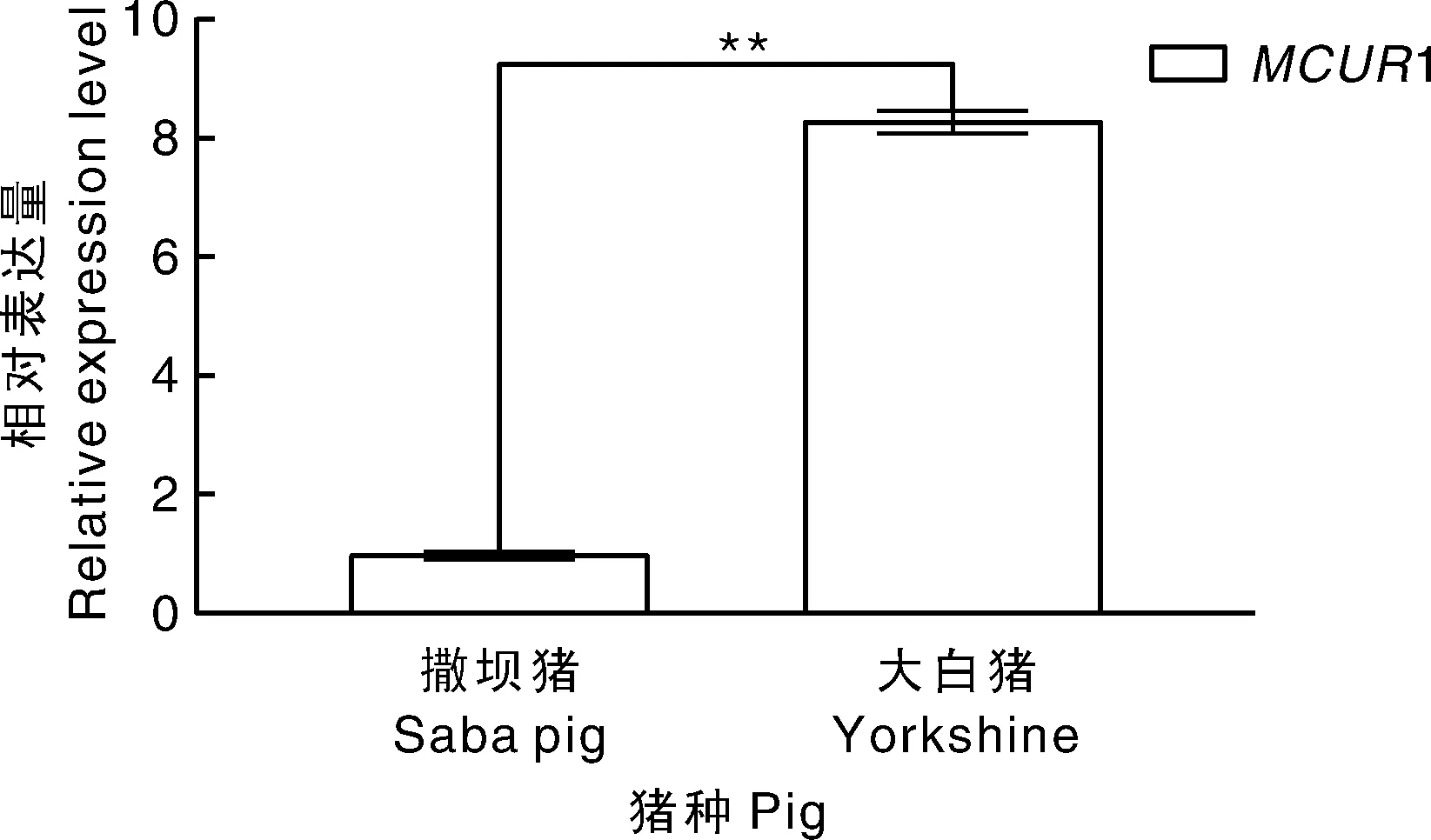
**表示差异极显著(P<0.01)。** indicated the significant difference (P<0.01).图15 MCUR1基因在撒坝猪和大白猪背最长肌中的表达量Fig.15 The expression of MCUR1 gene in Saba pig and Yorkshire
通过生物信息学分析显示:MCUR1蛋白属于亲水蛋白,没有信号肽,说明其不属于分泌蛋白;不存在跨膜结构,暗示该蛋白不是作为膜受体来发挥作用。亚细胞定位显示,MCUR1蛋白主要定位于细胞质,说明该蛋白主要在细胞质中发挥生物学功能。二级结构预测发现,MCUR1蛋白是以α螺旋为主的混合型结构蛋白,且结构较简单。在进化关系上,同源性分析和系统进化树分析都显示,猪MCUR1基因与山羊、绵羊和牛的亲缘关系是最近的。
细胞的生命活动中,线粒体Ca2+稳态至关重要。MCUR1作为线粒体Ca2+的调节者,在细胞正常生命活动及各种疾病中发挥重要作用。目前大部分关于MCUR1基因的研究主要集中在调控线粒体Ca2+的摄取来影响细胞能量代谢与肝癌等疾病发生的相关过程中,在猪体内的相关研究较少。本实验通过实时荧光定量PCR技术检测MCUR1基因在撒坝猪各个组织中的表达量发现:MCUR1在肝脏中的表达量最高,在肺脏中的表达量最低,推测猪体内的MCUR1基因主要在肝脏中发挥其生物学功能。检测该基因在大白猪和撒坝猪背最长肌中的表达量发现,MCUR1基因在大白猪背最长肌中的表达量高于撒坝猪的背最长肌中的表达量(P<0.01),大白猪相对于撒坝猪,其生长速度较快,这与本课题组通过简化基因组得到的MCUR1基因定位于生长性状相关功能上的信息一致。但是由于已有的研究结果有限,关于MCUR1基因在生长性状过程中发挥的具体作用仍不清晰,需要进行大量的后续试验来进行阐明。

